查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





花随水走,水载花流。
落花有意随流水,流水无心恋落花。
日日陪伴君左右,多情却被无情恼。
众所周知,乳酸脱氢酶LDH是临床检验中生化常规的必备之一。
每天盯着数以万计的检验指标,LDH也在你的面前晃了无数次。
但,你有真切感受到“此中有真意”吗?
接下来,就请大家跟着我好好走进一下这位一直被我们疏忽的“身边人”LDH的内心世界。你会惊呼,原来我们一直有这样一位有着倾国倾城容颜的每人在身旁暗恋着我们,但我们却冷落许久。
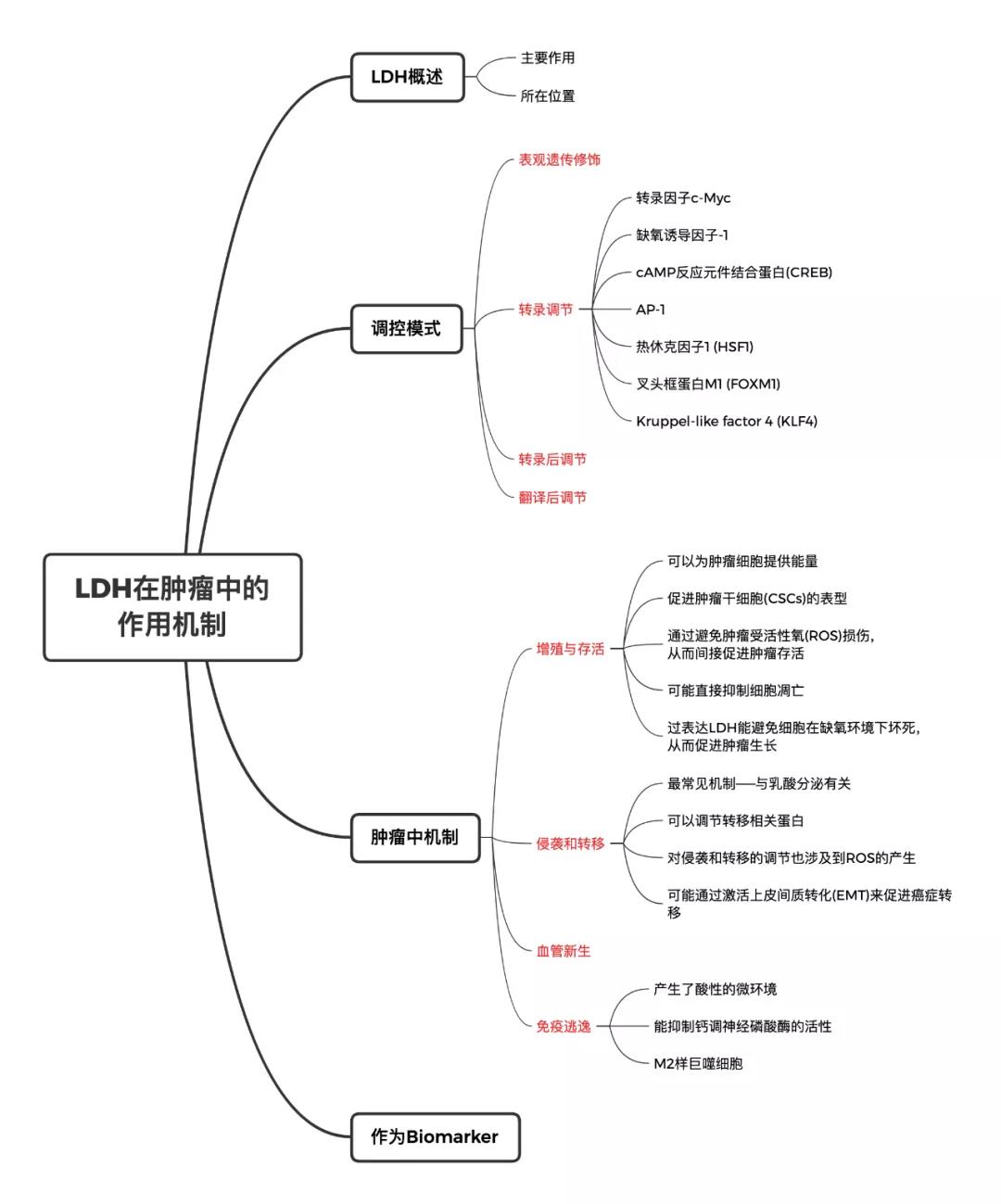
LDH概述
乳酸脱氢酶(lactate dehydrogenase, LDH)是烟酰胺腺嘌呤二核苷(nicotinamide adenine dinucleotide, NAD) 依赖性激酶,常见的A、B两种亚基可构成5种LDH同工酶(LDH1~5),C亚基仅仅组成一种LDH同工酶LDH-C4,又称为LDH-X。
LDH的亚基数量总共有LDH、LDHB、LDHC三种亚基,在人体内可构成6种四聚体同工酶。LDH的主要作用是将丙酮酸转化为乳酸,将NADH转化为NAD+。
LDH主要位于细胞质中,但在线粒体和细胞核中也发现了LDH。在细胞核外,LDH在糖酵解中发挥重要作用。而在细胞核内,LDH作为单链DNA结合蛋白(SSB)而发挥作用,可能参与了DNA复制和转录。
LDH的调控模式
第一,表观遗传修饰。LDH启动子中的甲基化修饰可以抑制LDH的表达。胶质瘤中突变的异柠檬酸脱氢酶(IDH)与野生型相比,LDH水平较低,其分子基础可能是IDH突变导致LDH启动子的高甲基化,抑制了LDH的表达。
第二,转录调节。LDH的启动子区域中可以与多种转录因子结合,进而产生不同的调节模式。
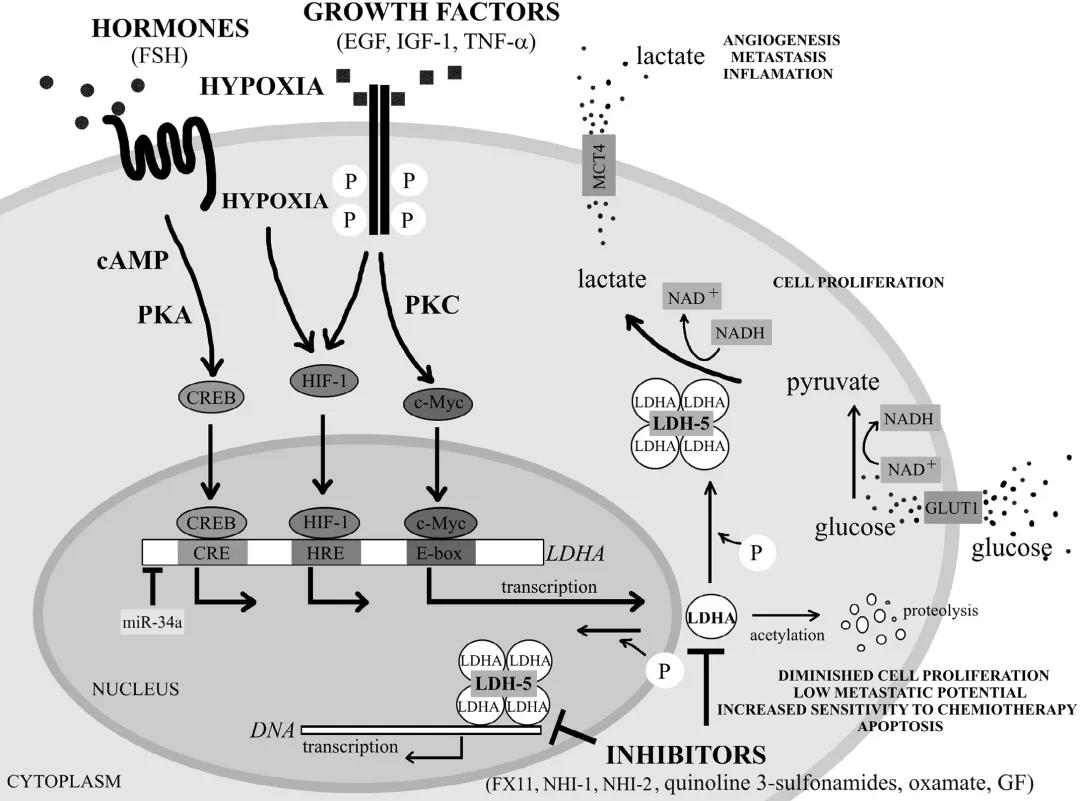
(图1 LDH的不同种转录调节模式)
(1)转录因子c-Myc。C-Myc在许多癌症中都是重要的癌基因。C-Myc可与Myc相关因子X (MAX)结合形成异源二聚体,从而与LDH启动子中的E-box(5’-CACGTG-3’)结合激活LDH表达。在胰腺癌中,c-Myc的表达与LDH呈正相关,敲减c-Myc可抑制LDH的表达,减少乳酸的生成和葡萄糖的消耗。而当LDH抑制了之后,观察到c-Myc的表达增加,表明LDH对c-Myc的表达具有负反馈作用。
(2)缺氧诱导因子-1 。HIF-1在处于缺氧状态时,该复合物与缺氧反应元件(HRE)结合以激活靶基因。在非小细胞肺癌,LDH与HIF-1α呈正相关。在LDH的启动子区域存在HRE,HIF-1α可以结合HRE(5’-RCGTG-3’)以促进LDH的表达。此外,c-Myc和HIF-1α还可以协同激活多种癌细胞中LDH的表达。
(3)cAMP反应元件结合蛋白(CREB)。一旦CREB被cAMP-PKA信号通路磷酸化, CREB可与含有5’-TGACGTCA-3’序列的cAMP反应元件(CRE)结合,从而启动靶基因的转录。LDH基因的启动子区域也具有高度保守的CRE序列。因此,LDH也可以被CREB调节。
(4)AP-1。12-O-tetradecanophorbol-13-acetate (TPA)可激活蛋白激酶C (PKC)信号通路,进而磷酸化转录因子激活蛋白-1 (AP-1)。该蛋白与TPA-response element (TRE)结合,能使靶基因表达。LDH基因的启动子区域具有TRE(5’-TGAG/CTCA-3’),所以LDH可以由AP-1进行转录调控。
(5)热休克因子1 (HSF1)。HSF是一种常见的转录因子,调节热休克蛋白(HSP)以恢复蛋白质内稳态。HSF1还可作为转录因子调控表达LDH,ErbB2可使LDH启动子区HSF1富集,提高LDH表达。
(6)叉头框蛋白M1 (FOXM1)。FOXM1属于叉头转录超家族,在启动子区域识别5’-TAAACA-3’重复序列,以介导靶基因的转录如参与细胞周期进程的靶基因。在胰腺癌中发现FOXM1水平与LDH呈正相关,而在胃癌中FOXM1与LDH启动子结合并促进其在胃癌中的转录。
(7)Kruppel-like factor 4 (KLF4)。KLF4是一种锌指转录因子,主要在上皮细胞的终末分化中表达。KLF4可以调控LDH的表达,KLF4与LDH水平呈负相关。KLF4结合于LDH的−371 ~−367 bp或−1310 ~−1306 bp启动子区域。
第三,转录后调节。有多个miRNA能通过与靶向LDH的mRNA的3’-UTR结合,可抑制靶点的翻译或促进其降解。有些miRNA还可以通过调节细胞因子来间接抑制LDH的表达。
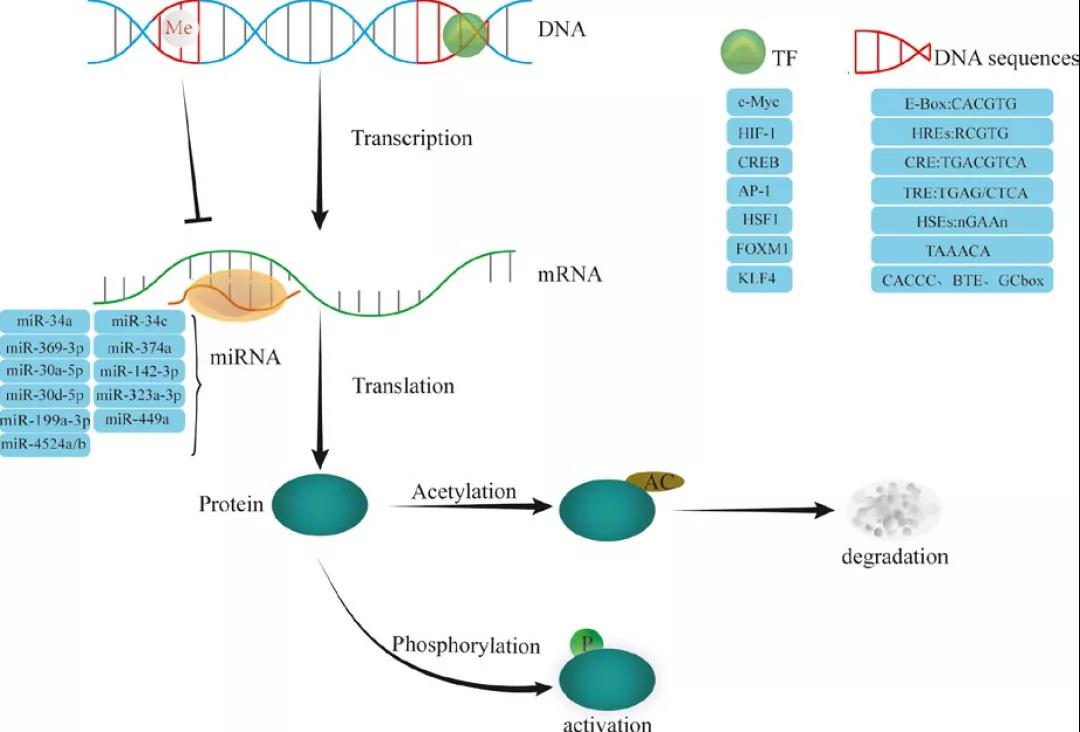
(图2 miRNA参与转录后调节)
第四,LDH也可以通过翻译后调节,例如特定氨基酸中的磷酸化和乙酰化。磷酸化显著增加了LDH的酶活性,与癌症进展有关。在乳腺癌中,Y10磷酸化引发LDH激活,促进癌细胞侵袭,增强抗脱落凋亡。赖氨酸乙酰还参与调控LDH活性。在胰腺癌中,LDH K5乙酰化水平的降低,激活LDH的酶活性,也抑制了LDH的降解。
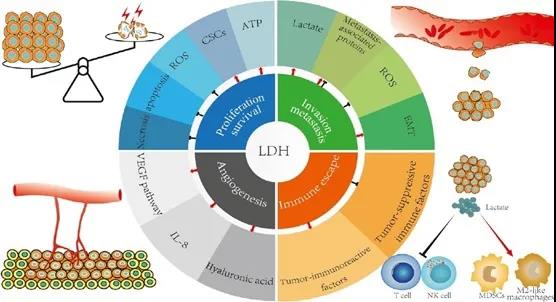
(图3 LDH在肿瘤中的生物学特性及作用机制)
LDH在肿瘤中增殖与存活
在部分肿瘤临床样本中可检测出LDH的表达上调,而LDH的下调在体外可抑制细胞的生长和迁移,并在体内影响肿瘤的发生。在具有高活性LDH的肿瘤细胞中,其分裂与存活的分子机制有多种可能性。
首先,LDH可以为肿瘤细胞提供能量。在正常氧条件下,下调LDH后细胞增殖率也下降;在低氧条件下,LDH缺乏的肿瘤细胞生长也受限。在测量了正常氧和低氧条件中LDH下调肿瘤细胞的三磷酸腺苷(ATP)水平,发现LDH活性降低的肿瘤细胞无法维持高ATP水平,导致细胞在常氧或低氧条件下增殖缓慢。
其次,LDH可以促进肿瘤干细胞(CSCs)的表型。有研究显示,LDH与八聚体结合转录因子4 (Oct-4)显著相关,在胚胎干细胞的自我更新中起到了重要作用。敲减LDH可在体内和体外降低Oct-4的表达与成瘤性。
同时,LDH通过避免肿瘤受活性氧(ROS)损伤从而间接促进肿瘤存活。抑制LDH使肿瘤细胞通过氧化磷酸化产生ATP,线粒体ROS进而升高。所以有学者基于此,提出了一种通过LDH诱导肿瘤细胞凋亡的模型,即抑制LDH从而诱导ROS的产生和胞浆Ca离子的释放,进而降低线粒体内膜的电位差,激活Caspase 9和Caspase 3, 最终诱导细胞凋亡。
此外,LDH可能直接抑制细胞凋亡。LDH敲减后,凋亡蛋白XIAP、Bcl-2等蛋白减少,使得异种移植模型中细胞的成瘤性降低。
最后,过表达LDH能避免细胞在缺氧环境下坏死,从而促进肿瘤生长。过表达LDH和Rcl的肿瘤坏死区域比过表达Rcl和血管内皮生长因子(VEGF)的坏死区域要小。可见,LDH表达升高可保护中央区肿瘤细胞免于缺氧诱导的坏死。
LDH在肿瘤中侵袭和转移
侵袭和转移是恶性肿瘤进展的显著特征,LDH在肿瘤侵袭和转移的机制作用主要可能有以下几点。
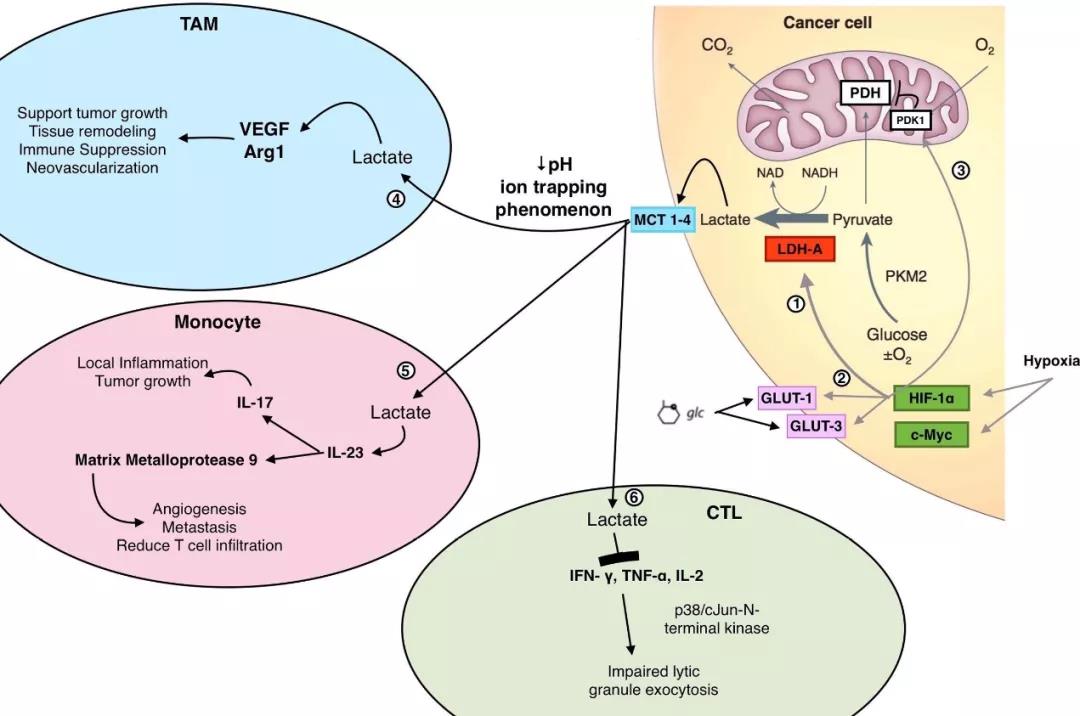
第一,LDH调节细胞迁移和侵袭的最常见机制与乳酸分泌有关。有研究表明,乳酸水平与远处转移的发生率有关,高浓度乳酸与癌症早期远处转移率有关。外源性乳酸可增强肿瘤细胞的运动性和不同细胞系的随机迁移性。乳酸对转移的影响主要包括通过酸性微环境激活基质金属蛋白酶(MMPs)和组织蛋白酶,上调VEGF、低氧诱导因子HIF-1α和转化生长因子(TGF-2),以及直接增强细胞的迁移能力。
第二,LDH可以调节转移相关蛋白。敲减LDH可降低粘附斑激酶(FAK)、基质金属蛋白酶-2 (MMP-2)和VEGF的表达,同时增加E-cadherin的表达。从中可见,LDH可能通过调控这些细胞过程中的关键角色来影响肿瘤的迁移和侵袭。比如,刺激产生MMP-2来诱导细胞外基质降解、上调VEGF来促进肿瘤转移的血管新生、抑制E-cadherin来抑制细胞粘附。
第三,LDH对侵袭和转移的调节也涉及到ROS的产生。在黑色素瘤中,抑制LDH所导致线粒体ROS的积累,可能通过氧化的方式改变原肌球蛋白的结构。这样一来,改变的原肌球蛋白可能抑制了其促进肌动蛋白重构的能力,进而导致黑色素瘤迁移减少。使用了抗氧化剂NAC治疗后,LDH下调引起的迁移抑制和细胞骨架损伤可以有部分受到缓解。
第四,LDH还可能通过激活上皮间质转化(EMT)来促进癌症转移。在膀胱癌中,下调LDH后Snail、N-cadherin、纤连蛋白和Vimentin表达减少,E-cadherin表达增加,从而抑制肿瘤细胞的侵袭。
LDH在肿瘤中血管新生
LDH可调节肿瘤血管生成。LDH的表达与VEGF信号通路的激活呈正相关,也与血管内皮生长因子受体2 (VEGFR2)磷酸化的激活显著相关,这些激活的VEGF/ VEGFR2信号可以显著促进血管新生。
从机制方面来说,LDH对血管生成的调节主要依赖于乳酸。肿瘤微环境中酸化能促进IL-8和VEGF的产生。乳酸可刺激内皮细胞产生VEGF并诱导新生血管形成,血管内皮细胞受乳酸刺激后引起IκBα磷酸化/降解,激活核转录因子NF-κB,促进IL-8表达增加,从而加速血管新生和肿瘤生长。此外,乳酸还可以通过增加透明质酸而促进血管生成。
LDH在肿瘤中免疫逃逸
肿瘤在机体内能得以生存及转移,离不开其能逃离免疫监控这一特殊的免疫逃逸特性。高表达的LDH在其中起到了“推波助澜”的作用。LDH通过抑制免疫的杀伤作用和促进免疫的抑制作用从而介导肿瘤免疫逃逸。有研究证实,在人黑色素瘤中,LDH的表达与T细胞激活标记物体如颗粒酶K (GZMK)和CD25呈负相关。低表达LDH肿瘤中的细胞毒性T细胞数量多于高表达LDH的肿瘤细胞。
要想理解LDH在免疫逃逸的作用机制,首先我们先明确“肿瘤微环境”这一概念。
肿瘤微环境是指肿瘤的发生、生长及转移与肿瘤细胞所处的内外环境有着密切关系,其微环境中不仅包括肿瘤所在组织的结构、功能和代谢,而且也与肿瘤细胞自身的内在环境有关。在肿瘤微环境中,有具有免疫抑制细胞与免疫应答细胞。而肿瘤之所以能逃离免疫监控,与免疫抑制的细胞密不可分。肿瘤相关巨噬细胞(TAMs)与髓系来源抑制性细胞(MDSCs)就属于免疫抑制细胞,处于肿瘤微环境中。
(图4 肿瘤免疫应答过程)
LDH抑制免疫的主要机制是增加乳酸的分泌量,破坏免疫因子的功能。
首先,乳酸分泌量增加产生了酸性的微环境,抑制了免疫活性细胞产生IFN-γ。在黑色素瘤中,高表达LDH的导致乳酸分泌量增加,酸性微环境使T细胞和NK细胞中的NFAT下调,进而导致IFNγ减少,减弱肿瘤中T细胞和NK细胞的浸润。乳酸同时可以促进了IL-23的表达和分泌,也阻碍了肿瘤微环境中CD8+ T细胞的浸润。这些最终都引起肿瘤的免疫抑制。
其次,酸性微环境能抑制钙调神经磷酸酶的活性,进而干扰NFAT的核转位,影响肿瘤免疫。乳酸还会抑制甘油醛-3-磷酸脱氢酶(GAPDH)的糖酵解功能,使其与IFN-γ mRNA结合,从而阻止IFN-γ的翻译。
前面提到的肿瘤微环境中的一部分TAMs可以被乳酸诱导极化为M2样巨噬细胞,这是一种可促进癌症进展的巨噬细胞。而乳酸也能通过上调HIF-1α促进M2样巨噬细胞的形成。肿瘤微环境中的MDSCs还能抑制T细胞和NK细胞的功能,抑制免疫应答。乳酸脱氢酶所致的乳酸积累也可增加肿瘤免疫逃逸中MDSCs的数量。
甚至更有研究称乳酸能直接引起T细胞和NK细胞的凋亡。
LDH在肿瘤中作为Biomarker
乳酸脱氢酶(LDH)存在于细胞中。当细胞受损时,它们被释放到血液中。因此,血液中LDH水平通常作为组织损伤的指标。由于肿瘤生长破坏组织,血清LDH水平在癌症诊断中也具有重要意义。一般来说,血清LDH通常在造血系统恶性肿瘤如霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤(NHL)中升高,在实体恶性肿瘤中也有升高的表现。肿瘤转移可导致LDH水平升高,提示LDH可能是一种潜在的癌症诊断标志物。
同时,LDH可作为恶性肿瘤预后的指标。LDH作为国际预后指数(IPI)的危险因素之一,是侵袭性淋巴瘤患者生存的强预测因子。除血清LDH外,组织中的LDH常被用作肿瘤诊断和恶性肿瘤的生物学指标,可以观察到肿瘤组织中LDH水平的上调,这与转移、肿瘤分期、肿瘤复发和患者生存有关。
值得注意的是,肿瘤组织中LDH的表达与血清LDH水平并不是完全一致的,这可能表明肿瘤LDH表达和血清LDH水平是两个独立的肿瘤预测因子。肿瘤组织中LDH低表达的患者血清LDH水平往往较低,但只有29%的LDH高表达患者血清LDH水平升高,71%的LDH高表达患者血清LDH水平正常。
所以,如我们本文开头所提到的,临床生化指标看到的LDH,并不完全等同于恶性肿瘤中的LDH。但是,血清水平的LDH可以与组织水平的LDH相互补充,发挥联合作用。
这就是我们所一直“熟视无睹”藏匿于我们身边的“绝代佳人”。
落花有意,流水无情;LDH有情,我等却疏忽大意。
作为一个天天和我们打交道的“尤物”,其身上蕴含的值得研究的方面还有许多,各种基金、课题都可以值得考虑一番,还愁找不到方向吗?
来源:解螺旋
查看更多