查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





免疫治疗是肿瘤学发展进程中的革命性突破,为全世界肿瘤患者带来了新的曙光,并逐渐成为肿瘤治疗的基石性手段。由百济神州自主研发、结构优化,唯一对Fc段成功改造的创新型PD-1替雷利珠单抗(百泽安®),自2019年12月获得国家药品监督管理局(NMPA)批准上市至今,已获批五大适应证,且其中两项成功纳入2020版国家医保药品目录。期待晚期鳞状非小细胞肺癌一线、晚期非鳞状非小细胞肺癌一线及至少经过一种全身治疗的肝细胞癌的治疗,这三大适应证能够增补进入2021国家医保药品目录,给国内肿瘤患者带来可负担的治疗新选择!特别是在晚期鳞状非小细胞肺癌一线治疗领域,尚未有PD-1药物进入其中,作为该领域免疫治疗新标准,替雷利珠有望凭借其成功的结构优化、高效低毒的临床优势和良好的可及性填补这一空白,为满足广大肿瘤患者的迫切需求贡献力量。本文将从替雷利珠单抗的结构特点出发,揭示其临床治疗特性,为临床探索的推进奠定基础。
不落窠臼
阻断PD-1与PD-L1结合势在必行
细胞程序性死亡-1(PD-1)是一种细胞表面受体,表达在活化的T细胞上,而其配体PD-L1和PD-L2经常被肿瘤细胞过度表达,以逃避免疫监视、检测和消除。针对免疫检查点抑制受体PD-1的单克隆抗体在多种恶性肿瘤患者中表现出了不同的临床疗效。然而,由于仅仅通过检查点调节抗体阻断免疫抑制通路,导致了临床中许多肿瘤对治疗反应不佳。追本溯源,这些免疫调节抗体为更好地与目标抗原结合,在设计之初主要识别部位为抗体的理想片段抗原结合(Fab)区域[1]。然而,随着研究的逐步深入,最新研究结果显示结晶片段(Fc)与Fcγ受体(FcγRs)相互作用对于免疫调节抗体介导的体内活动亦十分重要。Fc可以使IgG抗体具有效应功能,包括抗体依赖的细胞毒性(ADCC),补体依赖的细胞毒性(CDC)、抗体依赖性细胞吞噬(ADCP)等。我们的人体存在着四种同型IgG(IgG1-4),并且每一个IgG亚类都有独特的结合效应受体。而在IgG4铰链区中存在着S228这样一个特殊结构,它允许可互换的二硫键构型和形成“半抗体”[2],帮助IgG4通过Fc-铰链区与FcγRI呈现出显著的高亲和力。目前临床应用的大多数mAb,都具有IgG4S228P重链,保留了类似于野生型人IgG4的效应结合功能。而PD-1抗体与FcγRI的结合会导致表达PD-1的效应T细胞和表达FcγRI的巨噬细胞之间发生交联,而大部分抗PD-1抗体可能会因此降低疗效[3]。
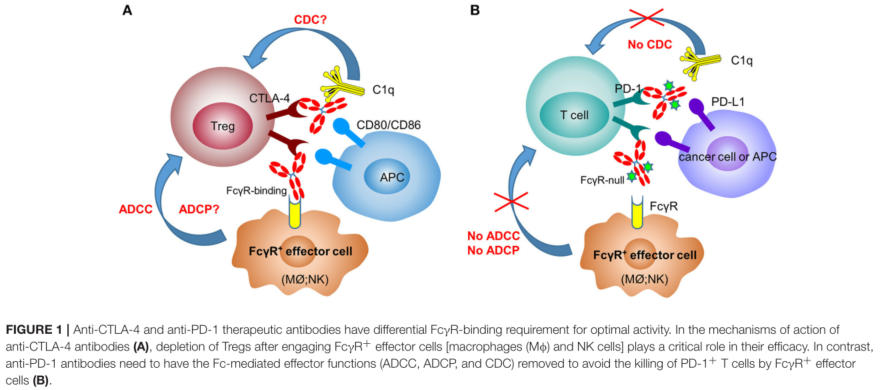
图1 抗CTLA-4抗体和抗PD-1抗体不同作用机制
独树一帜
更多的结合位点,更低的解离速率,更强的抗肿瘤活性
独特机制:Fc段成功改造
替雷利珠单抗成功对Fc段进行基因工程改造,能够最大限度地减少与巨噬细胞中的FcγRs结合,最大程度上保留效应性T细胞数量及功能,因此抗肿瘤活性更强。
独特机制:优化Fab段
替雷利珠单抗抗体结合片段(Fab段)与PD-1拥有更高亲和力,更多结合位点,可更大范围,持久阻断,预示疗效更好。
通过结晶替雷利珠单抗Fab片段与PD-1的胞外域,并经结构生物学和表面等离子体共振(SPR)分析实验证实(图2),PD-1的V64、N66、Q75、T76A、D77、K78、R86、I126和L128残基是替雷利珠单抗的关键表位,并且值得注意的是,突变Q75A、T76A、D77A和R86A仅显著影响替雷利珠单抗的结合。由此我们可以推断,与目前多数抗体不同,PD-1的Q75、T76、D77和R86残基为替雷利珠单抗的独特结合表位[4]。
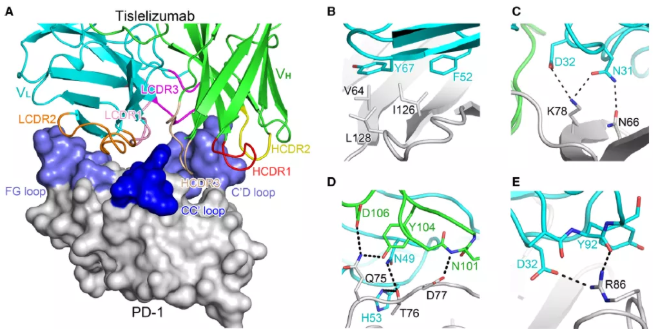
图2 替雷利珠单抗与PD-1之间的详细相互作用和SPR研究总结
通过对于使用替雷利珠单抗和带有S228P突变的替雷利珠单抗变体研究证实[5],FcγRI可与替雷利珠单抗 S228P变异体结合,但不能结合替雷利珠单抗。在体外对2型巨噬细胞(M2)和PD-1+ T细胞的研究也发现[6],与替雷利珠单抗 S228P变体孵育的巨噬细胞对T细胞的吞噬作用依赖于抗体;相反,与替雷利珠单抗孵育的细胞显示出与对照抗体(不与FcγRI结合)类似的基线抗体依赖的细胞吞噬活性。进一步证实了,替雷利珠单抗利用其关键表位Gln75、Thr76、Asp77和Arg86的相关特性提高了特异性和亲和力,极大地降低了解离速率[3]。
此外通过细胞P3Z检测显示[5],替雷利珠单抗会与PD-L1竞争性结合。这主要依赖于替雷利珠单抗的轻链可变区(VL),它可直接占据PD-L1与PD-1结合的位置(图3)。对PD-1结合表面的详细分析显示,替雷利珠单抗与PD-1的结合面与PD-1/PD-L1结合面的重叠面积高达80%。这些结果表明,替雷利珠单抗可能在与PD-1结合时提供对PD-L1的最大空间消除,保证T细胞能在免疫治疗中发挥更大作用。

图3 替雷利珠单抗完全阻断PD-1
正是由于独特的结合特性,替雷利珠单抗在B16F10/GM-CSF小鼠模型中也表现出了优异的抗肿瘤效果。在研究过程中,SPR分析揭示了替雷利珠单抗是首个针对PD-1 CC’环的抗PD-1抗体,并以此证实,若要与PD-L1结合,CC’环是PD-1的必备结构[4]。以上这些研究再次拓宽了我们对替雷利珠单抗作用机制的理解,并为进一步开展临床研究奠定了坚实基础。
及之而后知
结构优势与临床获益密不可分
为检验替雷利珠单抗在中国成年(≥18岁)晚期实体瘤患者中的安全性、耐受性和抗肿瘤活性。在全国16个中心开展了一项Ⅰ/Ⅱ期研究[7](CTR20160872),该研究纳入了300例患者。Ⅰ期试验包括剂量验证和药代动力学(PK)研究;Ⅱ期试验是一项扩大适应证的研究,包括11个实体肿瘤队列。在剂量验证期间,监测剂量限制毒性(DLT);对安全性和耐受性进行了检测,并验证了先前确定的推荐Ⅱ期剂量(RP2D)。Ⅱ期试验的主要终点则是研究者根据实体肿瘤疗效评价标准评估的客观缓解率(ORR)。最终研究结果显示,在Ⅰ期研究中,替雷利珠单抗总体耐受性良好,也未观察到突发安全事件。报告的最常见的紧急不良反应(TEAE)是贫血和肝功能异常。与替雷利珠单抗有关的大部分不良反应(AEs)的严重程度一般≤2级,且没有观察到新的免疫相关安全信号,这与先前研究中观察到的替雷利珠单抗以及其他mAb总体安全性是一致的。同时Ⅱ期研究显示,替雷利珠单抗在多种实体瘤,包括肝细胞癌(HCC)、胃癌(GC)、鼻咽癌(NPC)、非小细胞肺癌(NSCLC)、食管鳞状细胞癌(ESCC)和黑色素瘤等中显示出了初步的抗肿瘤活性,且耐受性良好(图4)。支持了替雷利珠单抗在肿瘤治疗中开展进一步研究。
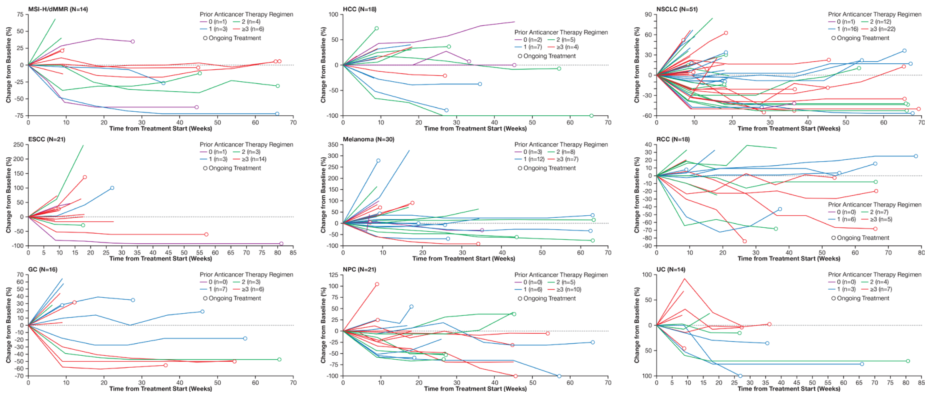
图4 靶病灶直径总和较基线的变化
为探索替雷利珠单抗在更多人群中治疗的安全性/耐受性、PK和初步的抗肿瘤活性,在来自澳大利亚、韩国、新西兰和中国(台湾地区)的451名患者中开展了一项ⅠA/ⅠB研究[8](NCT02407990),结果显示,替雷利珠单抗总体耐受性良好,安全性/耐受性与其他抗PD-1抗体一致。研究中观察到的大多数替雷利珠单抗相关AEs的严重程度为1-2级;只有9%的患者出现≥3级AEs。单药替雷利珠单抗在多个实体瘤的临床治疗中也显示了良好的安全性和耐受性,并在≥10%的患者中诱导了持久的临床疗效;此外,在PD-L1+或PD-L1−的肿瘤患者中均观察到了这些反应;但还需要进一步研究PD-L1的预测价值,并针对不同的肿瘤类型优化诊疗手段。
目前,替雷利珠单抗已在国内外开展了多项国际多中心临床研究,无论是单药还是联合治疗,或是在多个瘤种的各线治疗之中,结果都令人欣喜。也证实了替雷利珠单抗成功的结构改造可以助益取得良好的疗效与安全性。在临床治疗方面,替雷利珠单抗重点关注我国高发瘤种,在复发或难治性经典型霍奇金淋巴瘤、局部晚期或转移性尿路上皮癌、一线晚期鳞状非小细胞肺癌、一线晚期非鳞状非小细胞肺癌以及至少经过一种全身治疗的肝细胞癌,这五大适应证已获得国家药品监督管理局(NMPA)批准。今年3月,国家人力资源和社会保障部更新的国家基本医疗保险、工伤保险和生育保险药品目录(国家医保目录)正式落地执行[9],替雷利珠单抗在复发或难治性经典型霍奇金淋巴瘤和局部晚期或转移性尿路上皮癌治疗领域成功实现医保报销,让更多肿瘤患者以更加实惠的价格享受到优秀国产抗肿瘤新药带来的治疗红利。这一张张亮眼的成绩单,增强了临床医生和肿瘤患者抗击病魔的信心与斗志。期待替雷利珠单抗以下三项适应证能够增补进入2021国家医保目录,它们分别为:晚期鳞状非小细胞肺癌一线、晚期非鳞状非小细胞肺癌一线及至少经过一种全身治疗的肝细胞癌的治疗。此次增补一方面有望填补晚期鳞状非小细胞肺癌一线治疗领域PD-1单抗医保覆盖的空白,有力提高基本医保药品的保障能力;另一方面可更好地满足广大肿瘤患者的基本用药需求,保障更多适应证人群享受到医保的惠民价格,助力解决患者看病就医的后顾之忧,为患者带来更多治疗希望。
参考文献(向下滑动查看更多)
[1] Xin Chen, Xiaomin Song, Kang Li,et al. FcγR-Binding Is an Important Functional Attribute for Immune Checkpoint Antibodies in Cancer Immunotherapy[J].Front Immunol. 2019, Feb 26(10):292.
[2] Rony Dahan, Emanuela Sega, John Engelhardt, et al. FcγRs Modulate the Anti-tumor Activity of Antibodies Targeting the PD-1/PD-L1 Axis[J].Cancer Cell. 2015 Sep;28(3):285-295.Drugs
[3] Arnold Lee, Susan J Keam, et al. Tislelizumab: First Approval[J]. 2020 Apr;80(6):617-624.
[4] Yuan Hong, Yingcai Feng, Hanzi Sun, et al. Tislelizumab uniquely binds to the CC’loop of PD-1 with slow-dissociated rate and complete PD-L1 blockage[J].FEBS Open Bio. 2021 Mar;11(3):782-792.
[5] Dai X, Jayapal M, Tay HK, et al.Differential signal trans-duction, membrane trafficking, and immune effector functions mediated by FcgammaRI versus FcgammaRIIa[J]. Blood. 2009 Jul;114(2):318-327.
[6] Leidi M, Gotti E, Bologna L, et al. M2 macrophages phagocytose rituximab-opsonized leukemic targets more efficiently than m1 cells in vitro[J]. J Immunol. 2009 Apr;182(7):4415-4422.
[7] Lin Shen, Jun Guo, Qingyuan Zhang, et al. Tislelizumab in Chinese patients with advanced solid tumors: an open-label, non-comparative, phase 1/2 study[J].J Immunother Cancer. 2020 Jun;8(1):e000437.
[8] Jayesh Desai, Sanjeev Deva, Jong Seok Lee, et al. Phase IA/IB study of single-agent tislelizumab, an investigational anti-PD-1 antibody, in solid tumors[J].J Immunother Cancer. 2020 Jun;8(1):e000453.
[9] 医保发〔2020〕53号《国家基本医疗保险、工伤保险和生育保险药品目录(2020年)》.
查看更多