查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





原发性肝癌是我国常见的消化系统肿瘤,肝细胞癌(HCC)是其主要病理类型,乙型肝炎是我国HCC最常见的致病因素。近年来,免疫与靶向治疗的逐渐丰富、局部与系统治疗的强强联合,不断刷新着患者的生存获益。
本期将分享1例初诊合并门静脉癌栓的HCC病例,患者应用了HAIC+免疫(替雷利珠单抗)联合靶向(仑伐替尼)治疗2周期后成功转化,后进行手术治疗,术后病理提示达pCR。术后至今已达5月,定期随访,未见复发征象。(病例点评专家:毛帅教授;病例分享专家:何强教授)
何强教授
中山大学附属第一医院肝胆外科
东院肝胆外科主任 大外科主任
广东省肝脏病学会胆胰疾病专业委员会主委、综合素质治疗委员会副主委、外科手术专业委员会常委
广东省医学会肝胆胰外科学分会围手术期管理及加速康复学组副主委
广东省健康管理学会肝胆病学专业委员会常委
广东省抗癌协会转移癌专业委员会常委
广东省医师协会肝病分会常委
消化肿瘤杂志编委
毛帅主治医师
中山大学附属第一医院东院肝胆外科
医学硕士,毕业于中山大学附属第一医院
在国际专业期刊发表SCI论文及国内专业期刊多篇,其中第一作者或通讯作者SCI论文2篇
参与广州市科技创新发展专项资金项目各1项
从事肝胆外科学相关科研及临床工作多年,擅长临床常见病如肝胆肿瘤、胰腺癌、肝内外胆管结石的诊治
一般资料:患者男性,66岁,于2021年4月就诊。
主诉:消瘦1年余,右上腹胀痛4天。
既往史:慢性乙型病毒性肝炎及糖尿病病史。
个人史、家族史:无特殊。
ECOG PS评分:0分。
实验室检查:AFP>80000ug/L;Child-Pugh评分:5分 A级。吲哚靛青绿储留率(ICG R15):6.4%;左半肝体积:303ml,残肝占比:28.1%。
腹部超声造影(2021-04-14):肝内病变,考虑HCC伴门静脉右支、肝右静脉癌栓形成。如图1所示。
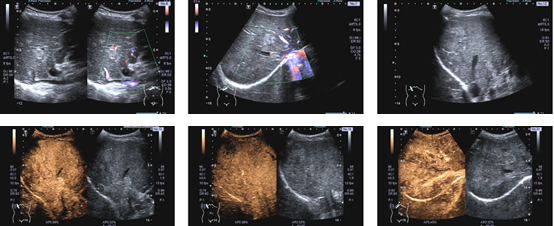
图1 治疗基线腹部超声造影
胸部+全腹CT(2021-04-13):肝右叶多发异常密度影,考虑恶性肿瘤合并灌注异常,考虑肝细胞癌可能,门静脉右支及分支、肝右静脉癌栓形成。如图2所示。
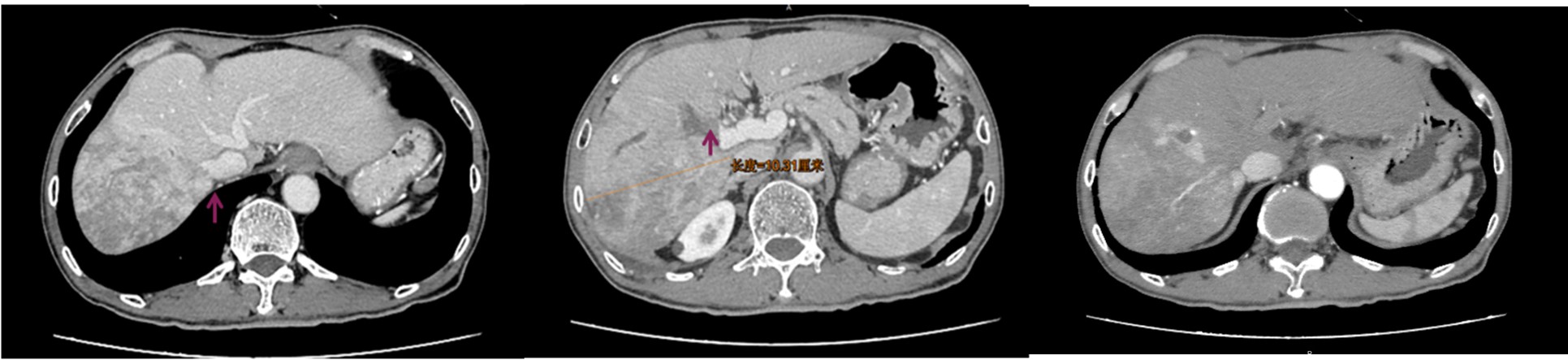
图 2:治疗基线胸腹部CT
诊断:肝细胞癌,BCLC C期,CNLC Ⅲa期
治疗方案:2021-04至2021-06 共行2个疗程肝动脉灌注化疗(HAIC)+替雷利珠单抗+仑伐替尼治疗。
临床复查及疗效评价:AFP由>80000ug/L降至1651ug/L, ICG R15由6.4%降至5.5%,左半肝体积由303ml升至346ml,残肝占比由28.1%升至31%,腹部CT病灶较前缩小,如图3所示。疗效评价为部分缓解(PR)。
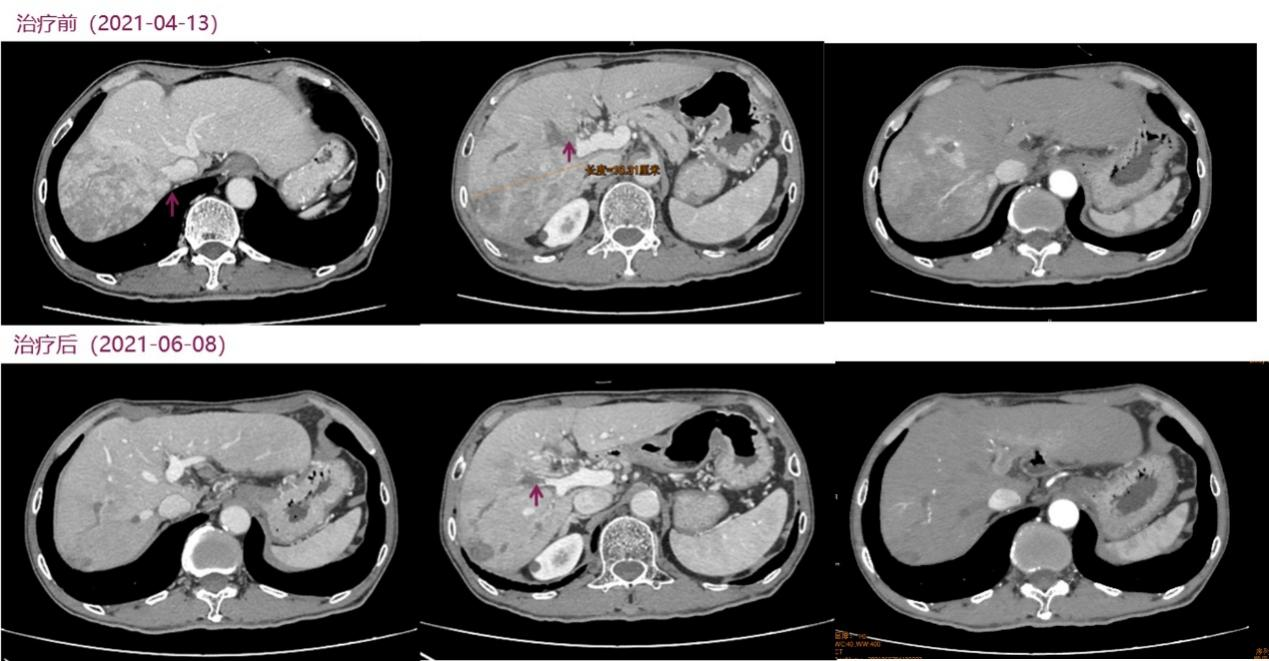
图 3:转化治疗后复查胸腹部CT变化
治疗方案:2021-06-21行右半肝切除+胆囊切除术,手术顺利。如图4所示。
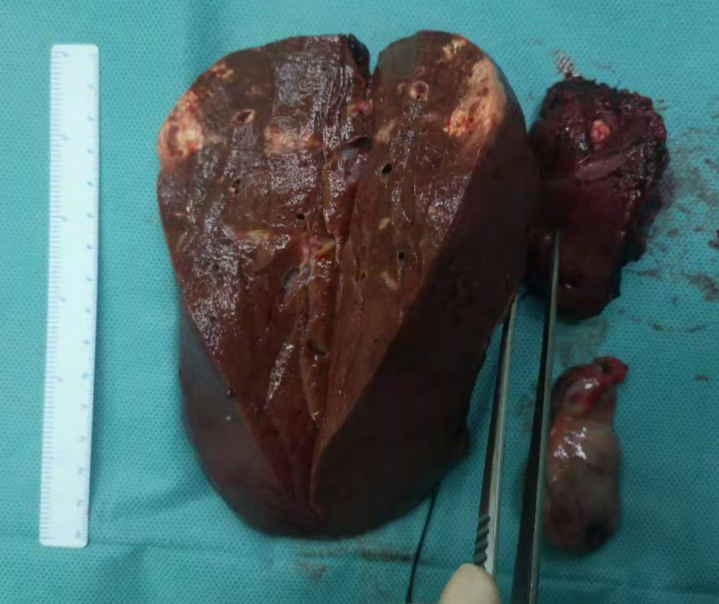
图 4:手术切除组织
术后病理:送检肝组织、肝右静脉进第二肝门处组织、胆管内组织及胆囊均未见存活肿瘤组织,病理学完全缓解(pCR)。
术后随访:术后1个月复查时AFP 7.5ug/L,影像学未见肿瘤复发征象,开始应用仑伐替尼辅助治疗;截至发稿,患者一般情况良好,未见肿瘤复发征象。
本例患者老年男性,既往乙肝病史多年,因“消瘦1年余,右上腹胀痛4天”就诊并确诊肝细胞癌,BCLC C期,CNLC Ⅲa期。经评估后选择先行转化治疗,行2个疗程HAIC+仑伐替尼+替雷利珠单抗治疗后病灶较前缩小,成功进行手术治疗。术后病理达pCR。术后继续辅助治疗,截至发稿(术后4月余)未见复发征象。
原发性肝癌是我国常见的消化系统肿瘤,肝细胞癌(HCC)是其主要病理类型,占比约90%[1]。乙型肝炎是我国HCC最常见的致病因素,乙型肝炎占病毒相关肝癌的75%至80%,而丙型肝炎约占10%至20%[2]。晚期HCC患者可选择的治疗方式有限,预后不理想,仍需要更创新的手段延长生存期改善生活质量。
近年来,以程序性死亡受体-1(PD-1)和细胞毒T淋巴细胞相关抗原4(CTLA-4)为靶点的多个免疫检查点抑制剂在HCC治疗上取得较大进展,为HCC患者带来新的治疗希望。免疫检查点通过与肿瘤表面抗原结合抑制肿瘤免疫应答,成为肿瘤免疫逃逸的机制。而免疫检查点抑制剂通过抑制检查点介导的信号传导,重新激活肿瘤特异性T细胞,发挥抗肿瘤作用[3],PD-1位于T细胞表面,也在活化的B细胞表和髓样细胞上表达,能够负调节免疫反应并维持外周自身耐受[4],研究表明,肝癌患者PD-1受体在肝脏浸润淋巴细胞中高表达,且在肿瘤组织中明显高于肿瘤临近组织或肝硬化组织[5-6],因此,PD-1抑制剂可重新激活T细胞,正向调节机体免疫应答,释放炎症细胞因子和细胞毒性颗粒达到杀死肿瘤细胞的效果。CheckMate-040[7]和KEYNOTE-224[8]研究证实了PD-1抑制剂在晚期肝癌患者的治疗效果。
免疫与靶向治疗的联合,就作用机制而言,抗血管生成小分子酪氨酸激酶抑制剂(TKI)能够逆转肿瘤免疫抑制微环境,PD-1抑制剂可重新激活T细胞,两者联合,可达到“1+1>2”的杀伤肿瘤效果。正如KEYNOTE-524研究[9]中,PD-1抑制剂联合TKI在不可切除HCC中显示了良好的协同增效作用,客观缓解率(ORR)和疾病控制率(DCR)分别达46%和88%。基于此,对于晚期肝细胞肝癌患者,PD-1抑制剂联合靶向治疗已成为权威指南推荐的一线标准治疗选择。
长久以来,肝肿瘤切除术是肝癌根治性治疗的最主要方式。针对初诊时不可切除或术后复发风险较高的HCC患者,转化治疗的探索则寄希望于为此类患者带来手术根治希望及长期生存获益。2020年ASCO,我国孙惠川教授报道了PD-1抑制剂联合TKI用于肝癌转化治疗的真实世界研究结果[10]:晚期不可手术切除肝癌患者接受PD-1联合TKI治疗后,部分患者转化成可切除且完成了手术获得pCR疗效。靶向药物、免疫治疗药物的发展,将进一步改变中晚期肝癌的临床治疗实践。
该患者就诊时确诊“肝细胞癌,BCLC C期,CNLC Ⅲa期”,患者合并门静脉癌栓,直接手术切除术后复发风险高,综合评估后,以降期、改善远期生存预后为目的进行了转化治疗。HAIC+替雷利珠单抗+仑伐替尼2个疗程就取得了惊喜的治疗效果——AFP水平明显降低,原发病灶及门脉癌栓明显缩小。后续的手术治疗也非常顺利,术后病理取得pCR的成效,且术后随访至今无明显复发征象。HAIC+免疫+靶向的转化治疗,作为创新的新辅助治疗方式,其疗效也在真实实践中获得证明。
本例患者免疫治疗药物选用了替雷利珠单抗,替雷利珠单抗是中国自主研发的PD-1抑制剂,其Fc段通过特殊改造,避免了抗体依赖性细胞吞噬(ADCP)效应,可在巨噬细胞数量较多的器官(如肝脏)中,发挥更优的T细胞激活效应,提高抗肿瘤活性。此外,替雷利珠单抗的Fab段改造,能够彻底持久阻断PD-1/PD-L1结合,极大地降低了脱靶效应的发生概率,使得抗肿瘤疗效提升。既往研究已显示了其单药后线治疗肝癌良好的安全性和显著的抗肿瘤活性[11-12]。
在RATIONALE 208研究[13]中,替雷利珠单抗单药二线及后线治疗不可切除肝细胞癌仍显示了良好疗效和安全性,二线中位总生存(mOS)达13.8个月,近80%客观缓解患者持续缓解时间超过一年(一年DoR率79.2%);部分患者实现深度缓解,单药治疗后有3例患者达到完全缓解(CR),疗效比肩国际同类药物既往数据,表明替雷利珠单抗单药治疗或可为患者带来更多生存获益。安全性方面,≥3级治疗相关不良事件(TRAE)发生率仅为14.5%,处于同类药物较低区间。基于RATIONALE 208研究数据,国家药品监督管理局(NMPA)于6月22日正式批准替雷利珠单抗用于至少经过一种全身治疗的肝细胞癌的治疗。在今年的中国临床肿瘤学会年会(2021 CSCO)上,公布了RATIONALE 211研究的安全性数据[14]。RATIONALE 211是一项在不可切除晚期肝癌患者中进行的开放标签、多中心、II期临床研究,旨在评估替雷利珠单抗联合仑伐替尼一线治疗不可切除晚期肝癌的抗肿瘤活性和安全性,期待该研究的后续成果为替雷利珠单抗在肝癌治疗领域提供更多的循证医学证据。同时,替雷利珠单抗联合其他治疗手段(如TACE、抗血管生成药物等)的更多研究,也都在紧锣密鼓开展中。希望这些研究成果进一步充实替雷利珠单抗在肝癌治疗领域的探索,转化到临床,造福更多肝癌患者。

中国医学论坛报编辑|金金 整理
查看更多