查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





甲状腺癌是一种起源于甲状腺滤泡上皮或滤泡旁上皮细胞的恶性肿瘤,也是头颈部最为常见的恶性肿瘤。近年来,全球范围内甲状腺癌的发病率增长迅速,据全国肿瘤登记中心的数据显示,我国甲状腺癌将以每年20%的速度持续增长。随着对甲状腺癌相关分子生物学研究的不断深入,一些分子的异常被认为在甲状腺癌的致病过程中发挥重要作用,可作为甲状腺癌治疗的分子靶点,并且取得了一定的治疗效果。来自上海市第六人民医院陈立波教授,中山大学附属第一医院李杰教授及福建省肿瘤医院吴宇教授将围绕分化型甲状腺癌靶向治疗前沿展望分享专家观点。
陈立波 教授
上海市第六人民医院核医学科主任医师
留德博士、教授、博士生导师
上海市第六人民医院核医学科副主任
兼临港院区核医学科主任
上海市医学会核医学分会治疗学组副组长
中华医学会肿瘤学分会甲状腺肿瘤专委会委员
中国临床肿瘤学会甲状腺癌专委会常务副主任委员
中国研究型医院学会甲状腺疾病专委会核医学学组副组长
李 杰 教授
中山大学附属第一医院甲状腺乳腺外科副主任医师
博士、博士生导师
广东省普通外科质控中心甲乳外科学组副组长
中国研究型医院学会甲状腺专业委员会青年委员
中国医促会甲状腺分会甲状旁腺学组委员
中国医师协会科学普及分会甲状腺科普专委会委员
广东省抗癌协会甲状腺癌青年委员会主任委员
广东省临床医学会甲状腺青年委员会副主任委员
广东省药学会甲状腺分会副秘书长
广东省抗癌协会甲状腺分会常务委员
广东省医师协会甲状腺腔镜分会委员
广东省临床医学学会甲状腺分会委员
吴 宇 教授
福建省肿瘤医院头颈外科副主任医师
医学博士、硕士研究生导师
香港中文大学威尔斯亲王医院访问学者
中国抗癌协会肉瘤专业委员会委员
中国人体健康科技促进会甲状腺肿瘤专委会委员
中国抗癌协会甲状腺癌专委会青年委员
中国抗癌协会肉瘤专委会黑色素瘤学组委员
福建省抗癌协会青年理事
福建省抗癌协会黑色素瘤专委会常务委员
福建省抗癌协会甲状腺肿瘤专委会委员兼青委副主任委员
福建省中西医结合学会甲状腺病分会委员兼青委副主任委员
福建省医学会外科学分会甲状腺外科学组委员
福建省肿瘤医院黑色素瘤多学科综合诊疗小组副组长
福建省肿瘤医院头颈肿瘤多学科综合诊疗小组秘书
分化型甲状腺癌靶向治疗进展盘点
甲状腺乳头状癌(PTC)、甲状腺滤泡癌(FTC)和甲状腺未分化癌(ATC)构成了分化型甲状腺癌(DTC),其特征性分子改变包括:突变、缺失、基因融合,涉及基因和蛋白质对不同信号通路的影响。其中,从PTC/FTC到低分化型甲状腺癌(PDTC)和ATC的转变还涉及BRAF、RAS、TERT等分子改变,而甲状腺髓样癌(MTC)起源于滤泡旁C细胞,普遍以RET突变为特征。DTC患者经手术、131I和促甲状腺激素(TSH)抑制治疗后大部分预后良好。然而,仍有部分分化良好的DTC进展为碘难治性DTC(RR-DTC),预后不佳。分子靶向药物为RR-DTC患者带来了一些希望,这类靶向药物主要是酪氨酸激酶抑制剂(TKIs),其作用机制主要有两个方面:一是抑制血管生成从而抑制肿瘤生长,这类包括针对VEGFR,FGFR,PDGFR等受体的经典的抗血管生成靶向药物;二是抑制肿瘤细胞增殖,促进肿瘤细胞凋亡。分子靶向药物在RR-DTC的治疗中具有重要作用,目前国内获批的多靶点TKIs主要包索拉非尼和仑伐替尼。
1. 领域进展
2021年,多项DTC靶向治疗临床试验结果出炉。一项系统性回顾的研究结果显示,与安慰剂相比,仑伐替尼可显著延长甲状腺癌患者无进展生存期(PFS,HR 0.24,95%CI 0.19-0.31,P<0.001),总生存期(OS,HR 0.65,95%CI 0.52-0.81,P<0.001),和客观缓解率(ORR,RR 35.41,95%CI 19.42-64.58,P<0.001)。安全性方面,与安慰剂相比,仑伐替尼显著增加≥3级不良事件发生率(RR 8.25,95%CI 6.50-10.46,P<0.001)。
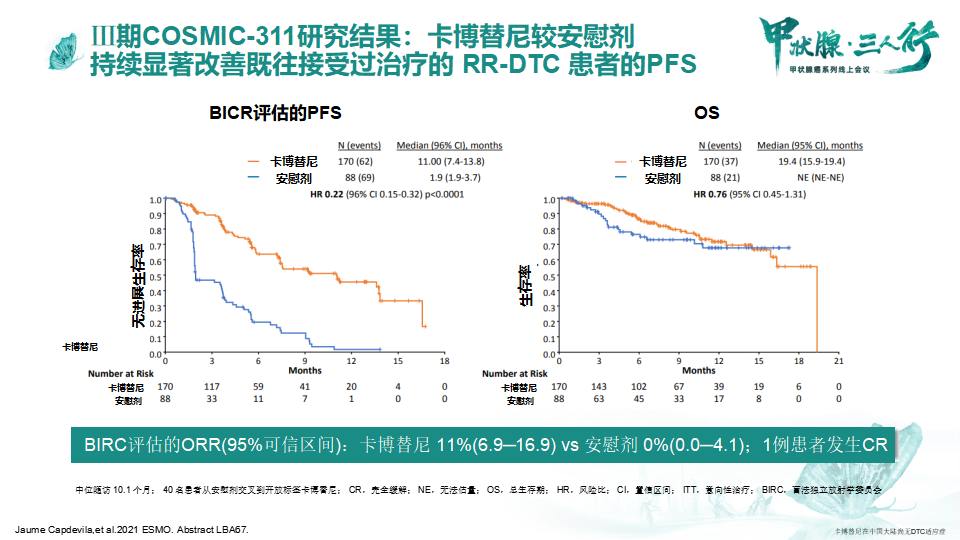
2021年美国临床肿瘤学会(ASCO)公布的Ⅲ期COSMIC-311研究[1-2]结果显示:卡博替尼可持续显著改善既往接受过治疗的RR-DTC患者的PFS(卡博替尼组的中位PFS为11.0个月,安慰剂组的中位PFS为1.9个月,HR 0.22,95%CI 0.15-0.32,P<0.001)。ORR方面,卡博替尼组也显著优于安慰剂组(p=0.028),卡博替尼组的疾病控制率达到了60%,而安慰剂组为27%。在进一步的亚组分析发现,无论患者既往是否接受仑伐替尼和/或索拉非尼治疗,与安慰剂相比,卡博替尼均能改善PFS。安全性方面,COSMIC-311的不良事件与卡博替尼已知的安全性数据一致。
另一项是基于ALTER01032研究[3]基线特征较差RR-DTC患者的亚组分析,该研究纳入113例老年(≥55岁)、骨转移或影像学检查证实在入组前3个月内出现疾病进展的患者,按2:1的比例随机接受安罗替尼(n=76)或安慰剂(n=37)治疗。ALTER01032研究亚组分析结果显示:与安慰剂组相比,安罗替尼治疗的所有亚组PFS均显著延长(P<0.05),出现骨转移或3个月内出现进展的患者接受安罗替尼治疗后OS显著获益(P<0.05);在老年患者中,同样观察到OS改善的趋势(HR=0.85,95%CI 0.37,1.97)。
此外,selpercatinib治疗RET改变型甲状腺癌患者的LIBRETTO-001研究[4]在今年ASCO会议也进行了疗效和安全性数据的更新,结果显示在RET融合阳性甲状腺癌(TC)患者中,既往接受治疗的患者经独立影像评估(IRC)的ORR为77%,53%持续缓解,而经治疗[放射性碘(RAI)治疗除外]的患者的ORR为92%,91%持续缓解。
2. 关注患者
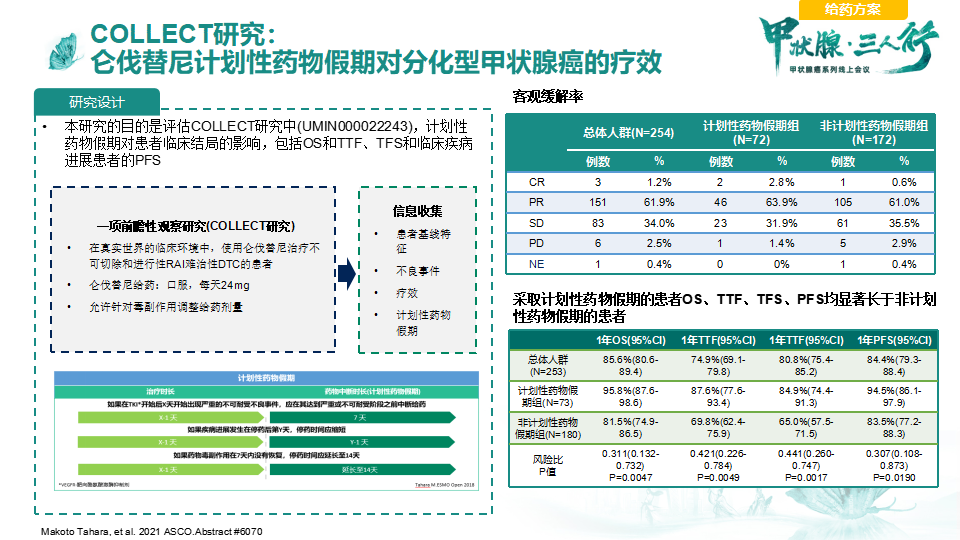
对于一线临床医生来说,关注DTC患者疗效的同时也要关注患者的生活质量,并探索兼顾疗效和安全性的给药方案。2021年欧洲内科肿瘤学会(ESMO)大会上公布了lenvima治疗RR-DTC患者II期临床研究Study 211研究[5]结果更新,该研究比较了lenvima的2种起始剂量(18 mg vs 24 mg,每日一次)的疗效和安全性。结果显示,24 mg/d剂量组和18 mg/d剂量组24周ORR分别为57.3%和40.3%。由于优势比置信区间低于预设下限0.4,因此研究结果未能达到18 mg/d剂量组的非劣效性终点。安全性方面,两个治疗组的HRQoL评估完成率和依从率相似。COLLECT研究[6]是一项前瞻性观察研究,该研究收集在真实世界的临床环境中,使用仑伐替尼治疗不可切除和进行性RR-DTC的患者基线、疗效及不良反应的信息。该研究结果提示,计划性药物假期使仑伐替尼治疗剂量更高,可能与较好的临床结局相关。另有回顾性研究结果发现,仑伐替尼在ECOG PS为0的患者中的PFS、OS以及ORR获益更显著[7],在NLR≤3患者中的PFS、OS获益更显著[8],在基线肿瘤负荷较低的患者中具有更好的生存结局[9]。
3. 创新探索
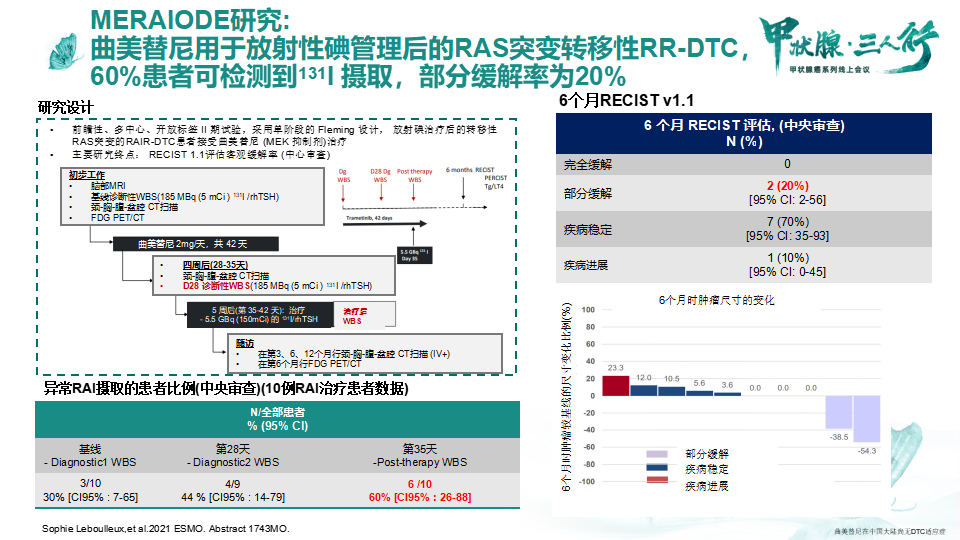
2021年ESMO会议报道了一项靶向治疗逆转碘耐药的初探研究——MERAIODE。MERAIODE研究[10]是一项前瞻性、多中心、开放标签,采用单阶段的Fleming设计,放射碘治疗后的转移性RAS突变的RR-DTC患者接受曲美替尼治疗的II期临床试验。该研究结果发现:曲美替尼用于放射性碘管理后的RAS突变转移性RR-DTC后,60%患者可检测到131I摄取,部分缓解率为20%,且毒性有限。
另一项靶向新辅助治疗研究的安全性结果发现[11]:安罗替尼新辅助治疗局部晚期甲状腺癌,不良事件与已知的不良事件特征一致,还期待该研究数据进一步的发表。
小结
随着甲状腺癌的基因突变和分子通路逐渐清晰,针对这些突变和通路的靶向治疗正在持续探索。目前包括仑伐替尼、索拉非尼等在内的靶向药物已显示出生存获益,并常规用于临床。2021年,DTC靶向治疗领域取得了多方面的进展。包括COSMIC-311(卡博替尼)、ALTER01032(安罗替尼)、LIBRETTO-001(赛帕替尼)等在内的多项临床研究进行了数据更新,RR-DTC患者逐步实现慢病化。目前,多项DTC靶向治疗的临床探索正在进行中,期待通过更多探索和发现让RR-DTC患者得到长期生存获益。
仑伐替尼治疗甲状腺癌真实世界应用
据国家癌症中心2018的流行病学报告,截至2015年12月,我国甲状腺癌疾病相关5年生存率为84.3%,相比美国甲状腺癌的5年生存率98.7%,还是有明显差距[12]。晚期甲状腺癌是患者死亡的最主要原因。虽然外科手术仍是晚期甲状腺癌治疗的基石,但技术已逐渐达到瓶颈,中美之间甲状腺癌死亡率差异的重要原因之一是靶向及免疫等新兴药物的可及性。随着近年来我国甲状腺癌多学科诊疗(MDT)模式的不断完善,属于中国甲状腺癌患者的靶向及免疫治疗时代已经到来。近年来,仑伐替尼、索拉非尼、拉罗替尼、达拉非尼/曲美替尼及安罗替尼等不断获得美国食品和药物管理局(FDA)及国家药品监督管理局(NMPA)的批准用于晚期甲状腺癌的治疗,许多临床研究的结果也不断更新,甲状腺癌靶向药物呈现百花齐放态势。
1. 仑伐替尼应用于晚期甲状腺癌的转化治疗
提到转化治疗,首先,要将其与新辅助治疗区别开来。1978年,de Lena在乳腺癌治疗中首先提出新辅助治疗的概念,新辅助治疗的目标是病理完全缓解(PCR),并不包括提高无病生存期(DFS)或OS。与新辅助治疗不同,转化治疗的目标是R0/R1切除、降期保器官以及追求患者长期生存。
近期,福建省肿瘤医院刘辉、吴宇教授团队开展了一项观察仑伐替尼治疗局部晚期分化型甲状腺癌的单中心真实世界研究。这是一项关于仑伐替尼转化治疗的研究,不仅关注可手术的晚期甲状腺癌患者是否能降期之后获得手术机会,从而最大限度保存患者的器官及功能,同时也注重难以获得手术机会的患者是否可以得到OS的获益。
该研究入组的第一例患者49岁,男性,2021年的4月7日入组,甲状腺细针穿刺抽吸活组织检查(FNAB)显示为甲状腺乳头状癌,基因检测报告显示该患者具有BRAFV600E联合TERTC228T突变。彩超结果显示:甲状腺癌侵犯周围软组织颈前肌,大小为7.2 cmX5.5 cmX5.2 cm。CT及MR结果提示:该患者甲状腺癌累及左侧甲状软骨,气管壁可疑受累,双肺多发转移。鼻咽喉镜提示双侧声带活动正常,气管镜提示气管内未见肿瘤,超声胃镜提示食管肌层未受累。
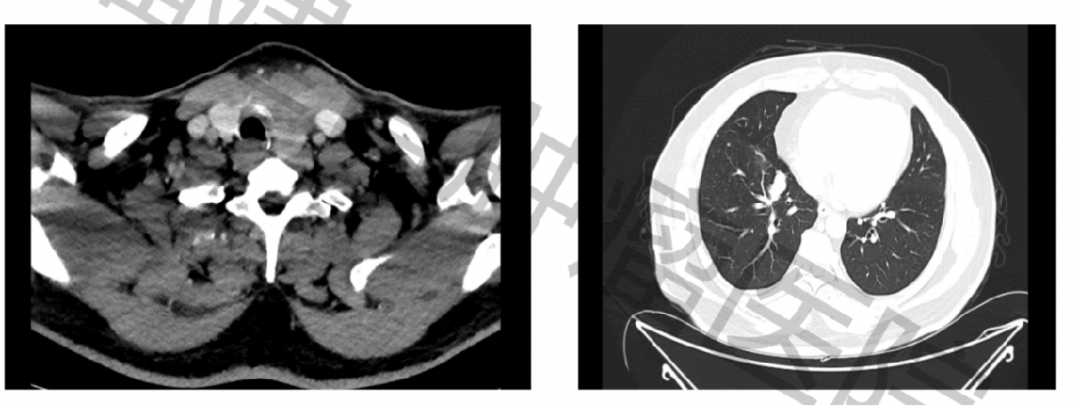
由于肿瘤体积较大,且有气管壁受侵,虽然既往这种病例也可以选择直接手术,但随着靶向治疗时代的到来,为降低手术难度,减少气管及喉返神经损伤的风险,可以先尝试用靶向药物让肿瘤进行缩小,然后再进行手术。该患者患有慢性活动性乙型肝炎,入院时乙肝病毒DNA 1.46×105,ALT 504 U/L,AST 215 U/L,经过2周保肝及抗病毒治疗,乙肝DNA下降至2.04×103,但转氨酶仍未下降至正常:ALT 180 U/L,AST 205 U/L。此时,患者开始口服仑伐替尼24 mg/日,同时继续保肝及抗病毒治疗,仑伐替尼开始口服的第1、3、5、7周时各复查一次基线(肝功、甲功、彩超等)。第1周复查时患者转氨酶已恢复正常。该结果提示,仑伐替尼的副作用方面,对于肝功能的损害是较低的。其他副作用方面,患者在第1周时出现了血压升高(160/105 mmHg)以及TSH升高(8.018 mIU/L)。生化疗效上,患者用药前TG 155 ug/L,第1周153 ug/L,第3周49.5 ug/L,第5周20.1 ug/L,第7周47.5 ug/L。 彩超最大径用药前7.2 cm,第3周降低至5.7 cm,第7周降低至4.7 cm。第7周复查患者肺部的转移灶明显消退。以下是福建省肿瘤医院刘辉、吴宇教授团队关于这项真实世界研究的一些临床体会:
关于手术时机的把握:首先,这例患者用药的目的是为了降期手术,因此当肿瘤缩小到一定程度,要观察手术的解剖间隙是否清晰呈现,如果已经获得R0或者R1手术切除的机会,手术时机即已成熟。其次,就是判断仑伐替尼是否已经出现一定的耐药,判断依据可以有以下几点:①连续2次评价,肿瘤体积不再缩小;②病灶出现明显的液化;③甲状腺球蛋白(TG)水平持续下降之后出现再次升高。此外,当患者出现不能耐受的不良反应,也该停止用药,尽快进行术前准备;
关于停药时间:仑伐替尼的半衰期为28小时,5个半衰期后体内血药浓度基本无法测量。因此,一般停药5-6天手术,本例患者停药7天,术前检测TG出现了明显的反弹,此现象在后续的多例研究中均有出现,因此最佳停药时间仍然值得探索;
关于手术过程:本例患者肿瘤得到R0切除,手术创面未见出血倾向。从机制上来说,抗血管生成药物主要通过使异常增生的血管正常化,从而缩小肿瘤,同时改善药物输送和含氧量。但这个过程只是一段时间,就是存在“血管正常化的时间窗”,调控血管生成是一个网络,涉及多个蛋白或是信号通路,超过了血管正常化的时间窗后,血管生成往往出现代偿性现象。且肿瘤可通过累积特别具有侵袭性的细胞来适应抗血管生成治疗。结合上述病例来看,患者TG水平的下降及肿瘤直径的缩小到来一定程度就不再继续,甚至有所反弹,也证实了上述理论。研究者反应术中出现创面出血倾向可能和用药时间、停药时间以及个体差异的血管正常化时间有关;
关于疗效的评价:本例患者的术后病理呈现间质纤维增生,伴较多吞噬含铁血黄素的组织细胞浸润,仅有少量癌巢残留。病理缓解率早于影像缓解率,提示对于抗血管生成靶向治疗的评价,不能以传统的RECIST标准,可以参考2010年基于索拉非尼治疗肝癌而提出的以肿瘤血管生成和密度改变为基础的新的疗效评估标准mRECIST。当然,仑伐替尼治疗甲状腺癌的疗效评估也有可能形成自己的评价标准,例如MRI的ADC值,PET/CT的SUV值和生化指标中的TG值等,这项工作值得继续完善;
关于肿瘤退缩模式:甲状腺癌的抗血管生成治疗以向心性退缩模式为主。这主要与甲状腺癌的血供模式有关,甲状腺癌的血供分布通常是周边富血供,中心乏血供,尤其是肿瘤越大,中心区域越容易出现液化坏死。当然,也并非都是如此,当主要的血管供应瘤体中央时,肿瘤表现为浸润性生长,环绕供应瘤体周边时,肿瘤表现为膨胀性生长,因此抗血管生成治疗之前,通过影像学或者肿瘤的生长模式,初步预判肿瘤的血供模式,对于用药后肿瘤的退缩模式是有参考意义的,如果肿瘤呈现向心性的退缩模式,将为局晚期甲状腺癌创造手术机会。
2.仑伐替尼联合PD-1治疗甲状腺未分化癌
2020年6月,FDA批准帕博利珠单抗用于治疗肿瘤突变负荷(TMB)≥10 Mut/Mb的晚期实体瘤患者,推荐可对晚期甲状腺癌病例行TMB检测,推荐TMB-H甲状腺癌患者可将帕博利珠单抗免疫治疗作为备选方案,并获得美国国家综合癌症网络(NCCN)2020.V2指南推荐。由于免疫联合抗血管生成治疗近年来风靡各大瘤种,在此之前,已有我国的研究团队对仑伐替尼调节免疫微环境的机制作出解释,该研究发现仑伐替尼可降低肝癌患者的PD-L1和调节性T细胞(Tregs)(动物实验及细胞实验)。在对仑伐替尼的已知作用靶点测评后发现:仑伐替尼主要通过抑制FGFR4信号通路来下调PD-L1表达,并通过抑制Tregs的分化,阻断Tregs对PD-1单抗的抑制作用。福建省肿瘤医院刘辉、吴宇教授团队研究发现:甲状腺癌是FGFR4表达和Tregs浸润都高的瘤种,帕博利珠单抗联合仑伐替尼的“KL组合”对甲状腺未分化癌具有良好的疗效,该中心自今年起收治的甲状腺未分化癌患者,采用“KL组合”的ORR率达到50%,疾病控制率(DCR)达100%。
小结
手术是局部晚期甲状腺癌治疗的基石,但是随着外科技术的发展,手术发展或将触及瓶颈。药物的突破性发展会使现有的治疗手段更加的丰富,并进一步延长患者的生存。目前,甲状腺癌已经进入到了一个靶向及免疫治疗的时代,联合治疗或将是未来发展的一个重要的方向。
专家观点
陈立波教授:关于仑伐替尼疗效预测的问题,2020年SELECT研究的亚组分析显示:肿瘤负荷低、转移灶少的患者接受仑伐替尼治疗后PFS获益更佳。在关于索拉非尼的多项真实世界研究中也观察到了相似的结果,对于无疾病相关症状、仅肺转移以及ECOG评分较低的RR-DTC患者,索拉非尼治疗有望得到较好的PFS及OS获益。2020年,我们团队发表在《Oncologist》针对接受索拉非尼治疗的进展性RR-DTC患者的真实世界研究结果同样发现:无骨转移以及生化反应有效/稳定是更长中位PFS的独立预后因子。临床特征能在一定程度上预测仑伐替尼疗效,并提示患者未来的生存预期。
此外,外科医生主要靠手术刀来解决临床问题,新辅助免疫治疗作为一种新兴的外科治疗前手段,提高了根治性手术的成功率,能够使一部分原本被认为失去手术机会的患者重新获得手术根治的机会,或可为患者带来新的生机。当然,如何选择合适的患者并制定合理的新辅助治疗方案仍需大型临床试验进行探索评价。
相较于乳腺癌、肝癌、胃癌等,甲状腺癌在TKI为代表的分子靶向治疗领域的发展是比较滞后的。但“他山之石,可以攻玉”,借鉴其他瘤种成功经验并规避其失败的风险,甲状腺癌或可少走“弯路”,甚至有可能以更快的速度赶上其他瘤种靶向治疗的研究步伐。从甲状腺癌领域目前蓬勃发展的态势来看,我们对甲状腺癌分子靶向治疗的明天充满信心。
李杰教授:甲状腺癌的靶向治疗在过去数年中取得了迅速发展,其中对131I耐受的DTC的靶向治疗更是获得了大量的循证医学证据。目前,针对甲状腺癌的靶向治疗药物有RET抑制剂、NTRK抑制剂、多靶点激酶抑制剂等。不同类型靶向药物的疗效和安全性具有区别,临床可优先参考药物疗效,考虑低剂量或药物假期的方式。在药物排兵布阵上,个人的观点是尽早使用疗效更优的药。甲状腺癌的靶向治疗正突飞猛进的发展,希望广大患者可以尽最大可能享受到药物快速发展的红利。甲状腺癌的靶向药物正在不断涌现,未来应该探索更多的治疗策略。
此外,新辅助治疗在甲状腺癌的治疗疗效、评估手段等仍存在争议。如何平衡疗效及不良反应间的关系,并提高患者的OS等问题仍尚待解决。作为外科医生,如果针对局部晚期甲状腺癌患者用靶向药物,我们肯定希望肿瘤在靶向治疗后呈现一个利于手术实施的状态。然而,如果说肿瘤呈是一个非向心性的退缩,可能会增加手术的难度。
吴宇教授:近年来的研究发现,仑伐替尼对肺转移灶的疗效比较好,对骨转移灶的疗效却比较差。这种现象值得我们对临床的决策进行思考。尤其是骨转移灶,如果是一个寡病灶,那么在靶向治疗无效之后,我们还是要争取手术或者放疗,而对于一个多发骨转移的患者,可能会考虑靶向联合免疫等系统性治疗。
另一方面,仑伐替尼用于局部晚期甲状腺癌的新辅助治疗,手术时机该如何把握?事实上,新辅助治疗存在一定风险性及未知性:例如在术前用药期间可能出现肿瘤进展、患者不良反应等,反而可能延误手术及保存器官的时机。术前新辅助治疗一旦出现合适的手术时机,不可恋战,应即时对患者进行手术。此外,甲状腺癌患者亟须符合自身特征的“mRECIST”评价标准,这里面可能需要进一步能测定肿瘤密度、肿瘤血管状态等检查手段。
随着精准医学的深入,越来越多的专家开始使用异病同治的策略来治疗肿瘤。精准医学时代,对于甲状腺滤泡上皮来源的肿瘤的靶向及免疫治疗,以下两方面具有不断发展的潜力:其一,新一代靶向或免疫治疗药物的研发。越来越多的新一代小分子靶向药、抗血管靶向药及新一代免疫疗法等的涌现,包括有着“不可成药”靶点之称的KRAS靶点在近期首次迎来新药获批,会使得未来的甲状腺癌治疗方案将进一步多元化;其二,靶向药物虽然通常在短期内疗效不错,疾病响应率很高,但耐药性几乎不可避免。因此,在未来如何降低靶向药物的耐药将成为重要的研究方向,例如开发针对耐药突变基因的新药。
参考文献:
1.Marcia SB, et al.2021 ASCO. Abstract 6001.
2.Jaume Capdevila,et al.2021 ESMO. Abstract LBA67.
3.2021 ASCO.Abstract #602
4.Eric Sherman, et al. 2021ASCO. Poster #6073
5.Matthew H. Taylor,et al.2021 ESMO.Poster #1746
6.Makoto Tahara, et al. 2021 ASCO.Abstract #6070
7.Taylor MH, et al. Thyroid. August 2021; 31(8): 1226–1234.
8.Taylor MH, et al. Thyroid. August 2021; 31(8): 1226–1234.
9.Suzuki C, et al. Front Oncol . 2021 Jul 8;11:638123
10.Sophie Leboulleux,et al.2021 ESMO. Abstract 1743MO
11.2021 ASCO.Abstract #6069.
12.Zeng, H ; Chen, W ; He, J,et al. Lancet Glob Health.2018 05 ;6(5)
审批号:MI-LEN-0165-CN
免责声明:
本资讯由默沙东医学团队编辑提供,旨在用于医学专业人士间的学术交流,请勿随意转发或转载。文中相关内容不能以任何方式取代专业的医疗指导,也不应被视为治疗建议。医学专业人士对文中提到的任何药品进行处方时,请严格遵循该药品在中国批准使用的说明书。默沙东不承担相应的有关责任。
查看更多