查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





奥施康定配合射频消融术治疗骨转移癌痛的效果观察
李泓锡,姚 鹏
0 引言
大多数癌症,如肺癌、肝癌、前列腺癌等易发生骨转移。骨转移病灶的局部可以产生很严重的破坏,包括疼痛、高钙血症、病理性骨折、脊髓或神经根压迫。目前,骨转移癌的治疗包括手术、放化疗、药物治疗,其中药物治疗包括镇痛药物和双膦酸盐类药物。对于癌症中晚期患者,手术并不是治疗骨转移癌痛的最佳方法。骨癌痛是一种复杂的疼痛综合征,包括稳定的基础疼痛和爆发痛,并且运动及改变体位时疼痛加重,强效的阿片类药物也很难控制此类疼痛。增加阿片类药物用量的同时会增加药物副作用,对患者的生活和精神造成了极大的伤害,所以迅速有效地控制骨转移癌痛是临床医生面临的重要问题。
射频消融术( Radiofrequency Ablation,RFA )是利用高频交流电通过针尖传导到周围组织,产生震动生热,使组织坏死。与正常细胞相比,恶变的细胞对热更敏感,容易被热破坏,从而杀灭肿瘤细胞[1]。Madaelil 等[2] 研究证明,RFA 能够有效缓解骶骨转移癌疼痛并控制局部肿瘤的发展。自Dupuy 等[3]首次报道了 RFA 可以缓解骨转移癌痛以来,RFA 逐渐得到广泛应用和肯定的疗效, 临床将 RFA 与放疗、开放手术、椎体成形术等技术联合用于肿瘤的治疗[4-6]。本文旨在研究奥施康定配合射频消融术治疗骨转移癌痛的有效性及安全性。
1 资料与方法
1. 1 一般资料 选取 2014 年 4 月至 2017 年 3 月于我科诊断为多发骨转移癌的患者 90 例,分为手术组( A 组) 和保守治疗组( B 组) ,每组 45 例,A组给予口服镇痛药和射频消融术治疗,B 组仅给予口服镇痛药治疗。入选标准:患者影像学检查确诊为骨转移癌,主要疼痛部位与影像学表现相符合; 视觉模拟评分法( Visual Analogue Scale, VAS) ≥5 分;患者末次放化疗距手术时间大于 3 个月。排除标准:不能口服药物及恶病质患者;阿 片类药物过敏及滥用者;严重全身系统疾病、肝肾功能严重异常;精神疾病不能配合者;凝血功能等生化检查明显异常。经医院伦理委员会批准,签署知情同意书。
1. 2 治疗方法
1. 2. 1 手术方法 对于高血压患者,术前将血压控制在 140 /90 mmHg 以下; 对于患有冠心病、糖尿病等基础状态欠佳的患者,调整基础状态稳定后再接受手术治疗。患者术前给予邦亭肌肉注射、建立静脉通路。患者进入 CT 室后,常规监测心率、血氧饱和度、血压。手术同侧贴射频仪的负极板。CT 平扫下定位穿刺路径,椎体骨转移癌选择相应椎体一侧椎弓根为穿刺点,其余部位骨转移癌选择体表至肿瘤中心的合适穿刺路径( 避开重要的神经、血管) ,以 0. 5% 利多卡因逐层浸润麻醉,取射频针按预定角度及深度逐渐进针,行 CT 扫描确认射频针进入椎体内或者肿瘤中心位置,撑开射频针伞部,CT 扫描确认针尖位置安全( 距离脊髓、主要运动神经、大动脉大于 1cm) ,连接射频仪进行射频热凝治疗,70℃ 、80℃ 、90℃ 共10 min,消融结束后,边拔出射频针边行针道消融,消融病灶处给予骨水泥灌注,再次行 CT 扫描确认骨水泥无渗漏且弥散良好。术后嘱患者绝对卧床24 h,常规给予邦亭止血、抗生素预防感染。
1. 2. 2 口服镇痛方法 非阿片类药物耐受患者奥施康定起始剂量为 10 mg;阿片类药物耐受的患者将药物等量换算后增加 10% 作为初始剂量, 12 h口服一次。爆发痛处理: 给予口服盐酸吗啡片,剂量为 24 h 使用的阿片类药物换算成吗啡口服用量的 25% 。第二日奥施康定剂量根据前一日阿片类药物总量及 NRS 评分调整:VAS≥7 分,剂量增加 50% ~ 100% ;VAS≥4 分,剂量增加25% ~ 50% ;VAS≤3 分,维持原有剂量。经过 2 ~ 3 d 滴定后,将疼痛控制在 VAS ≤3 分,爆发痛次数少于 3 次。
1. 3 观察指标
1. 3. 1 VAS 评分 0 分为完全无痛,10 分为不能忍受之剧痛。
1. 3. 2 生活质量评分 采用健康调查简表( the MOS item short from health survey,SF-36) 来评估患者的生活质量,SF-36 包括 36 个条目和 8 个维度,通过计算得出生理总分 ( Physical Component Summary,PCS ) 和心理总分( Mental Component Summary,M CS) 数值。
1. 4 统计学方法 所得数据均采用 SPSS19. 0 软件进行统计分析。计量资料以( 均数 ± 标准差) 表示,采用 t 检验,计数资料采用 χ2 检验。P < 0. 05 表示差异有统计学意义。
2 实验结果
2. 1 一般资料 两组患者的性别、年龄、住院时间及肿瘤类型比较无明显统计学差异( P < 0. 05), 见表 1。A 组 45 例手术患者,消融部位:脊柱椎体25 例,骨盆 7 例,脊柱 + 骨盆 9 例,肋骨 2 例,肱骨 1 例,肩胛骨 1 例。
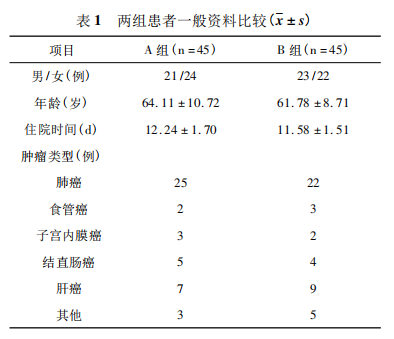
2. 2 两组 VAS 评分比较 两组患者治疗后与治疗前相比,VAS 评分比较差异有统计学意义( P <
0. 05) ,出院时、出院 1 个月 VAS 评分 B 组高于 A组( P < 0. 05) ,见表 2。
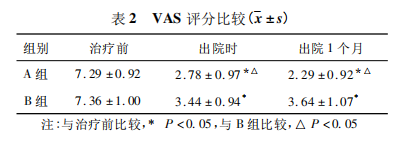
2. 3 两组生活质量比较 两组患者在治疗前,生活质量评分均较低,比较无统计学差异 ( P >
0. 05)。治疗后,两组患者生活质量均升高( P <0. 05)。出院时、出院后个月,A 组患者的生活质量评分明显高于 B 组( P < 0. 05) ,见表 3。
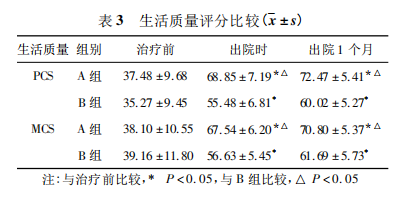
2. 4 镇痛药用量 治疗前两组患者镇痛药用量无明显差异;出院时、出院 1 个月奥施康定、吗啡用药量 B 组高于 A 组,两组比较有显著性差异 ( P < 0. 05) ,见表 4。
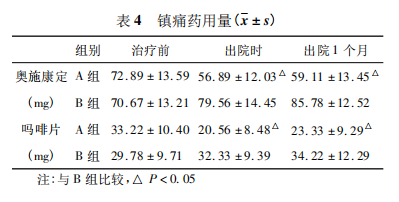
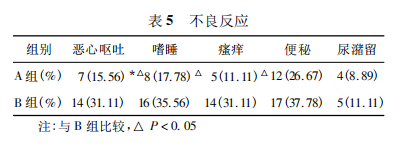
2. 5 不良反应 两组患者治疗期间均未出现严重不良反应,出现不良反应患者给予对症治疗。A 组患者发生恶心呕吐、嗜睡及瘙痒不良反应明显少于 B 组(P < 0. 05)。A 组患者10 例术中出现疼痛,给予芬太尼静注后疼痛缓解;2 例术中出现恶心,给予氟哌利多对症治疗。2 例患者术后发热,给予抗生素及物理降温等对症治疗后缓解。见表5。
3 讨论
骨髓内血流丰富、血流量高,所以骨是肿瘤常见的转移部位,甚至有些肿瘤以骨转移和骨痛为首发症状。骨癌痛的发生机制复杂,尚未有统一的观点。目前研究表明,中枢和外周的痛觉敏化与骨癌痛有关。骨癌痛痛觉敏化的机制主要包括两个方面:一是与骨髓微环境的改变有关系。破骨细胞增生、活化和肥大是溶骨性与成骨性肿瘤的共有特征。破骨细胞的活动造成骨髓局部微环境酸中毒。另外,肿瘤转移至骨髓,激活机体的免疫细胞,合成并分泌大量细胞因子,造成骨髓内微环境的改变。另一方面是与骨肿瘤引起外周和中枢神经系统重建有关[7]。此外,在骨癌痛的发生发展过程中,交互存在着炎症反应、神经损伤及其 他组织损伤等病理变化,导致伤害性刺激传入信 号增加,引起剧烈的疼痛。由于医学的进步,对原发肿瘤治疗效果的改善,患者的生存期相对延长, 一项研究发现,晚期癌症患者平均每 3 ~ 6 个月发生一次骨骼事件[8]。骨转移癌引起的活动性疼痛、爆发痛甚至病理性骨折,严重影响了患者的生 存质量,最终患者死亡与骨转移并发症密切相关。因此,治疗转移癌病灶对患者的预后变得非常重 要。目前临床上治疗骨转移癌的方法主要有:药 物治疗( 阿片类镇痛药、双膦酸盐类药物) 、微创介入治疗( 经皮椎体成型术、射频消融) 、放疗等。对于重度疼痛的骨转移癌患者,增大镇痛药物用量 的同时,药物副作用也增加并出现药物耐受。有研究表明,吗啡可能导致疼痛上调,超出肿瘤本身导致的疼痛加重[9]。由于放疗不适于有脊髓压迫、病理性骨折的患者,以及其他禁忌症和副作用,或者患者及家属拒绝行放射治疗,微创介入治疗成为治疗骨转移癌痛的一个较好的选择。
临床上诊断转移癌的患者,大部分发现时已 经有多发转移,包括内脏转移、骨转移、淋巴转移 等。骨转移癌患者运动及改变体位时疼痛加重, 严重影响日常生活,射频消融术能够消除骨转移 病灶,起到改善运动相关疼痛的作用,进而改善患 者生活质量。患者行射频消融术前需要完善相关 化验及影像学检查,并且需要尽快控制患者疼痛 症状,所以患者入院后给予奥施康定滴定缓解疼痛。本研究结果显示,奥施康定配合 RFA 治疗骨转移癌痛镇痛效果明显,降低奥施康定用量及相关药物副作用,考虑与手术的镇痛作用和消灭肿瘤作用有关。RFA 消灭肿瘤病灶,骨水泥产热及占位效应也可使肿瘤组织坏死,同时能够加固椎体,增加骨的稳定性,防止病理性骨折的发生。同时,RFA 降低骨水泥注入引起的肿瘤远处播散,并显著降低骨水泥渗漏[10]。RFA 止痛机制目前还不完全清楚。可能的机制包括:通过破坏骨膜和骨皮质的感觉神经,抑制疼痛信号的传递;通过缩小肿瘤组织的体积,解除压迫邻近组织结构,如支配骨和骨膜的感觉神经,减少感觉神经末梢的侵蚀破坏;阻止肿瘤细胞释放致痛因子,如前列腺素、内皮素、白细胞介素 1、缓激肽、肿瘤坏死因子等,避免刺激神经及疼痛传导; 抑制破骨细胞活动,减轻疼痛[11-12]。骨水泥镇痛机制与骨水泥的热效应、细胞毒效应、占位效应有关,并且能够毁损神经末梢来缓解疼痛[13-14]。
奥施康定分为即释部分和缓释部分,因而能在 1 h 内迅速起效,又能 12 h 持续镇痛。口服生物利用度高,且个体差异小,镇痛强度为吗啡的 2 倍。奥施康定易于滴定,无封顶效应,与其他药物
联合应用不存在明显配伍禁忌,并且能够改善患者焦虑抑郁情绪,提高患者的生活质量[15],与本研究结论一致。
本研究中未出现手术相关并发症,如射频消融部位骨折;脊髓、神经损伤;骨水泥渗漏;肿瘤异位种植;皮肤烫伤等。可能与 CT 影像下定位精确、骨水泥适量推注及选择合适的注入时机、熟练的手术操作、术中严密监测等有关。我科在微创手术治疗后,定期配合双磷酸盐治疗,进一步预防骨不良事件的发生,以及一定程度上抗肿瘤和抑制肿瘤转移[16]。
本研究利用奥施康定配合射频消融术治疗骨转移癌痛取得了较好的治疗效果,但仍存在一些不足之处。本研究中样本量相对较少,患者具体转移部位、转移灶数量、患者生存期以及远期治疗效果未作更详细的统计和随访,这些因素可能造成一定的偏倚和影响更加精确的统计结论。同时,本研究未进行进一步的分层分析,未将联合治疗方法与单独RAF 治疗进行对照研究。所以,进一步的大样本观察、长期随访和平衡各种混杂因素后进行对比分析是十分必要的,并且更有说服力。
总之,奥施康定配合射频消融术治疗骨转移 癌痛,镇痛效果明显,并且无严重不良反应发生, 减少阿片类药物的用量及副作用,提高患者的生 存质量,推荐用于骨转移癌痛的治疗。
查看更多