查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





细菌耐药已成为全球关注的公共卫生热点。2013年,美国疾病控制与预防中心(CDC)将耐甲氧西林金黄色葡萄球菌(MRSA)列为“严重威胁”之一。21世纪以来,陆续有新的抗耐药革兰阳性球菌药物上市,包括2000年在美国首次上市的噁唑烷酮类药物利奈唑胺,在耐药革兰阳性球菌的治疗中发挥了重要的作用,尤其对于肾功能不佳、不能耐受万古霉素的MRSA感染具有明显优势,此外,其抗结核作用也被列入一些指南和专家共识。但是,近年来逐渐发现了利奈唑胺的耐药菌株,其骨髓抑制、神经毒性、乳酸酸中毒等不良反应的发生给临床上带来了很多棘手的困扰。
2021年6月,由中国自主研发的新一代噁唑烷酮类抗菌药物——康替唑胺获批上市。康替唑胺是我国具有自主知识产权的1类抗菌新药,本文从临床药学的视角重点梳理康替唑胺的临床药理特点。
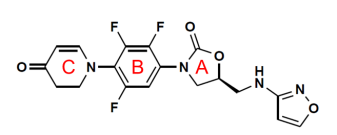
针对初代噁唑烷酮类药物的临床痛点,康替唑胺采用了突破性创新的“三氟非共面”分子结构设计。B环,邻位F增加AB两环的非共面性,显著降低毒性,间位F降低体细胞及线粒体穿透性,进一步降低骨髓抑制毒性;C环,将吗啉环的氧拉出环外(二氢吡啶酮结构替代利奈唑胺的吗啉环),加快代谢,缩短半衰期,降低毒性作用的时间,且通过黄素单加氧酶(FMO5)独特途径代谢,不会干扰单胺氧化酶或者细胞色素P450酶,药物相互作用更少;异噁唑结构取代利奈唑胺的乙酰基,增加了与细菌核糖体靶位结合力,增强了抗菌活性。这些化学结构的改变,为康替唑胺良好的抗菌活性、更少的不良反应和药物相互作用奠定了基础。
在纳入32例受试者的单剂空腹口服Ⅰ期临床试验中,分为200、400、800、1200 mg 4个剂量组,结果显示,随剂量的增加,其Cmax 升高和AUC0-inf 增大,但不呈现线性关系。尤其在800mg组至1200 mg 组,Cmax 和AUC0-inf 变化幅度不明显,因此剂量确定为800 mg。康替唑胺的平均T 为2h 左右(1.33 h~2.50 h),口服吸收速率较快,表观分布体积(Vd/F)和血浆总清除率(CL/F)随剂量增加而逐渐增大和加快。
另一项单剂空腹口服Ⅰ期临床试验分为300、600、900mg 3个康替唑胺剂量组,结果同样提示康替唑胺PK参数与剂量呈非线性关系,而且末端相消除半衰期T1/2 随剂量增加而显著延长,900 mg 剂量康替唑胺的药动学可能呈现饱和性。进食高脂餐后显著影响康替唑胺在受试者体内的Cmax 和AUC0-inf ,使其分别增加 133.4%和112.3%,T1/2 也缩短53.3%。未发现性别对PK 参数的影响。
康替唑胺连续给药第1天和第8天的Cmax ,T ,AUC0-t ,AUC0-∞ ,T1/2 ,MRT0-∞ 均无显著变化。
康替唑胺餐后口服达稳态后,T 约为2.5 h(中位数);血浆蛋白结合率约为90%,无浓度依赖性。在健康受试者口服给药后体内分布广泛,平均表观分布容积约为0.61 L/kg,与利奈唑胺相当(0.65 L/kg) 。康替唑胺的代谢由黄素单胺氧化酶FMO5和肝胞浆中的还原酶共同催化,与利奈唑胺相比,康替唑胺对单胺氧化酶的影响更小,药物间相互作用(DDI)更少 。口服给药后,康替唑胺原形药物经尿和粪便的累积排泄量不足给药量的5%;康替唑胺主要以代谢物的形式随尿和粪便排泄,且排泄集中在给药后24 h内。
在112名中国健康受试者中开展的安全性研究显示,康替唑胺 50~1800 mg 剂量具有良好的耐受性。未观察到严重或重度不良事件。与研究药物相关的临床不良事件主要为恶心、呕吐等消化道症状,与研究药物相关的实验室检查异常主要为肝酶升高。均少见而轻微,并呈一过性。
口服康替唑胺600 mg 或800 mg每日2次连续14 天后对血液系统无明显影响。
以莫西沙星为阳性对照评估餐后口服康替唑胺对健康成年男性和女性受试者 QT/QTc间期的影响的试验结果显示,康替唑胺对心率、PR和QRS间期持续时间没有明显影响 。
AE发生率:单剂和多剂(14日)康替唑胺和空白对照组相当;多剂(28日)利奈唑胺组(100%)高于康替唑胺组(60%) 。
药物相关AE发生率:多剂(28日)利奈唑胺组(80%)高于康替唑胺组(40%);多剂(28日)对比研究中,利奈唑胺出现3例血液学不良事件,其中1例因明显骨髓抑制毒性而提前退出,康替唑胺无相关异常发现 。
与对照组健康受试者相比,5例中度肝功能损害者单剂口服康替唑胺片800 mg 后,血浆中原型药物康替唑胺的体内系统暴露量、尿液中原型药物康替唑胺和代谢产物M2的排泄量、排泄率未见明显改变。与对照组健康受试者比较,康替唑胺片在中度肝功能损害者中的Cmax 降低和T 延长,但AUC 相近。鉴于康替唑胺的AUC0-24h /MIC是反映疗效的PK/PD指数,因此轻至中度肝功能损害者口服康替唑胺片无须调整剂量。
康替唑胺Ⅰ期、Ⅱ期、Ⅲ期临床试验受试者的群体药代动力学(PPK)研究结果显示,康替唑胺在轻度肾功能不全患者(60 ml/min ≤肌酐清除率<90 ml/min)中的药代动力学性质与肾功能正常患者(肌酐清除率≥90 ml/min)的无显著差异。尚没有康替唑胺在中重度肾功能不全患者中的药代动力学数据。因为康替唑胺在体内主要以代谢途径消除,原形药物经尿的累积排泄量不足给药量的2%,故预测不同程度的肾功能损害患者均可获得相似的康替唑胺血浆暴露量,因此无需对肾功能不全的患者调整剂量 。
在健康受试者研究中,康替唑胺对MRSA和MSSA的MIC均≤1 mg/L且低于利奈唑胺;康替唑胺在800 mg,bid方案下,即使在MIC=4 mg/L时,预计仍可保持90%以上的达标率;康替唑胺800 mg、1200 mg或 1600 mg,bid方案下,体内暴露量随剂量升高疗效更好。
在中国患者研究中,康替唑胺对MRSA的MIC均≤1 mg/L;在常规饮食状态下,连续给药14 天后,800 mg bid的剂量方案治疗 MRSA感染时累积响应百分率(CFR)和达标概率(PTA)为90%或更高;可长疗程治疗。AUC/MIC为23时可达到较高疗效。
康替唑胺的临床药理学特点总结如下:
① 口服体内暴露量随剂量增加而增加,食物可促进吸收;
② 平均表观分布容积约为0.61 L/kg,提示体内分布广泛;
③ 每12 h服药一次,连续服药7~14天,无明显蓄积;
④ 由FMO5酶代谢,发生药物间相互作用可能性较小;
⑤ 肾功能不全患者、轻中度肝功能不全患者无须调整剂量;
⑥ 康替唑胺PK/PD靶值比利奈唑胺更低,更容易达到临床治疗目标;
⑦ 在健康受试者人群康替唑胺治疗剂量 800mg 不导致 QTc 间期延长;
⑧ 安全性和耐受性良好,比利奈唑胺更少发生骨髓抑制毒性。
本文转发自SIFIC感染视界
查看更多