查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





↑↑↑
点我一键到达清单列表
尽管术前患有肺部疾病和/或心功能不全的患者发生ARDS的风险可能较高,术中和术后可以优化相关因素,以最大限度地降低ARDS的发生风险。
1. 肺功能受到广泛的左心室合并症的负面影响。
2. 左侧心脏瓣膜病、左室射血分数低和晚期左室舒张功能障碍均导致左室舒张末压升高和左室顺应性差。
3. 直接手术损伤和体外循环(CPB)的使用通常是术中引发肺部炎症的因素。
从心脏麻醉师和重症监护医师的角度来看,有一些关键因素可能有助于降低心脏手术后ARDS的发生率(表2)。
表2 限制心脏手术后ARDS发病率的关键因素(心脏麻醉师和重症监护医师的观点)

特别讨论了以下内容。
优化机械通气
使用小潮气量(TV)是ARDS患者通气的“准则”。一项荟萃分析表明,在没有ARDS的患者中,使用低TV的肺保护性通气策略也与临床预后的改善相关;然而,PREVENT研究显示,与高TV策略(8~10 ml/kg)相比,低TV策略(4~6 ml/kg的预测体重)并没有改变使用呼吸机的天数。
接受更大TV治疗的患者的器官功能障碍和ICU住院天数增加。
肺开放策略并不能降低术后肺部并发症的发生率。
尽管肺开放策略在短期内改善了背侧通气,但这种益处并不具有持续性,并与上皮性肺损伤的更高的血浆生物标志物水平相关,提示肺过度膨胀。
在术中“开胸”条件下,肺开放策略可能导致肺扩张,并且对照组的肺复张已经达到最大限度。
表3 针对心脏手术患者潮气量和/或呼气末正压组合的随机对照研究
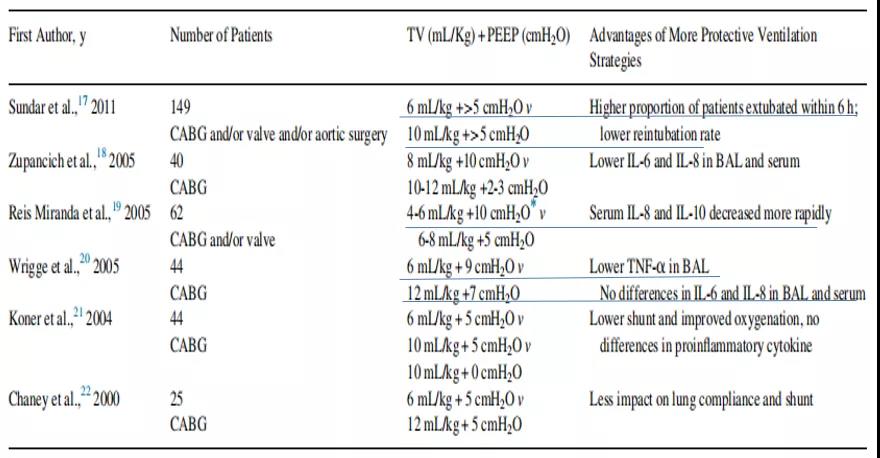
6 h内拔管的患者比例较高;再插管率较低。
BALF和血清中IL-6和IL-8水平下降。
血清中IL-8和IL-10的下降速度更快。
BALF中肿瘤坏死因子-α(TNF-α)水平较低;BALF和血清中IL-6和IL-8无差异。
降低分流功能,改善氧合功能;促炎细胞因子无差异。
对肺顺应性和分流功能的影响较小。
在术中和术后期间保持驱动压尽可能低似乎是合理的,低TV(基于预测的体重)和最佳的PEEP水平(从心肺角度来看是最佳的)。
另一个值得研究的问题是使用单肺通气(OLV),其对麻醉师来说是一项新的挑战,关于心脏手术期间最佳术中OLV管理的证据仍然很少。
输血相关急性肺损伤(TRALI)是输血的严重并发症,伴随着发病率和死亡率的增加。其发病时间通常在输血后6小时内。
相关文献
在心脏手术中,应实施旨在降低TRALI风险的操作,包括术前纠正贫血,避免过度的血液稀释和液体超负荷,以及控制围手术期出血。
也有学者建议避免使用CPB或限制其持续时间。其中,“输血束”的实施可能有助于减少所有血液制品的输血。
纤维蛋白原和凝血酶原复合物的使用显著减少了整体和单独的血液制品输血。
最小化MV的影响并优化血流动力学
MV对右心室功能的影响是主要的。右心室不仅对前负荷高度敏感,而且对后负荷的快速增加高度敏感,如缺氧、酸中毒和/或胸内高压。
衰竭的右心室具有延长的心肌壁应变,最终超过左心室肌纤维应变的持续时间。
超声心动图早期检测右心室功能障碍可能对建立及时的心血管支持或调整MV设置具有临床意义。强制通气期间静脉回流的减少,特别是使用高PEEP时,可能导致液体过量。
在治疗ARDS患者的大型随机对照试验中,已经提出并研究了几种方案,但并非所有方案在心脏手术围手术期均可行。
1 无创呼吸支持
无创呼吸支持在成年ARDS患者中的作用仍存在争议,轻度ARDS患者可能从这种干预中获益。
在RCT中,使用经鼻高流量氧疗(HFNO)减少了住院时间和心脏手术后再入ICU的风险。相反,HFNO在降低心脏手术后再插管风险方面的仍存在争议。
连续气道正压和/或无创通气(NIV)已被提议用于改善心脏手术患者的氧合,用于防止再插管和治疗心脏手术后的肺部并发症。
最近的一项荟萃分析证明,心脏手术后预防性使用NIV可以缩短住院天数和ICU住院天数,在心脏和肺部并发症方面没有差异。
2 神经肌肉阻断剂
一项随机对照试验发现,对中至重度ARDS患者(PaO2/FiO2<150 )使用神经肌肉阻断剂可提高调整后的90天存活率,并缩短呼吸机使用时间,而不增加肌无力。
在ROSE研究中,将深度镇静和麻痹的患者与轻度镇静且无麻痹的对照组患者进行了比较,结果发现,两组之间的医院死亡率几乎相同,与对照组患者相比,神经肌肉阻断剂组患者体力活动较少,心血管不良事件较多。
最近的证据不支持在ARDS患者中使用神经肌肉阻断剂,尤其是在可能追求较轻镇静的情况下。在缺乏强有力的理论依据的情况下,将神经肌肉阻断剂的使用限制在需要深度镇静的中重度ARDS患者中似乎是合理的,可能使用早期镇痛并将其限制在短期内。
3 俯卧位
具有里程碑意义的PROSEVA研究显示,保持约16 h/d天的俯卧位改善了中重度ARDS患者的预后(PaO2 /FiO2<150),俯卧位组患者28 d死亡率减半(仰卧位组为16.0%~33%)。
俯卧位对ARDS患者的右心室显示出积极的效应,显著降低了房室-左室舒张末期面积比和三尖瓣反流的发生率。尽管心率降低,但左室舒张末期容积更大,心脏指数有所改善。
一项回顾性研究纳入心脏手术后进行3次(中位数)治疗的患者,平均PaO2/FiO2比值为87。俯卧位结束时,PaO2/FiO2比值提高至194,仰卧位1 h后略有下降(146),俯卧位24 h后再次升高(184)。
4. 高频振荡通气
2项随机对照试验证明,高频振荡通气(HFOV)在ARDS患者中并未显示出获益,尽管有荟萃分析显示,PaO2/FiO2较低(<64)的患者使用HFOV,其生存率有可能提高。
Guervilly等证明,从常规通气到HFOV,平均气道压力增加5、10、15 cmH2O,显著增加右心室功能障碍和/或心力衰竭的患者数量,这些变化通过恢复常规通气可逆转。
由于没有证据支持在ARDS患者中使用HFOV,并且从心血管角度考虑了HFOV的负面影响,本综述作者认为不应在心脏手术后实施HFOV。
5 体外CO2清除与体外膜氧合
SUPERNOVA研究表明,中度ARDS患者可以安全地接受体外CO2清除(ECCO2R),从而减少VT和驱动压。
体外膜氧合(ECMO)对于ARDS患者的治疗仍存在争议。ECCO2R和ECMO可能分别代表中度和重度ARDS患者的合理选择,但需要更多的数据支持。
几种ECMO策略使用(V-V、V-A,经皮或中央插管)应考虑临床条件,包括右心室功能障碍的存在。这些策略使患者面临插管和全身抗凝的风险,并且应考虑心脏手术围手术期开始全身抗凝时出血和输血的高风险。
6 肺复张和PEEP上升
ARDS的另一治疗策略是采用肺复张和提高PEEP。最近的研究表明,与低PEEP相比,肺复张和PEEP滴定增加了28 d死亡率。
一项在非ARDS的择期心脏手术患者中进行的研究表明,在CPB分离和ICU到达时进行2次短暂的肺活量调整,可改善氧合,减少肺不张。
肺容积的增加和PEEP升高可能会改善气体交换,但代价是增加右心室后负荷。肺复张可能会导致严重的心血管结局,即使是在正常血容量或高血容量的情况下。
若增加PEEP时,如果PaO2/FiO2未能改善,临床医生应确认是否因卵圆孔未闭而导致显著的心房间隔分流。
7 吸入性一氧化氮
目前不支持ARDS患者使用吸入一氧化氮(iNO)。一项荟萃分析显示,尽管氧合有短暂的改善, 但iNO与使用呼吸机天数、MV持续时间、多器官衰竭的改善、生活质量、ICU/住院时间或成本效益的差异无关。
iNO增加了肾损害的风险。
心脏病患者肾损伤的基线风险更高,iNO可能进一步导致肾功能恶化。
1. 需要在多个层面(危险因素、诊断、治疗选择)对心脏手术后ARDS的发生进行更多的研究。
2. 预防肺损伤似乎是最重要的,需要更好地描述危险因素。
3. 避免过多的围手术期输血以及优化通气和血流动力学似乎是最可改变的危险因素。
4. 对于心脏手术后发生ARDS的患者,体外支持技术可能是有效的选择。
5. 可根据具体情况考虑使用神经肌肉阻断剂、俯卧位和iNO,而应避免积极的肺复张和振荡通气。
来源 中国呼吸治疗 作者 广西壮族自治区江滨医院呼吸康复科 韦晓丹
查看更多