查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





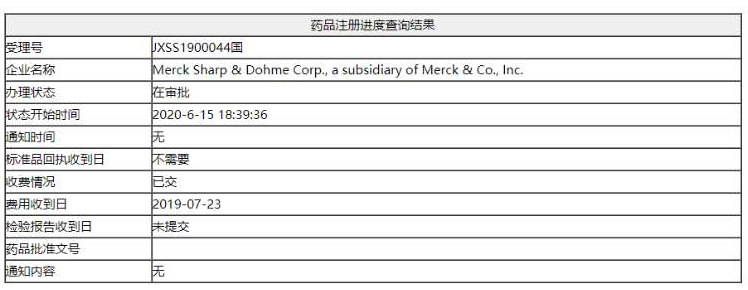
该受理号所对应的适应证为K药用于既往一线全身治疗失败的、局部晚期或转移性食管鳞状细胞癌(ESCC)患者的治疗。
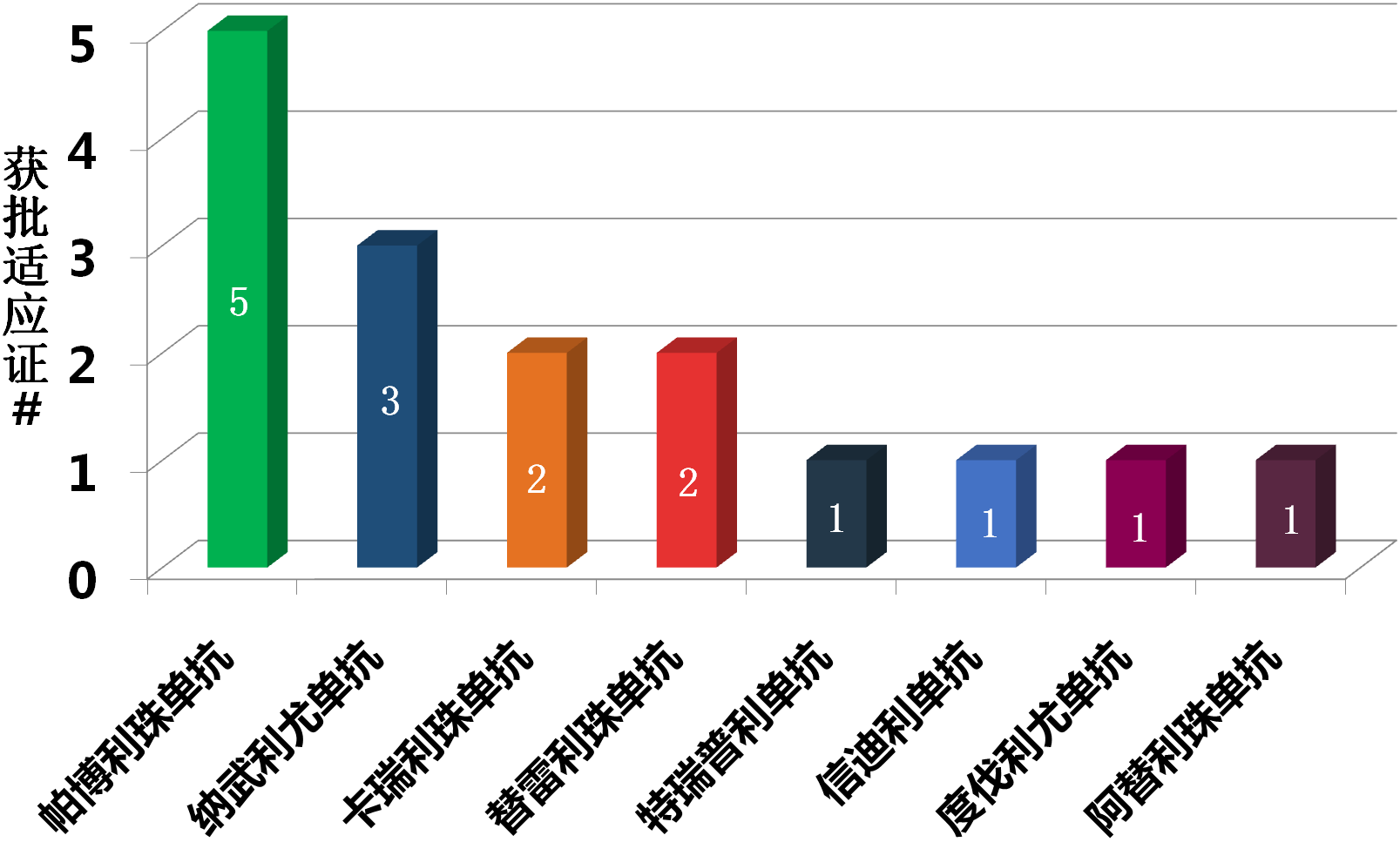
一旦获批,这将是K药在华获批的第五个适应证,居当前国内8个PD-1/PD-L1免疫检查点抑制剂获批适应证数量之首。
 该适应证也将是K药在消化道肿瘤治疗领域获批的第一个适应证。 目前,K药在国内已获批二线治疗黑色素瘤,以及2019年在8个月内一口气“拿下”的三个一线治疗非小细胞肺癌(NSCLC)的适应证,包括联合化疗一线治疗转移性非鳞NSCLC、联合化疗一线治疗转移性鳞状NSCLC以及单药一线治疗PD-L1表达阳性(TPS≥1%)的局部晚期或转移性NSCLC。
该适应证也将是K药在消化道肿瘤治疗领域获批的第一个适应证。 目前,K药在国内已获批二线治疗黑色素瘤,以及2019年在8个月内一口气“拿下”的三个一线治疗非小细胞肺癌(NSCLC)的适应证,包括联合化疗一线治疗转移性非鳞NSCLC、联合化疗一线治疗转移性鳞状NSCLC以及单药一线治疗PD-L1表达阳性(TPS≥1%)的局部晚期或转移性NSCLC。
美国FDA于2019年7月31日批准K药用于一线治疗后出现进展的,PD-L1表达阳性(CPS≥10)的局部晚期或转移性食管鳞癌, K药也因此成为全球首个获批治疗食管癌的PD-1免疫检查点抑制剂。
该适应证的获批是基于一项全球多中心、开放标签、随机对照的III期临床研究KEYNOTE-181的结果。该研究结果首次于2019年的ASCO-GI大会公布结果,并于2019年ASCO大会上公布了更新的总生存数据。
结果显示在PD-L1表达阳性 (CPS评分≥10)的患者中(n=222),
K药组的中位OS为9.3个月,而化疗组的中位OS为6.7个月;死亡风险降低33%(HR = 0.67,95%CI 0.52-0.89,p = 0.0029)。
K药组患者在12个月时的总生存率为42%, 是化疗组 (20%)的两倍。
在食管鳞癌患者(n=401)中,
K药组中位OS达到8.2个月, 化疗组的中位OS为7.1个月; 死亡风险降低了25%的(HR = 0.75,95%CI 0.61-0.80,p = 0.0035)。
K药组患者在12个月时的总生存率为39%,而化疗组仅为25%。
K药治疗食管癌的适应证是其在美国获批的第21个适应证, 成为在美国获批适应证最多的PD-1单抗(截至发稿日,帕博利珠单抗在美国获批适应证已达23个)。
KEYNOTE-181中国亚组的研究结果由北京大学肿瘤医院副院长、消化内科主任沈琳教授在2019欧洲肿瘤内科学学会(ESMO)年会上正式公布。
结果显示, 在所有意向治疗(ITT)人群和食管鳞癌人群中, K药治疗组的中位总生存(mOS)都达到8.4个月,化疗组的mOS为5.6个月,死亡风险都降低45%; ITT和食管鳞癌人群12个月的生存率分别为36%和35.7%, 分别是化疗组(ITT组, 17%;食管鳞癌,15.3%)的两倍以上(如下图)。
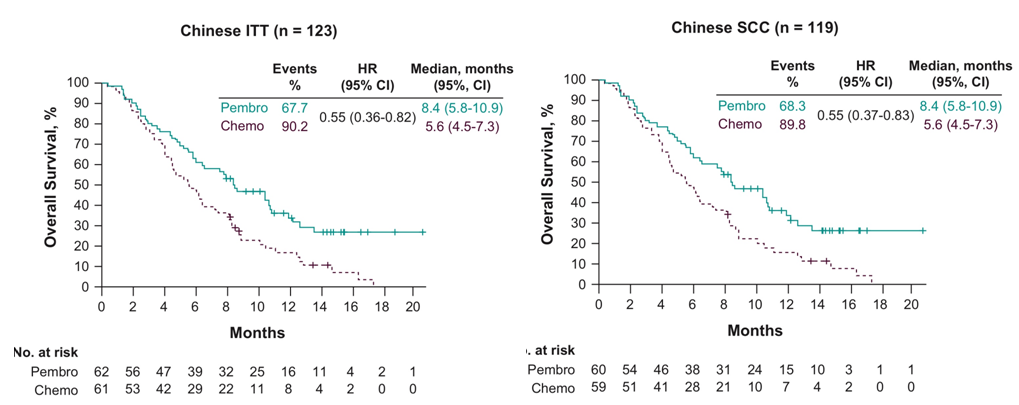 帕博利珠单抗治疗中国食管癌(ITT和食管鳞癌人群)带来显著OS获益
帕博利珠单抗治疗中国食管癌(ITT和食管鳞癌人群)带来显著OS获益
不难看出, 相比KEYNOTE-181的全球研究人群的治疗数据,K药治疗中国人群带来的OS获益更显著,死亡风险降低幅度是整体研究人群的3倍:中国人群45% (HR, 0.55[0.36-0.82], 95% CI),相比整体人群仅有的15% (HR, 0.85[0.72-1.01], 95% CI p=0.031)。
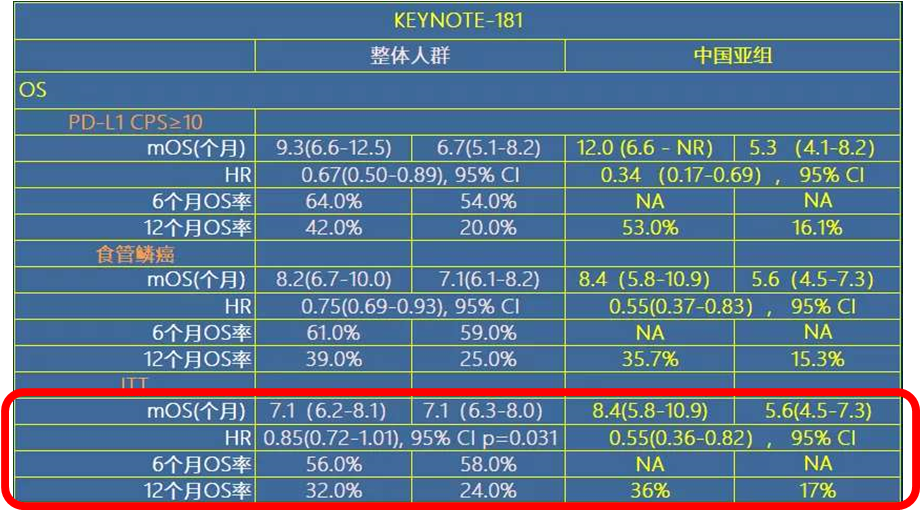 帕博利珠单抗治疗全球人群和中国亚组人群的OS数据对比
帕博利珠单抗治疗全球人群和中国亚组人群的OS数据对比
该“偏向性”在食管鳞癌和PD-L1表达阳性(CPS≥10)人群都有体现。
而且在PD-L1表达阳性(CPS≥10)的人群中,相比化疗方案,K药治疗中国人群的中位OS达到12.0个月, 降低死亡风险66%, 降低幅度是整体人群的2倍;在12个月时,超过一半的患者仍然存活,OS率是化疗组的3倍多,堪比一线疗效。
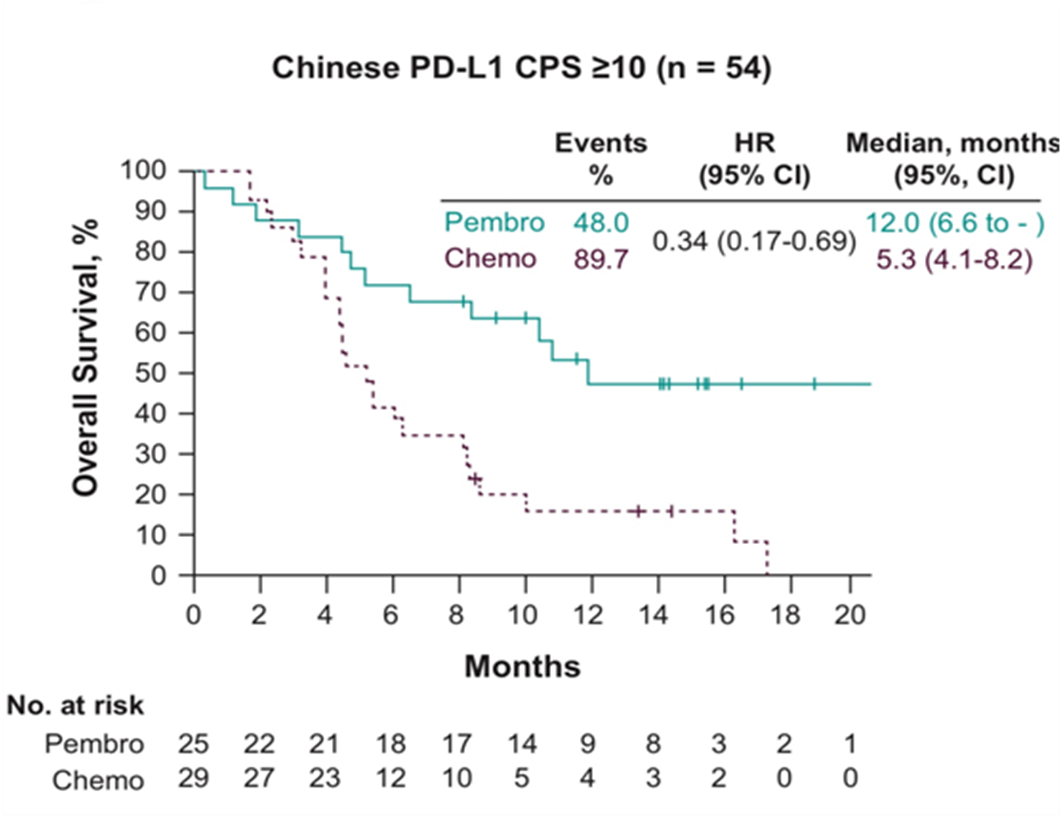 帕博利珠单抗治疗中国PD-L1 表达阳性(CPS≥10)食管癌带来显著OS获益
帕博利珠单抗治疗中国PD-L1 表达阳性(CPS≥10)食管癌带来显著OS获益
沈琳教授指出,食管癌治疗能带来中位OS超过12个月,近乎于化疗一线治疗能带来的OS, 这是食管癌治疗的一个历史性的突破;而且更重要的是,免疫治疗的疗效不仅限于PD-L1表达阳性的患者,因为ITT人群在帕博利珠单抗治疗后死亡风险也能降低45%。
我国食管癌的发病率和死亡率都居世界首位。世界卫生组织下属国际癌症研究机构(IARC)于2018年9月发布的《全球癌症报告》的统计数据显示,我国食管癌新发患者和死亡患者的人数占全球的55%左右。
我国食管癌五年生存率仅15%-25%。究其原因,有若干因素。首先,食管癌早期症状隐匿,我国约70%的患者在确诊时已为局部晚期或晚期转移性食管癌,失去了根治性手术机会,大多依赖化疗和/或放疗方案进行治疗。其次,系统治疗方案的疗效有限,在过去近50年未有重大突破,有效率低、复发率高。东西方食管癌差异假说对不同治疗的预后究竟有多大影响,之前还未有III期研究进行证实。对于食管癌的治疗困惑还有很多。
K药所展示的对于中国食管癌患者的“偏好”恰是目前全球范围内首次有III期临床证实了东西方食管癌的流行病学差异与治疗预后相关。而本次K药的审批受理,无疑将拉开食管癌治疗的全新时代篇章。
"我觉得国内的食管癌患者若有机会都不应放弃这个机会,因为这是目前复发局部晚期或转移性食管癌患者唯一能够实现长期生存的机会。“
—— 沈琳教授
查看更多