查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





为全面反映2021年我国药品不良反应监测情况,提高安全用药水平,更好地保障公众用药安全,国家药品不良反应监测中心组织编撰《国家药品不良反应监测年度报告(2021年)》。
第1章 药品不良反应监测工作情况
2021年,国家药品不良反应监测中心在国家药品监督管理局的领导下,深入贯彻落实党中央、国务院决策部署,以习近平总书记“四个最严”要求为根本遵循,扎实开展药品不良反应监测评价工作,监测评价体系逐步健全,法规制度日趋完善,报告数量和质量稳步提升,监测评价手段和方法更加成熟,各项工作取得明显成效,为药品监管提供科学有力支撑,切实保护和促进公众健康。
一是强化布局谋篇,推动体系和能力建设。推进落实国务院办公厅《关于全面加强药品监管能力建设的实施意见》《国家药监局关于进一步加强药品不良反应监测评价体系和能力建设的意见》,加快构建“一体两翼”工作格局,不断完善监测评价制度体系,持续提高监测评价能力。
二是完善法规体系,出台配套技术规范。发布我国首部《药物警戒质量管理规范》,完成《药物警戒检查指导原则》《药物警戒体系主文件撰写指南》起草和征求意见,指导药品上市许可持有人(以下简称持有人)开展监测、报告、分析和评价工作,推动药物警戒制度建立健全。
三是科学分析评价,发挥技术支撑作用。密切关注国内外监管动态,强化监测数据分析评价。根据评价结果,及时发布药品安全警示信息。2021年发布注销小儿酚氨咖敏颗粒等品种药品注册证书公告2期,发布药品说明书修订公告48期。
四是有效监测风险,保障疫情防控大局。严格落实常态化疫情防控措施,持续加强新冠肺炎防控及治疗药品监测、分析和评价,密切跟进《新型冠状病毒肺炎诊疗方案》所列药品,重点关注相关预警信号、群体事件及药品不良反应报告情况,切实保障疫情防控用药安全。
五是优化信息系统,助力监测评价发展。完成E2B(R3)电子数据管理系统建设,实现在线报告、可扩展标记语言格式文件递交多种途径报告功能。完善国家药品不良反应监测信息化体系,提高数据分析效率,提升监测评价效能。
第2章 药品不良反应/事件报告情况
2.1 报告总体情况
2.1.1 2021年度药品不良反应/事件报告情况
2021年全国药品不良反应监测网络收到《药品不良反应/事件报告表》196.2万份。1999年至2021年,全国药品不良反应监测网络累计收到《药品不良反应/事件报告表》1,883万份(图1)。

图1 1999年-2021年全国药品不良反应/事件报告数量增长趋势
2.1.2 新的和严重药品不良反应/事件报告情况
2021年全国药品不良反应监测网络收到新的和严重药品不良反应/事件报告59.7万份;新的和严重药品不良反应/事件报告占同期报告总数的30.4%。
2021年全国药品不良反应监测网络收到严重药品不良反应/事件报告21.6万份,严重药品不良反应/事件报告占同期报告总数的11.0%(图2)。
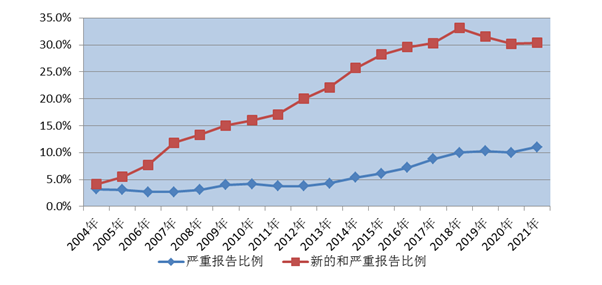
图2 2004年-2021年新的和严重以及严重药品不良反应/事件报告比例
2.1.3 每百万人口平均报告情况
每百万人口平均报告数量是衡量一个国家药品不良反应监测工作水平的重要指标之一。2021年我国每百万人口平均报告数为1,392份。
2.1.4 药品不良反应/事件县级报告比例
药品不良反应/事件县级报告比例是衡量我国药品不良反应监测工作均衡发展及覆盖程度的重要指标之一。2021年全国98.0%的县级地区报告了药品不良反应/事件。
2.1.5 药品不良反应/事件报告来源
持有人、经营企业和医疗机构是药品不良反应报告的责任单位。按照报告来源统计,2021年来自医疗机构的报告占86.3%;来自经营企业的报告占9.4%;来自持有人的报告占4.1%;来自个人及其他报告者的报告占0.2%(图3)。

图3 2021年药品不良反应/事件报告来源
按照报告数量统计,2021年持有人报送药品不良反应/事件报告共计8.1万份,同比增长22.3%。其中,新的和严重药品不良反应/事件报告占持有人报告总数的34.7%,高于总体报告中新的和严重药品不良反应/事件报告占比。
2.1.6 报告人职业
按照报告人职业统计,医生占55.6%,药师占25.5%,护士占13.0%,其他职业占5.9%(图4)。
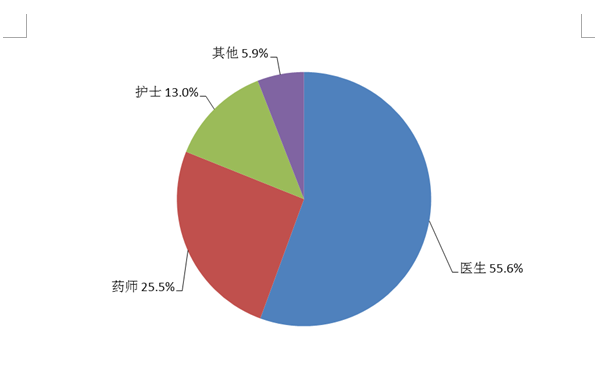
图4 2021年报告人职业构成
2.1.7 药品不良反应/事件报告涉及患者情况
2021年药品不良反应/事件报告中,女性多于男性,男女性别比为0.86:1。从年龄分布看,14岁以下儿童占8.4%,65岁及以上老年患者占31.2%(图5)。
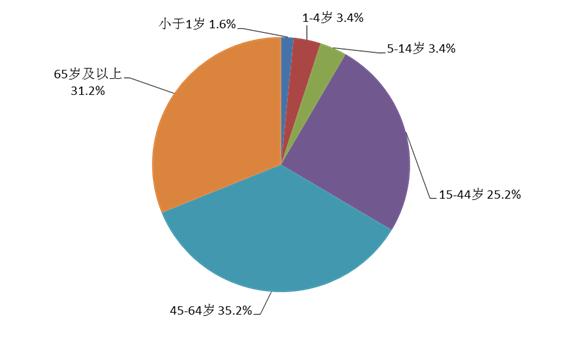
图5 2021年药品不良反应/事件报告涉及患者年龄
2.1.8 药品不良反应/事件报告涉及药品情况
按照怀疑药品类别统计,化学药品占82.0%、中药占13.0%、生物制品占2.0%、无法分类者占3.0%(图6)。
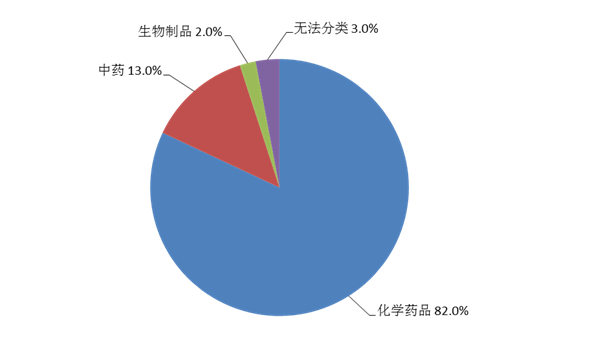
图6 2021年药品不良反应/事件报告涉及药品类别
按照给药途径统计,2021年药品不良反应/事件报告中,注射给药占55.3%、口服给药占37.9%、其他给药途径占6.8%。注射给药中,静脉注射给药占90.5%、其他注射给药占9.5%(图7)。
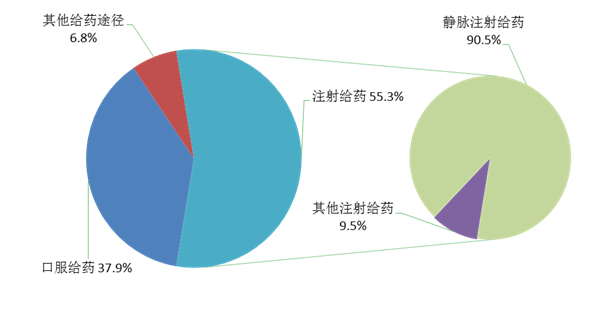
图7 2021年药品不良反应/事件报告涉及给药途径
2.1.9 药品不良反应/事件累及器官系统情况
2021年报告的药品不良反应/事件中,累及器官系统排名前3位依次为胃肠系统疾病、皮肤及皮下组织类疾病、全身性疾病及给药部位各种反应。
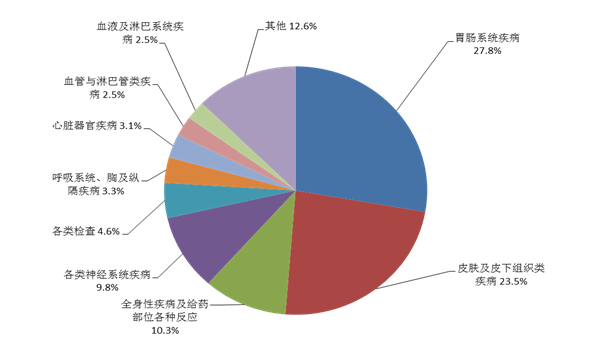
图8 2021年药品不良反应/事件累及器官系统
2.2 化学药品、生物制品监测情况
2.2.1 总体情况
2021年药品不良反应/事件报告中,涉及怀疑药品210.4万例次,其中化学药品占82.0%,生物制品占2.0%。2021年严重不良反应/事件报告涉及怀疑药品27.8万例次,其中化学药品占87.7%,生物制品占4.3%。
2.2.2 涉及患者情况
2021年化学药品、生物制品不良反应/事件报告中,男女患者比为0.87:1,女性多于男性。14岁以下儿童患者的报告占8.6%,65岁及以上老年患者的报告占31.4%。
2.2.3 涉及药品情况
2021年药品不良反应/事件报告涉及的化学药品中,例次数排名前5位的类别依次为抗感染药、肿瘤用药、心血管系统用药、镇痛药、消化系统用药。
2021年严重药品不良反应/事件涉及化学药品中,报告数量最多的为肿瘤用药,占33.2%;其次是抗感染药,占28.1%。按严重报告占本类别报告比例计算,肿瘤用药的严重报告比例最高,为43.0%,其次是运动系统用药,为19.9%。
2021年药品不良反应/事件报告涉及的生物制品中,细胞因子占71.7%、抗毒素及免疫血清占16.0%、血液制品占0.8%、诊断用生物制品占0.2%。
按剂型统计,2021年化学药品不良反应/事件报告中,注射剂、口服制剂所占比例分别为59.5%和34.8%,其他剂型占5.7%。生物制品中,注射剂、口服制剂占比分别为83.5%和0.2%,其他制剂占16.3%。
2.2.4 总体情况分析
2021年化学药品和生物制品不良反应/事件报告情况与2020年相比未出现显著变化。
从不良反应涉及患者年龄看,14岁以下儿童占比依然延续了去年的下降趋势,但降幅有所减缓,儿童用药的安全性总体依然良好;65岁及以上老年患者占比持续升高,提示临床应重点关注老年患者的用药安全。
从药品剂型上看,注射剂占比仍呈下降趋势,风险进一步降低。从药品类别上看,抗感染药报告数量居于首位,其占比已连续十年呈下降趋势,抗感染药的合理使用显现出明显效果;肿瘤用药占比继续上升,其严重报告构成比居首位,提示临床需继续加强该类药品的风险管理。生物制品报告占比有所升高,其中细胞因子的占比升幅相对突出,主要与近年来PD-1/PD-L1类新型肿瘤用药上市品种快速增加并且一些品种列入医保目录有关。
2.3 中药监测情况
2.3.1 总体情况
2021年药品不良反应/事件报告中,涉及怀疑药品210.4万例次,其中中药占13.0%;2021年严重不良反应/事件报告涉及怀疑药品27.8万例次,其中中药占5.1%。
2.3.2 涉及患者情况
2021年中药不良反应/事件报告中,男女患者比为0.81:1。14岁以下儿童患者占5.7%,65岁及以上老年患者占29.3%。
2.3.3 涉及药品情况
2021年药品不良反应/事件报告涉及的中药中,例次数排名前5位的类别分别是理血剂中活血化瘀药(24.5%)、清热剂中清热解毒药(11.7%)、祛湿剂中清热除湿药(7.1%)、祛湿剂中祛风胜湿药(5.2%)、补益剂中益气养阴药(4.9%)。2021年中药严重不良反应/事件报告的例次数排名前5位的类别分别是理血剂中活血化瘀药(39.0%)、补益剂中益气养阴药(10.7%)、清热剂中清热解毒药(8.6%)、开窍剂中凉开药(6.4%)、补益剂中补阳药(4.2%)。
2021年中药不良反应/事件报告按照给药途径统计,注射给药占27.5%、口服给药占60.5%、其他给药途径占12.0%。注射给药中,静脉注射给药占97.2%、其他注射给药占2.8%。
2.3.4 总体情况分析
与2020年相比,2021年中药不良反应/事件报告数量有所上升,但严重报告占比有所下降。从给药途径看,注射给药占比下降较为明显。从药品类别上看,活血化瘀药的报告数量依然居首位,但占比略有下降。从总体情况看,2021年中药占总体不良反应/事件报告比例呈下降趋势,但仍需要注意安全用药。
2.4 基本药物监测情况
2.4.1 国家基本药物监测总体情况
2021年全国药品不良反应监测网络共收到《国家基本药物目录(2018年版)》收载品种的不良反应/事件报告94.6万份,其中严重报告11.3万份,占11.9%。报告涉及化学药品和生物制品占88.6%,中成药占11.4%。
2.4.2 国家基本药物化学药品和生物制品情况分析
《国家基本药物目录(2018年版)》化学药品和生物制品部分共417个(类)品种。2021年全国药品不良反应监测网络共收到国家基本药物化学药品和生物制品药品不良反应/事件报告89.7万例次,其中严重报告13.5万例次,占15.0%。
2021年国家基本药物化学药品和生物制品不良反应/事件报告按照药品类别统计,报告数量排名前5位的分别是抗微生物药、心血管系统用药、抗肿瘤药、激素及影响内分泌药、治疗精神障碍药;累及器官系统排名前5位的是胃肠系统疾病、皮肤及皮下组织类疾病、各类神经系统疾病、全身性疾病及给药部位各种反应、各类检查。
2.4.3 国家基本药物中成药情况分析
《国家基本药物目录(2018年版)》中成药共涉及268个品种。2021年全国药品不良反应监测网络收到国家基本药物中成药不良反应/事件报告11.5万例次,其中严重报告5,950例次,占5.2%。2021年国家基本药物7大类中成药中,药品不良反应/事件报告总数由多到少依次为内科用药、骨伤科用药、妇科用药、外科用药、耳鼻喉科用药、儿科用药、眼科用药。
以上监测数据表明,2021年国家基本药物监测总体情况基本保持平稳。
本文转发自国家药品监督管理局
查看更多