查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





目前,针对人类免疫缺陷病毒(HIV)感染者的治疗主要依靠抗反转录病毒疗法(ART),虽然ART能有效抑制病毒复制,使感染者体内的病毒控制在无法检测的水平,显著延长了他们的寿命,但无法完全消除HIV,感染者的体内仍然存在病毒储存库。
另外,HIV具有高变异率的特点,常常能够逃避免疫系统的追杀,这也是无法根除HIV的主要障碍。然而,潜伏的HIV可能与慢性炎症有关,会诱发诸如心血管疾病,糖尿病和恶性肿瘤疾病等。到目前为止,HIV感染没有治愈的特效药,患者需终身服用药物来抑制病毒复制。因此,找到彻底消除HIV的药物,是全世界研究者们都在努力的事。
近日,来自华盛顿大学医学院Shan Liang领衔的研究团队在《科学》杂志上发表重要研究成果。他们发现,原来人的细胞中有一个HIV-1感染的“警报器”——CARD8,它作为炎性小体感受器,可识别具有活性的HIV-1蛋白酶,启动由其介导的程序性细胞死亡,以此来清除感染HIV-1的细胞。
HIV-1蛋白酶是病毒复制过程中关键酶之一,它的活化能使HIV-1变成具有感染性的成熟病毒,通过抑制它,可阻止病毒复制。因此,HIV-1蛋白酶是治疗HIV-1感染的靶点之一。而此次研究不同于以往“阻止复制”的治疗策略,而是通过提前活化细胞内的HIV-1蛋白酶,从而启动细胞程序性死亡,直接杀死感染细胞。
那研究团队是如何发现CARD8这一“报警器”的呢?我们知道,在大多数情况下,机体通过细胞内受体识别不同危险的刺激信号,从而引起抗感染的级联反应。其中, NLRP1是能形成炎症小体的受体,其含有未知功能的FIIND结构域和CARD结构域,因涉及的信号通路与许多疾病都息息相关,是被众多科学家研究的对象。
研究发现,小鼠中NLRP1b N端,能被炭疽芽孢杆菌致死因子蛋白切割,之后引起炎症小体组装和激活Caspase-1(CASP1)下游信号,使细胞发生程序性死亡。而人的CARD8与鼠的NLRP1结构相似,且CARD8具有在淋巴组织中高表达的特点,与CD4+T细胞和巨噬细胞的炎性体活化有关。
这表明在淋巴组织中,CARD8作为炎性小体感受器可有效发挥作用,而CD4T细胞是HIV-1感染的关键细胞。研究人员据此猜测,CARD8炎性小体可能是一个HIV-1感染的“警报器”,可触发感染细胞的死亡。
为了验证这一猜测,他们开展了一系列实验。首先,他们构建了用HIV-1感染表达CARD8的人肾上皮细胞(HEK293T),发现CARD8的N端被HIV-1蛋白酶切割了两次,而在感染突变的HIV-1细胞中(HIV-1蛋白酶无活性),CARD8的N端则无法被切割。研究者认为,CARD8是无法检测没有活性的HIV-1蛋白酶的。
通常情况下,被感染细胞中的HIV-1为了更好地潜伏,都会使蛋白酶不具活性,只有离开受感染的细胞后,HIV-1蛋白酶才会活化,这也就意味着HIV-1蛋白酶不仅逃过了细胞内CARD8的监测,还开始繁衍自己的后代了。那如果能在感染细胞内活化蛋白酶,就能拆穿HIV-1的诡计,靶向消灭它。
幸运的是,在2006年有报道称,临床上治疗感染HIV的非核苷类反转录酶抑制剂(NNRTI)药物,如利匹韦林(RPV)和依非韦伦(EFV),可增强细胞内Gag-Pol多蛋白二聚作用,引起潜伏的HIV-1蛋白酶活化[8]。
根据这一思路,研究者用RPV处理了被HIV-1感染的含有CASP1和促IL-1β表达的质粒的HEK293T细胞,促炎因子IL-1β能正常分泌,它是引起免疫反应和细胞焦亡的关键分子。但加入蛋白酶抑制剂洛匹那韦 (LPV)或敲除CARD8后,这种现象被阻断了。这些结果证明,在RPV作用下,HIV-1蛋白酶被活化后切割CARD8 N端,诱导IL-1β的分泌。
那NNRTI在人免疫细胞中是否也与HEK293T细胞中一样,能够通过激活HIV-1蛋白酶,引发CARD8警报呢?CARD8警报“响起”后,这类感染细胞又能否死亡?如果能成功的话,那就意味着人类有可能清除潜在的HIV-1。
确实有研究发现,NNRTI可引起存在潜伏HIV-1的CD4+ T细胞的死亡,但是其中的机制还不清楚[9-11]。基于综上研究,他们猜想感染细胞的死亡是由NNRTI活化HIV-1蛋白酶引起的,并通过CARD8炎性小体感受器激活CASP1,从而发生细胞死亡。
因此,研究团队用HIV-1感染人扁桃体组织中的原代CD4+ T细胞以及血液中单核细胞来源的巨噬细胞(MDM),从不同角度证明了自己的猜测:
首先,用EFV、RPV、LPV或组合的方式处理感染的MDM,结果显示,HIV-1蛋白酶活化会引发细胞死亡,并且细胞杀伤效果随时间增加而加强,而LPV能够抑制这一现象的发生。与此同时,他们还检测了与CASP1激活启动细胞死亡程序的关键因子IL-1β、p10和p20,结果显示,RPV成功激活了CASP1介导的程序性细胞死亡。相似的结果也出现在CD4+ T细胞中。
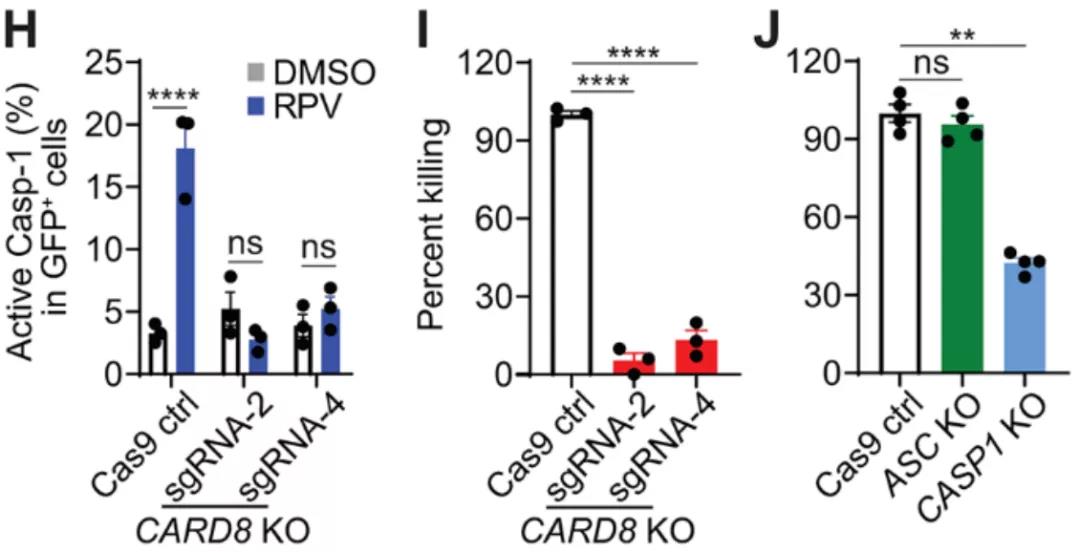
RPV处理的细胞相比对照(DMSO),细胞中CASP1被激活的百分比更高(H),死亡的感染细胞更多(I、J),但是在敲除了CARD8(CARD8 KO)或敲除了CASP1(CASP1 KO)的细胞中效果显著减弱
随后,在两类细胞中分别采用加入CASP1抑制剂、蛋白酶抑制剂以及敲除CARD8或敲除CASP1的方法,都同样出现了抑制IL-1β分泌及减少细胞杀伤的现象,证明了其推测。
结合之前的结果,研究团队将该方法用于临床感染的病人中。他们从接受ART的八位感染者体内获得血液CD4+ T细胞,用EFV和RPV处理后,发现所有患者体内感染HIV-1的细胞都显著减少了,并且有三名患者没有检测到病毒,证明了该机制清除了大部分潜在的HIV-1。
研究团队还证明了,在一些主要的HIV-1亚型中,该机制都可触发感染细胞的死亡,包括北美,欧洲,非洲和亚洲常见的菌株。说明了该机制的普适性,对HIV-1的治疗策略具有直接的影响。
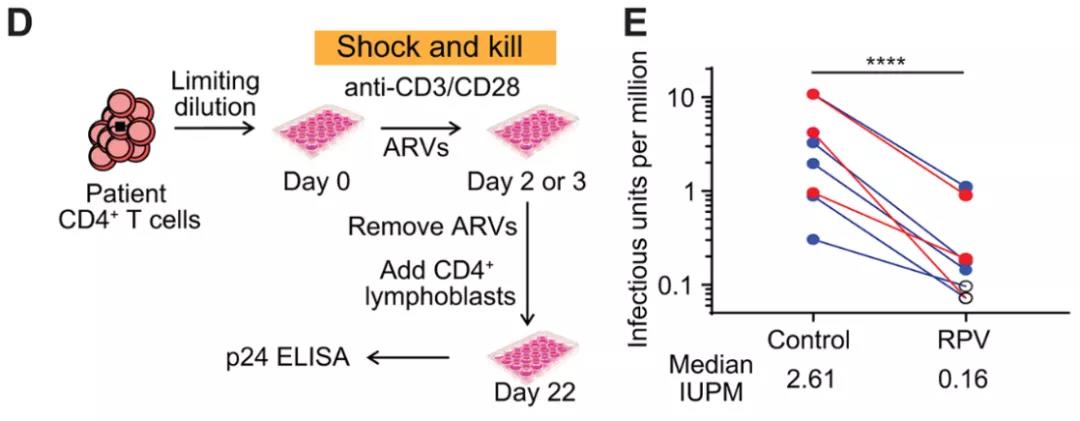
HIV-1感染者获取CD4+ T细胞后的处理方案(D)和结果(E),相比对照组(control),RPV组的感染细胞明显减少,红色为2.5μM剂量处理2天,蓝色为5μM剂量处理3天
总的来说,该机制在一定程度上解决了HIV-1因高变异率而逃过免疫系统追杀的问题。免疫系统就像一位狙击手,在NNRTI的帮助下,无论HIV-1突变程度如何,都可通过识别活化的HIV-1蛋白酶,而迅速击杀。
该研究提示我们在治疗患者初期,采用无蛋白酶抑制剂的NNRTI,可减少HIV-1在体内的病毒库。此外,可进一步研究NNRTI这类药物激活潜伏HIV-1的过程,从而开发出低剂量和快速杀伤细胞的特效药,为艾滋病患者带来治愈的希望。
未来,进一步探索CARD8炎性体能否识别其他病毒蛋白酶,也可以为其他一些病毒感染类疾病提供新的治疗思路。
文章转发自奇点网
查看更多