查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





——K药在国内首个消化道肿瘤适应证获批
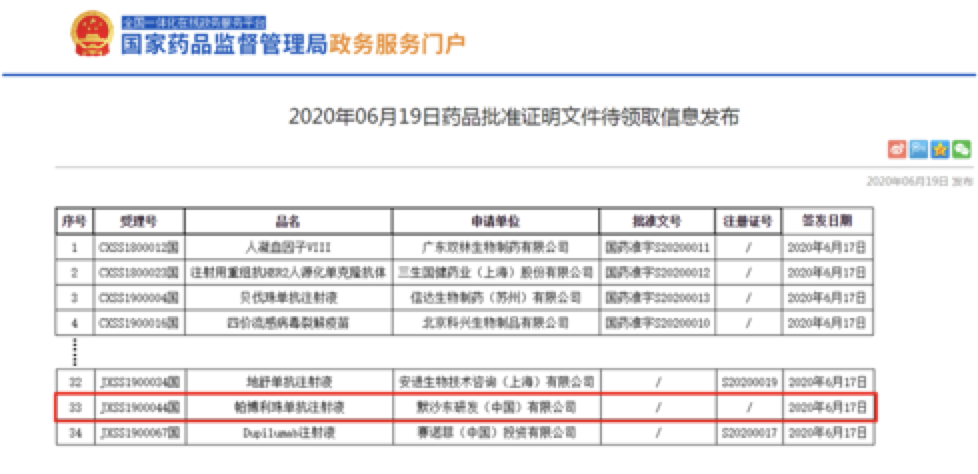
该受理号所对应的适应证为K药用于既往一线全身治疗失败的、局部晚期或转移性食管鳞状细胞癌(ESCC)患者的治疗。
这是K药在华获批的第五个适应证,居当前国内8个PD-1/PD-L1免疫检查点抑制剂获批适应证数量之首。
该适应证也将是K药在消化道肿瘤治疗领域获批的第一个适应证。 目前K药在国内已获批二线治疗黑色素瘤,以及2019年在8个月内一口气“拿下”的三个一线治疗非小细胞肺癌(NSCLC)的适应证,包括联合化疗一线治疗转移性非鳞NSCLC、联合化疗一线治疗转移性鳞状NSCLC以及单药一线治疗PD-L1表达阳性(TPS≥1%)的局部晚期或转移性NSCLC[1]。
该适应证的获批是基于一项全球多中心、开放标签、随机对照的III期临床研究KEYNOTE-181的结果。该研究结果首次于2019年美国临床肿瘤学会消化道肿瘤(ASCO-GI)年会上公布结果, 并由北京大学肿瘤医院副院长、消化内科主任沈琳教授在2019欧洲肿瘤内科学学会(ESMO)年会上首次公布中国亚组人群的研究结果[2]。
KEYNOTE-181研究共纳入了123例患者(119例食管鳞癌)随机分配至帕博利珠单抗组(n=62)和化疗组(n=61); 两组的中位随访时间分别为15.1个月和14.7个月。
结果显示, 在意向治疗(ITT)人群和食管鳞癌人群中, K药治疗组的中位总生存(mOS)都达到8.4个月,化疗组的mOS为5.6个月,死亡风险都降低45%; ITT和食管鳞癌人群12个月的生存率分别为36%和35.7%, 分别是化疗组(ITT组, 17%;食管鳞癌,15.3%)的两倍多(图)[2]。
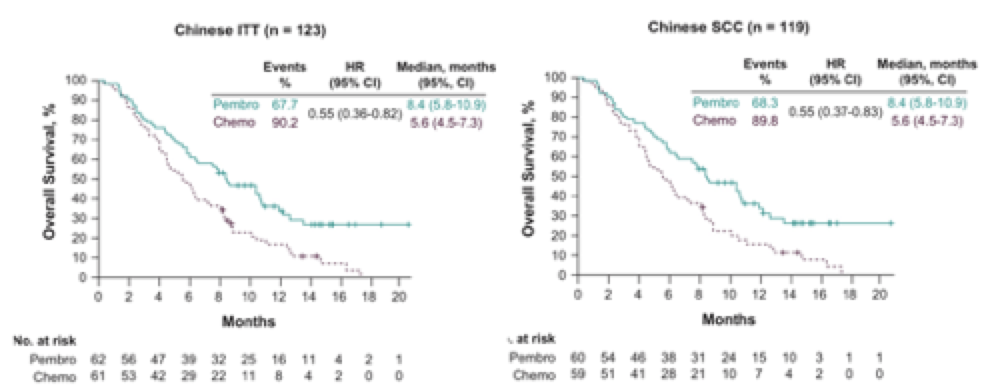
帕博利珠单抗治疗中国食管癌(ITT和食管鳞癌人群)带来显著OS获益[2]
而且在PD-L1表达阳性(CPS≥10)的人群中,相比化疗方案,K药治疗中国人群的中位OS达到12.0个月, 降低死亡风险66%(图);在12个月时,超过一半的患者仍然存活,OS率是化疗组的3倍多[2]。
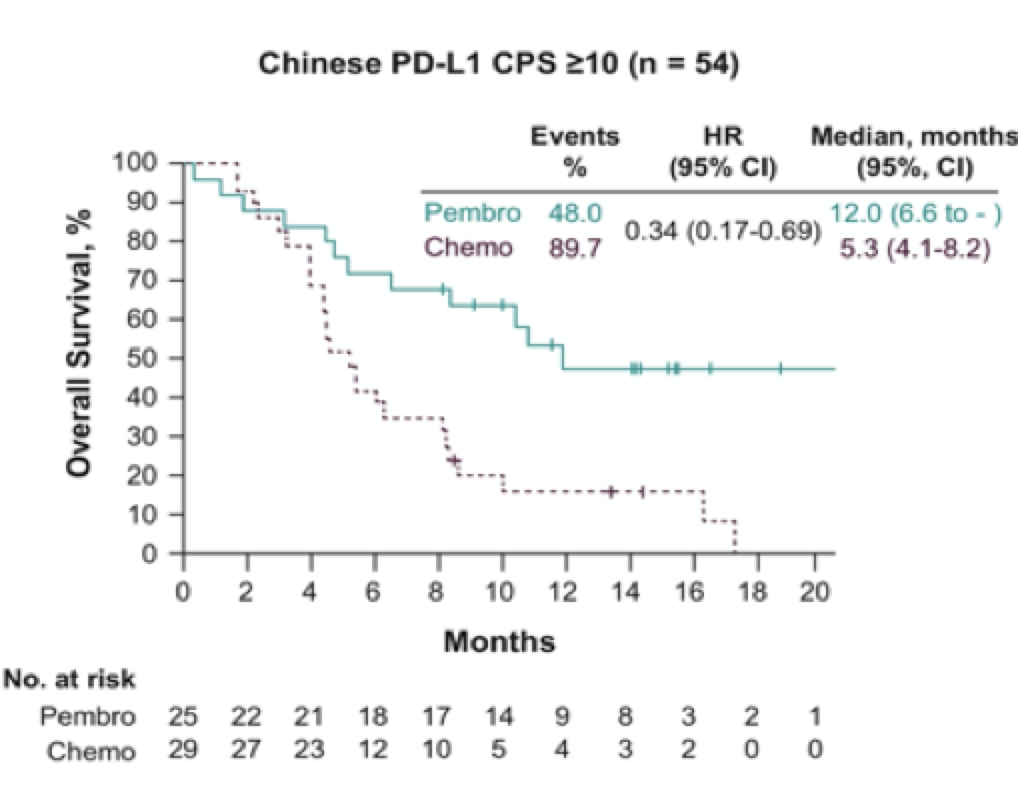
帕博利珠单抗治疗中国PD-L1 表达阳性(CPS≥10)食管癌带来显著OS获益[2]
沈琳教授指出,食管癌治疗能带来中位OS超过12个月,近乎于化疗一线治疗能带来的OS, 这是食管癌治疗的一个历史性的突破;而且更重要的是,免疫治疗的疗效不仅限于PD-L1表达阳性的患者,因为ITT人群在帕博利珠单抗治疗后死亡风险也能降低45%。
帕博利珠单抗组的与治疗相关的不良反应发生率低于化疗(K药组75.8%, 化疗组83.1%), 3~5级不良反应的发生率更是仅有化疗组的一半 (K药组21.0%, 化疗42.4%),而且也没有出现任何因脱靶而导致的反应性血管内皮细胞增生症(RCCEP)等不良反应。
我国食管癌的发病率和死亡率都居世界首位,食管癌新发患者和死亡患者的人数占全球的55%左右; 而且我国食管癌五年生存率仅15%~25%,背后的一个主要原因是我国约70%的患者在确诊时已为局部晚期或晚期转移性食管癌,失去了根治性手术机会,而多依赖化疗和/或放疗方案治疗。
而晚期转移性食管癌的治疗在过去几十年的发展缓慢,一线治疗仍以5-FU,或紫杉醇联合含铂化疗为主,有效率低,中位的总生存不到一年;因此,约60%~70%的食管癌患者最终可能需要接受二线治疗, 但二线治疗更是缺乏标准治疗方案。
KEYNOTE-181是全球首个证实PD-1抑制剂对于食管癌疗效的大型三期临床研究, 其中国亚组研究亦是首个公布的针对中国食管癌患者疗效的研究。K药获批治疗晚期食管癌,意味着免疫治疗将成为我国食管癌二线治疗的新标准, 从而打破食管癌系统治疗有效率低、副作用高疗效不尽人意的僵局。
[1] NMPA 官网
[2] Chen J et al., Pembrolizumab versus Chemotherapy in Patients with Advanced/Metastatic Adenocarcinoma or Squamous Cell Carcinoma of the Esophagus as Second-line Therapy: Analysis of the Chinese Sub-group in KEYNOTE-181, Abstract, 2019 ESMO
查看更多