入院情况:患者男性,53岁,职业:农民。主诉:咳嗽、咳痰伴气促4月余,加重1周。
现病史:患者1个月余前无明显诱因出现咳嗽、咳黄痰,量中,随后出现咯血,为痰中带血。发热,体温最高38.6℃,夜间为主,伴盗汗、乏力,无畏寒、寒战。于当地医院行血常规检查:WBC 12.26x109/L、N 10.19x109/L( 83.1% );胸部CT示:左上及右下肺感染征象。予抗感染治疗(具体不详)后症状无好转,并出现左上胸持续性隐痛,以咳嗽、深吸气时胸痛加剧,无放射痛。
遂至广东省某三甲医院住院(7-22至8-9),查血常规、PCT未见异常;血结核感染T细胞检测:阴性;痰X-pert及TB-DNA均阳性。
诊断:1.细菌性肺炎;2.肺结核。先后予左氧氟沙星、头孢哌酮钠舒巴坦钠、万古霉素抗感染治疗,予四联抗结核治疗共1周。患者体温恢复正常,咳嗽、咳痰症状好转后出院。
患者出院4天后自行停用抗结核药至我院门诊,我院门诊予莫西沙星抗感染2周。患者症状无好转,渐出现活动后气促、胸闷,并咯鲜血,每天量约10毫升,遂收治入院。
起病以来,患者无心悸、头晕、头痛,无皮疹、关节痛、光过敏现象。患者精神、睡眠可,胃纳稍差,大小便如常,体重下降约4kg。
既往史:无特殊。
个人史:吸烟30年,平均20支卷烟/天。无嗜酒史,无冶游史。
查体:T 36.8℃,P92次/分,R20次/分,SpO2 96%(吸空气下)。四肢血压:左上肢 113/72mmHg,右上肢 112/74mmHg,左下肢 126/68mmHg,右下肢 131/67mmHg。
神志清楚,慢性病容;皮肤黏膜无黄染及皮疹,全身浅表淋巴结未触及肿大;胸廓对称,双肺呼吸音粗,左下肺可闻及少许细湿啰音,未闻干啰音及胸膜摩擦音;心腹、四肢体查无异常。
影像学:

2019-07-17
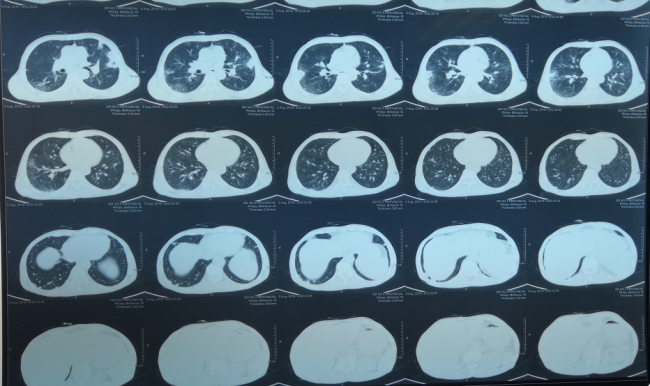
2019-08-05
双肺病变性质待查:特殊病原体感染?
常规:血常规(08-28):白细胞 8.10x109/L,中性粒细胞比率 64.0%,红细胞 4.57x1012/L,血红蛋白 132g/L,血小板304x109/L。大便常规+OB(-),尿化学与沉渣分析(-)。
血气分析:
生化:
肝功:总蛋白 67.6 g/L,白蛋白38.9g/L,谷丙转氨酶 39.6U/L,γ-GGT 228.0U/L ↑,总胆红素 9.6umol/L,直接胆红素 2.2 umol/L。
CX3生化八项:葡萄糖 7.80↑ mmol/L(随机),尿素氮 2.5↓ mmol/L,肌酐88.00 umol/L,钾3.40↓ mmol/L,钠 139.0 mmol/L,氯 111.0 mmol/L,钙 2.25 mmol/L。
感染指标及病原学:
降钙素原检测: <0.05 ng/mL;血沉: 69↑ mm/h;细菌学:痰细菌培养、肺泡灌洗液细菌培养 、肺组织细菌培养、肺泡灌液NGS均为阴性。

结核相关:血T-SPOT(08-29):抗原A(ESAT-6)孔 10 ↑个,抗原B(CFP-10)孔 2↑个;多次痰结核菌涂片检查: (-);痰X-pert: (-);肺泡灌洗液X-pert: (-);气管镜刷检结核菌涂片检查: (-);肺泡灌洗液结核菌培养:结果未回报;
真菌相关:血真菌1-3-β-D-葡聚糖定量检测:<10 pg/mL;血曲霉菌抗原、隐球菌抗原检测:(-);痰真菌培养:(-);肺泡灌洗液GM、隐球菌抗原:(-);肺泡灌洗液真菌培养:(-);肺组织真菌培养:(-)。
免疫风湿:
抗“O” :162.0 IU/mL;类风湿因子RF:9.3IU/mL;免疫八项:CH50 62.7↑U/mL,余(-);抗核抗体测定:(-);抗核抗体十一项:抗Ro-52抗体 弱阳性(+);ENA系列(广医二附院):RO-52(+);肌炎谱16项检测:抗NXP2抗体IgG(++),抗SAE1抗体IgG(+),甲功五项、 抗心磷脂抗体三项、 血管炎三项均未见异常,总IgE 129 ↑KU/L;专项IgE(-)。
肌酶:
谷草转氨酶 27.3U/L,肌酸激酶 41.0 U/L,肌酸激酶MB同工酶 8.0 U/L,乳酸脱氢酶 165.0 U/L,肌钙蛋白I 0.02 ug/L,肌红蛋白 9.3 ug/L
肿瘤指标:
NSE: 26.82 ↑ ng/mL;CEA :1.99 ng/mL;AFP :1.79 ng/mL;CA125: 48.75↑ U/mL;CA153: 17.11 U/mL;CA199: 121.90↑ U/mL;非小C肺癌相关抗原: 3.34 ↑ ng/mL。
凝血功能及ProBNP:
凝血五项(08-28):PT 14.2 秒,INR 1.08,纤维蛋白原 4.58↑g/L,APTT 42.3秒,D二聚体(ELISA法) 1734 ↑ng/ml。
凝血五项(09-05):PT14.5 秒,INR 1.11,纤维蛋白原 6.06 ↑g/L,APTT 46.8 ↑秒,D二聚体(ELISA法) 640 ↑ ng/ml。
B型脑钠肽前体(09-06):604.4pg/ml。
影像学:
超声检查:
心脏彩超(08-31) :右房、右室大,三尖瓣返流束面积 10.7cm2,VP 539cm/s,PG 116mmHg,估测PASP 126mmHg。三尖瓣返流(重度),肺动脉高压(重度)。左室收缩功能未见异常。
心脏彩超(09-02):右房、右室大,右室面积变化率减低,估测肺动脉收缩压(PASP) 120mmHg。肺动脉瓣口收缩期血流频谱见类似“指权征”。三尖瓣返流(重度),肺动脉高压(重度)。结合以上等考虑肺动脉栓塞可能。左室收缩功能未见异常。
超声右心声学CO2造影:考虑肺动-静脉短路(动静脉瘘)或卵圆孔未闭可能。
腹部+泌尿系彩超:慢性胆管炎并肝内胆管多发结石声像。门静脉左支闭塞声像。胆囊已切除。脾脏不大,血流未见异常。胰腺不大。双肾大小正常,未见结石及积液。双输尿管上段未见扩张。膀胱未见结石.前列腺钙化斑声像。
双下肢静脉彩超:未见异常
肺功能及心电图:
肺通气+弥散功能报告:中度混合性通气功能障碍。弥散功能重度下降。

心电图:窦性心律,大致正常心电图。
V/Q检查(2019-09-05):
1.双肺多发血流灌注功能受损,以双肺胸膜下为著,与通气显像呈不匹配性改变,考虑血管性病变(外周型PE)可能。
2.分肺灌注功能的测定:左肺占位全肺的41.85%;右肺占全肺的58.15%。

组织病理学:
2019-09-05 经气管镜肺活检病理报告:(左上叶舌段)送检肺组织肺泡腔内见组织细胞渗出,局灶间质增宽,个别淋巴细胞浸润,组织改变为肺炎症性病变,未见肉芽肿及肿瘤。
特殊染色结果:GMS(-),PAS(-),抗酸(-),革兰氏(-),抗酸荧光(-),真菌荧光(-)。
2019-09-06 经超声引导下左上肺穿刺病理报告: (左上肺)病理示组织改变考虑为肺梗死,未见特殊病原菌。
右心导管检查:2019-9-10行右心导管术:肺动脉平均压:43mmHg,为毛细血管前性肺动脉高压。主肺动脉压力:82/3/43mmHg右心室压力:80/-4/28mmHg 右房压:9/1/5mmHg 肺小动脉楔压:7mmHg肺血管阻力12.2WU心指数1.91L/min/m2血氧饱和度:指脉氧90% ;上腔静脉69%;下腔静脉67%;主肺动脉58%。

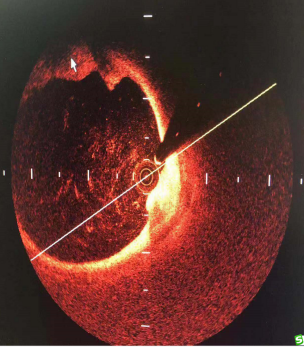
2019-9-10行OCT光学相干断层显像:肺动脉OCT成像清晰,未见成像血管壁增厚或明显炎症性改变。成像血管最小管径4mm,同时OCT发现双下肺动脉管腔内红白血栓。
耳鼻喉科会诊:结合电子鼻咽喉镜检查,诊断为“慢性咽喉炎”。余未见明显异常。
眼科会诊: 1、未累及眼底小血管病变,眼科定期随诊;2、双眼白内障若进展影响视力,可考虑手术治疗。
1.双肺病变查因:结缔组织病相关性肺病?血管炎?
2.肺动脉血栓栓塞症(外周型)
3.肺动脉高压(中度、中风险):血管炎相关?
危险分层(中风险):心功能Ⅱ级,proBNP:604 pg/mL,右房压:5mmHg,心指数1.91L/min/m2,SvO2 > 65%。
1.抗感染:哌拉西林舒巴坦钠针 3.0 q8h
2.抗凝:依诺肝素针 3000U 皮下注射 q12h(09-05至09-09)
3.依诺肝素针 4000U 皮下注射 q12h(09-10至出院前)
4.抗炎:甲强龙针 40mg qd
5.免疫球蛋白 5g qd

患者入院后即无发热,一般情况良好,目前偶有咳嗽,使用激素治疗后较入院时明显减轻。咳少许白痰,无咯血,胸痛缓解,但仍诉活动后气促。
PE:SpO2:91%(吸空气下),左下肺少许湿啰音,双下肢无浮肿。
出院带药:
泼尼松片 40mg qd 口服,
利伐沙班 15mg bid 口服,
安立生坦片 5mg qd 口服,
乙酰半胱氨酸 0.6 tid 口服。
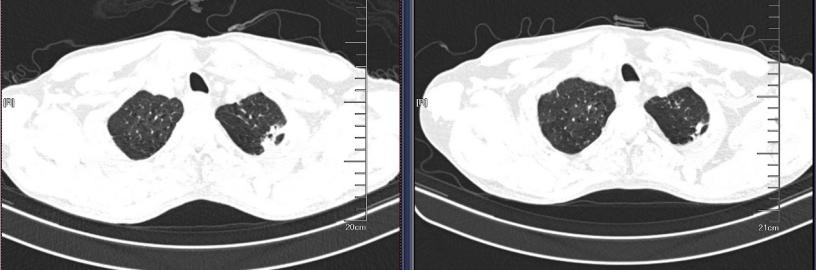
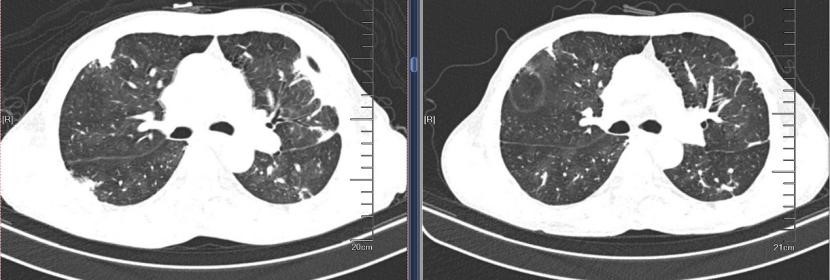
2019-09-04 2019-10-31
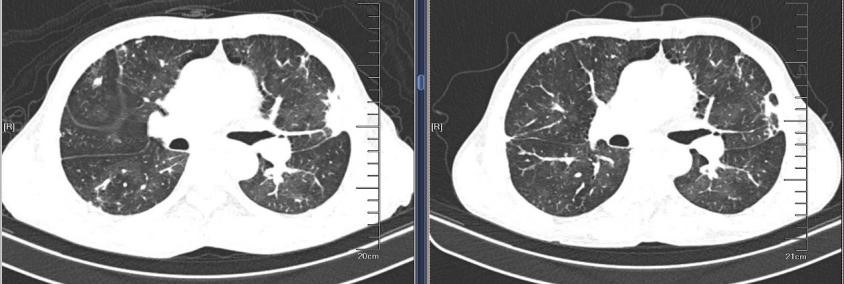

2019-09-04 2019-10-31
超声检查:
心脏彩超(9-29) :三尖瓣返流束面积 6.1cm2,VP 358cm/s,PG 52 mmHg,估测PASP 57mmHg。三尖瓣返流(中度),肺动脉高压(中度)二尖瓣返流(轻度)。左室收缩功能未见异常。
心脏彩超(10-31):三尖瓣返流束面积 6.6cm2,VP 111cm/s,PG 68 mmHg,估测PASP 73mmHg。三尖瓣返流(中度),肺动脉高压(中度)二尖瓣返流(轻度)。左室收缩功能未见异常。
心脏彩超(12-05):右室增大,横径44mm,右房未见增大,估测肺动脉收缩压(PASP) 72mmHg。肺动脉瓣口血流频谱呈“指拳征”。 左室收缩功能未见异常。结合临床考虑肺心病。三尖瓣返流(中度),肺动脉高压(中度)。
门诊随访:
第二阶段:
住院时间:2019-12-5~2019-12-23
查体:
T 36.8℃,P 92次/分,R 20次/分,BP 103/72 mmHg,SpO2:91%(呼吸空气下)。
头颅五官无畸形,颈无抵抗。皮肤黏膜无黄染,浅表淋巴结未扪及肿大。心界不大,心率92次/分,律齐,未闻及杂音。肝脾肋下未及,肝区无叩击痛。脊柱四肢无畸形,各椎体无压痛。生理反射存在,病理反射未引出。双侧瞳孔等圆等大,对光反射存在。双肺呼吸音清晰,双肺呼吸音粗,左肺可闻及少许细湿性啰音,未闻干啰音、胸膜摩擦音或Velcro啰音。
腹壁平坦,无压痛,无反跳痛,无包块,无移动性浊音,肠鸣音正常。双肾区无叩击痛,无输尿管行程压痛。四肢关节活动可,无红肿,无杵状指(趾),四肢无明显水肿。
1.双肺病变查因:结缔组织病相关性肺病?血管炎?
2.右上肺空洞查因:特殊病原体感染?
3.肺动脉血栓栓塞症(外周型)
4.肺动脉高压(中度 中风险):血管炎相关?
血常规:WBC 8.61x109/L (N 65.0%),Hb、Plt(-)。ALT 86.2 u/L,AST 39.6 u/L, ALB 36.5,GGT 409.4 u/L ,TBILL 6.4 u/L。PT 13.3s , INR 1.00 , PTA 100% , FIB 4.39g , APTT 35.8s , D-D 1052ng/ml。抗Ro-52抗体 弱阳性(+) ,ANA、ANCA 、抗心磷脂抗体、抗核抗体十一项均(-)。血真菌抗原、 1-3-β-D-葡聚糖定量均阴性。
2019-12-11再次气管镜检查:BALF( TB涂片、X-pert、细菌培养)、组织细菌培养均阴性。
2019-8 肺泡灌洗液结核菌培养:(-)。
肿瘤指标:
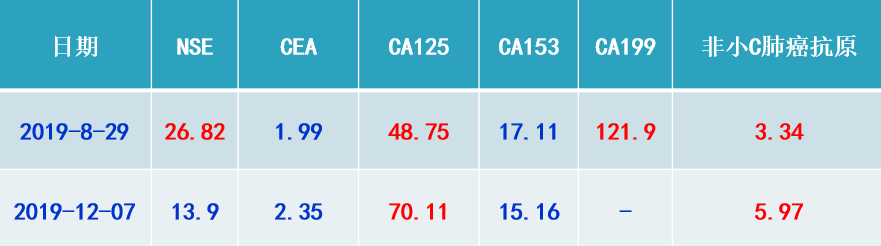
V/Q检查(2019-12-16):
1. 双肺多发血流灌注功能受损,以双肺上叶及下叶为著,与2019-9-5相比:双下肺灌注受损较前加重,余肺灌注受损同前。
2. 分肺灌注功能的测定:左肺占位全肺的42.1%;右肺占全肺的57.9%。
组织病理学:
2019-12-13经支气管镜右下肺活检:(右下叶)送检肺组织,支气管黏膜下可见少许呈腺腔样排列的异形细胞,邻近肺组织,肺泡上皮异形增生,形成乳头状结构,免疫组化结果:CK(+),NapsinA(-),TTF1(-),P40(-),ALK-P(D5F3)(-),ALK-P(Neg)(-),CK20(-),COX2(个别+),组织改变符合肺腺癌。
1.肺腺癌(T4N1Mx)
2.恶性肿瘤模拟血管炎
3.肺动脉血栓栓塞症(外周型)
4.肺动脉高压(4型 中度 中风险)
抗肿瘤治疗:
1.培美曲塞二钠 0.8 静脉滴注 D1
2.贝伐珠单抗注射液 300mg D1
本例患者初始症状为咳嗽,咳痰气促经检查后发现肺动脉栓塞、肺动脉高压及免疫风湿指标异常。初以激素治疗后肺部病灶有明显的好转,但随后再次出现加重;整个治疗过程中,肺动脉高压没有改善,因此,需要进一步的完善检查,不能放过一丝一毫的疑虑。最终,经再次活检确诊肺腺癌,从而考虑为肺癌合并恶性肿瘤模拟血管炎,即风湿性副肿瘤综合征。因此,在临床上对病人的随诊追踪异常重要,当发现有治疗效果不及预期的时候,应该高度警惕,需要进一步去排查其他诊断的可能。
患者为老年男性,吸烟30年,咳嗽、咳痰、痰中带血。入院多项微生物学检查阴性。而免疫风湿检查及肿瘤指标部分阳性。胸部CT提示:双肺多发实变影、多发磨玻璃影及马赛克征。肺功能检查发现患者弥散功能重度下降,不能排除肺栓塞的可能。行V/Q检查发现患者为外周型肺栓塞。左上肺病理示组织改变考虑为肺梗死。OCT显像为双下肺动脉管腔内红白血栓。
结合以上等考虑免疫风湿异常、肺动脉高压、外周型肺栓塞可能。后经住院祛痰抗氧化(N-乙酰半胱氨酸口服)、抗感染、抗凝、抗血管炎等治疗。值得一提的是,N-乙酰半胱氨酸这一临床常用祛痰抗氧化药物。其既可以通过游离巯基(-SH)断裂黏液中黏蛋白的二硫键连接,使其变为更小的单位,使得黏性明显下降,发挥直接黏液溶解作用,也可通过解聚与黏蛋白交联的DNA,促进黏液清除;此外,其还具有抗氧化抗炎、协同抗菌作用。N-乙酰半胱氨酸在慢阻肺、慢性支气管炎、特发性肺纤维化等疾病的治疗中有广泛应用,并得到国内外多部指南的推荐。
经过治疗,患者症状改善。于是出院,继续口服药物进行治疗。
出院后随访,胸部CT显示双肺实变影经治疗后明显吸收好转,但复查心脏彩超,肺动脉高压未改善。后复查胸部CT,右上肺出现空洞型病灶,下肺实变影增加。为什么病情曾经好转,又再次加重了呢?
患者第二次入院,双肺阳性体征少。再次细菌学相关检查正常,肿瘤指标中CA125、非小C肺癌相关抗原值较上次住院时升高。V/A检查显示双下肺灌注受损较前加重,说明之前针对肺栓塞的治疗没有效果。
经支气管镜右下肺活检组织改变符合肺腺癌。最终得出诊断:肺腺癌(T4N1Mx),恶性肿瘤模拟血管炎,肺动脉血栓栓塞症(外周型),肺动脉高压(4型 中度 中风险)。遂进行抗肿瘤治疗。
从该病例看出,难点在于疾病的诊断,种种临床表现最内在的病因是什么。患者经过多次入院治疗,沿着肺动脉栓塞及高压(是否血管炎相关?)这条线索,最后综合肺功能、V/Q检查、心脏彩超、肿瘤指标检查、肺活检等检查,做到了踏“血”寻迷,抽丝剥茧,明确了诊断。
该病例病史记录详尽,实验室检查、鉴别诊断详尽,诊治思路清晰,鉴别诊断贯穿了整个诊治过程。
几个关键点:发烧在入院后很快解决,咯血是一个非常重要的提示,咯血最常见原因大家很清楚,但少见的原因是什么,这就需要结合临床资料去进行分析。I型呼吸衰竭的原因是什么?没有通气功能障碍的时候,我们要看换气功能障碍以及通气血流比,后面的检查,V/Q检查发现了肺栓塞的问题,OCT发现肺血管的问题,心脏彩超发现了肺动脉高压的问题,反过来就解释了前面的推测,I型呼吸衰竭是由于血管炎或者肺血栓造成的。激素、抗凝、肺动脉高压的治疗效果不好的情况下,肺动脉高压没有降下来,第二次的气管镜检查非常重要,发现是恶性肿瘤。恶性肿瘤模拟血管炎的诊断为后续治疗奠定了基础。这里也提示,临床上有些检查是要重复进行的,重复检查是有意义的。
接下来,我们一起来看一下什么是恶性肿瘤模拟血管炎。
模拟血管炎(Vasculitis Mimic)是指非血管炎症性疾病导致血管狭窄、扩张、动脉瘤、甚至撕裂,其临床表现、实验室检查、影像学和/或病理上类似血管炎,病因包括:(1)感染:细菌、病毒、寄生虫、螺旋体、支原体、衣原体等。(2)肿瘤:实体肿瘤、淋巴瘤、血管内淋巴瘤等。(3)药物:抗生素、抗甲状腺药物、精神药物、别嘌醇、众多抗风湿药。 (4)可卡因:尤其加用左旋咪唑。(5)其他系统疾病、血栓性病变、动脉硬化。(6)遗传性疾病。
由恶性肿瘤继发的血管炎样表现称为恶性肿瘤模拟血管炎(malignancy mimic vasculitis,MMV),属风湿性副肿瘤综合征(Rheumatic paraneoplastic syndromes)表现。 可早于、 同时或在恶性肿瘤之后出现,二者的时间间隔文献报道不一,绝大多数报道和学者认为两者的发病间隔应在12个月以内。
根据可能的发病机制,分为血管病样表现和血管炎样表现。血管病样表现:是恶性肿瘤可能通过游走性血栓性静脉炎、弥散性血管内凝血(DIC)、直接侵入血管及高凝促血栓等机制间接表现为血管事件,任何肿瘤都可以出现高凝状态,肿瘤相关血栓栓塞的发生率达11%。 血管炎样表现:主要为肿瘤细胞作为“移植物”产生免疫反应,循环免疫复合物吞噬清除障碍激发宿主发生超敏性血管炎以及肿瘤细胞分泌不同的细胞因子造成血管损伤。
常见的模拟血管炎类型:白塞病( Behcet’s disease ), 肉芽肿性多血管炎(CPA), 结节性多动脉炎(PAN) ,嗜酸性肉芽肿性多血管炎( EGPA ) ,多发性大动脉炎巨细胞动脉炎(GCA) ,类风湿血管炎。临床表现:多系统受累较多见;肺部受累可表现为肺部结节、间质性病变和肺动脉高压等。 其他临床表现:体重明显下降、发热、血液系统异常、皮肤损害黏膜损害、血栓形成、神经系统损害(脑梗死、周围神经炎、头痛)、肾损害(膜性肾病、肾小球肾炎、血尿、肾动脉血栓形成等)、视力下降等。
临床上MMV在血液系统MMV中更常见。 MMV需引起临床医生的重视。国外有文献报道,恶性肿瘤可以以某种血管炎为首发临床表现, 2.5%~5.0%的血管炎患者实为恶性肿瘤所致。恶性肿瘤出现血管炎样表现占0.17‰。对常规针对性治疗反应欠佳,特别是对于高龄伴有消耗症状者,应高度警惕MMV可能。有血管炎样表现的患者不应放松对肿瘤的警惕性并适时活检。
医学博士,呼吸内科教授、主任医师,博士研究生导师;广州医科大学附属第一医院/广州呼吸健康研究院 肺血管病亚专科临床部负责人/呼三支部书记;广东省医学会呼吸病学分会血管组副组长;广东省药学会肺血管病学专业委员会副主任委员;广东省健康学会静脉疾病专业委员会副主任委员;中国医疗保健国际交流促进会外科分会血栓与抗凝学组常委;中国医师协会呼吸分会肺血管组委员;广东省肺栓塞与深静脉血栓防治联盟秘书长;北京医学奖励基金会心肺循环专业委员会 常委;国家心血管病专家委员会右心与肺血管病专业委员会委员;广东省杰出青年医学人才(2018);广州市高层次人才——优秀专家(2019);广州市高层次卫生人才——医学重点人才(2019)。
广州医科大学附属第一医院呼吸内科主治医师。广东省医师协会睡眠医学专业医师分会委员 秘书。广东省老年保健协会呼吸科专业分会委员。师从陈荣昌教授。毕业后至今在钟南山院士指导下在广州医科大学附属第一医院、广州呼吸健康研究院工作。参与多项国家级及省级科研项目,发表多篇学术论文。对呼吸系统常见病诊治有较深认识,尤其是睡眠呼吸暂停、慢性阻塞性肺疾病、肺血管病方面的诊治。
中国医学论坛报







