查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





胰腺癌因症状隐匿、解剖位置复杂、生存率极低而被称为「癌中之王」。近年来,以 PD-1/PD-L1 抑制剂为代表的免疫疗法已在多种实体肿瘤治疗中展现出强大疗效。然而,对于「癌王」而言,免疫治疗疗效并不明显,已经开展的绝大多数临床试验收效甚微。
2025 年 6 月 4 日 (当地时间),复旦大学附属肿瘤医院虞先濬、施思团队于Gut期刊发表题为「Histone lactylation- driven feedback loop modulates cholesterol- linked immunosuppression in pancreatic cancer」的论文。该研究成果表明,细胞「代谢废物」乳酸可以调控胰腺癌基因表达与蛋白质功能,在胰腺癌的肿瘤微环境中发挥重要作用,进而首次系统阐明组蛋白乳酸化修饰 (H3K18la) 通过驱动乙酰转移酶 2(ACAT2) 表达,构建了「乳酸代谢-表观遗传-胆固醇免疫抑制轴」的全新机制,为破解胰腺癌的免疫治疗「密码」提供了全新策略。
研究进一步证实,通过靶向抑制该信号通路,不仅可重塑抗肿瘤免疫应答,更能与免疫治疗药物 PD-1 抑制剂产生协同效应,为胰腺癌提供新的免疫治疗机会。

肿瘤医院院长虞先濬教授表示,胰腺癌高度免疫抑制性的肿瘤微环境是阻碍免疫治疗成功的「顽固堡垒」。如何有效重塑胰腺癌的免疫抑制微环境并探索增强免疫治疗响应的策略,成为提升患者生存期的重大临床挑战。
据介绍,肿瘤细胞 (尤其是胰腺癌等) 常常依赖糖酵解产生大量乳酸,形成「酸性微环境」。研究证实,既往被认为是细胞「代谢废物」的乳酸,可以作为「信号分子」,通过组蛋白乳酸化修饰,直接调控基因表达。颠覆了乳酸作为「代谢废物」的传统认知,使其成为调控基因表达与蛋白质功能的关键调控分子。
然而,组蛋白乳酸化在胰腺癌中调控肿瘤进展与免疫逃逸的具体分子机制究竟如何,能否通过对该机制的干预来破解「癌王」免疫治疗的密码?迄今仍未有研究成果阐明。
发现改善胰腺癌抗 PD-1 治疗反应新路径
为明确组蛋白乳酸化在胰腺癌免疫治疗失败中的作用机制,研究团队开展了深入研究。
通过乳酸化修饰组学分析,发现组蛋白 H3 第 18 位赖氨酸乳酸化修饰是最显著上调,且与不良预后相关的组蛋白乳酸化修饰。同时,乳酸驱动的组蛋白 H3K18la 激活乙酰转移酶 ACAT2 的转录,诱导胰腺癌细胞内乳酸水平进一步上调。此外,研究还发现,胰腺癌细胞内 ACAT2 的过度表达诱导肿瘤相关巨噬细胞 (TAMs) 向免疫抑制性的 M2 型极化,M2 型 TAMs 进而抑制 CD8⁺ T 细胞功能,最终形成「免疫荒漠」微环境,导致免疫治疗效果不佳。以上结果表明,靶向降解 ACAT2 或能实现瓦解免疫抑制的精准爆破。
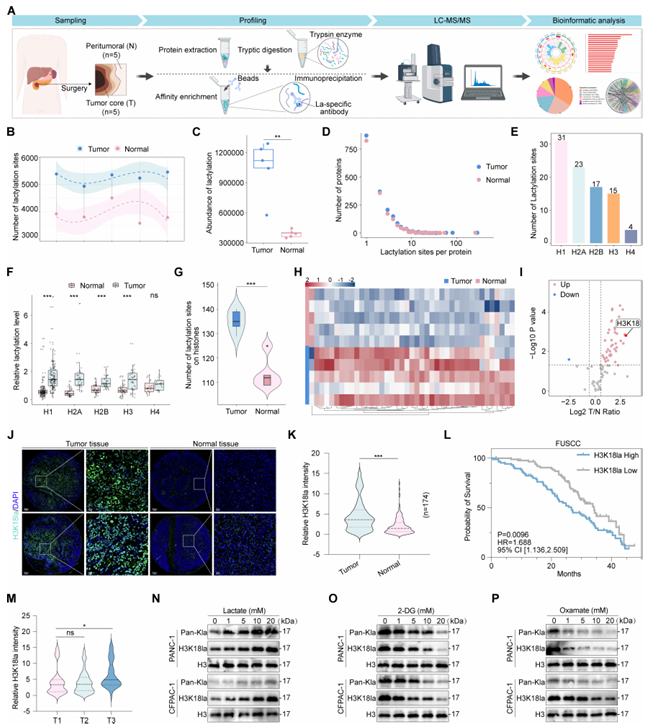
从机制层面来看,乳酸驱动的 H3K18la 如同分子开关激活 ACAT2 转录,ACAT2 进而乙酰化线粒体载体同源蛋白 2(MTCH2) 的 K100 位点,稳定其蛋白表达。MTCH2 的累积破坏线粒体氧化磷酸化,导致乳酸产生进一步增加,从而形成「乳酸 →H3K18la→ACAT2→MTCH2→ 乳酸」的正反馈环路,驱动胰腺癌进展。
更重要的是,ACAT2 同时促进胆固醇生物合成,并通过小细胞外囊泡 (sEVs) 将胆固醇递送至 TAMs,诱导 TAMs 向免疫抑制性的 M2 型极化,构建排斥 CD8⁺ T 细胞的免疫屏障。基于 ACAT2 的关键作用,研究团队创新性地设计并合成了靶向降解 ACAT2 的蛋白降解靶向嵌合体 (PROTAC)AP1,AP1 与抗 PD-1 抗体联用,产生了远超单药的强大协同抗肿瘤效果,显著抑制肿瘤生长并延长小鼠生存期。
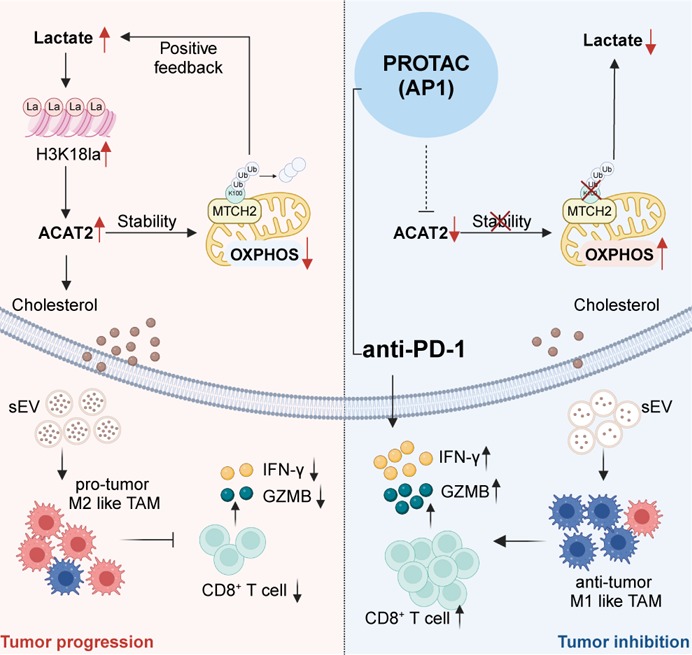
虞先濬教授表示,该研究首次构建了「乳酸代谢-表观遗传-胆固醇免疫抑制轴」的全新机制,为破解胰腺癌的免疫治疗「密码」提供了全新策略,有望让胰腺癌从「免疫荒漠」变为「免疫敏感」,为患者带来新希望。
攻坚「癌王」,形成胰腺癌诊治「上海方案」
据了解,作为国家临床重点专科,肿瘤医院胰腺外科以「三个并举」为宗旨,即「临床科研并举,内科外科并举,微创开腹并举」,积极推动学科发展,打造成为国内领先、国际一流的胰腺肿瘤医教研中心。
在学科带头人、肿瘤医院院长虞先濬教授的带领下,团队开展了一系列基础临床转化研究,引领国际国内潮流,形成了胰腺癌诊治的「上海方案」,显著提高了胰腺癌手术的安全性、根治性和有效性。数据显示,在该院接受手术治疗的胰腺恶性肿瘤患者术后 3 年生存率达到 56%,位居上海第一,赶超了国际先进水平。
团队多项原创性成果纳入国际国内指南共识,并牵头执笔编写《胰腺癌综合诊治指南》(2018 版和 2020 版),在全国推广应用。近年来获得上海市科技进步奖一等奖、中国抗癌协会科技奖一等奖、上海医学科技奖一等奖等荣誉。
![]()
本文及图片来源于复旦大学上海医学院、复旦大学校友会光华生命健康分会
查看更多