查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





北京时间2019年9月12日,《新英格兰医学杂志》(NEJM)“Brief Report”栏目在线发表了来自中国的《CRISPR编辑干细胞治疗一例HIV感染合并急性淋巴细胞白血病患者》论著(Xu L, Wang J, Liu Y, et al. CRISPR-edited stem cells in a patient with HIV and acute lymphocytic leukemia. N Engl J Med 2019. DOI: 10.1056/NEJMoa1817426)。
该文由北京大学生命科学学院邓宏魁教授、解放军总医院第五医学中心陈虎教授、首都医科大学附属佑安医院吴昊教授分别领导的团队合作发表。这是2019年由中国团队作为第一和通讯作者发表在NEJM的第7篇论著(Original Article),创造了记录。
这是全球首次报道CRISPR-Cas9基因编辑技术编辑人体造血干细胞中的CCR5基因,并“成功移植到罹患HIV和急性淋巴细胞白血病”的病例。该文的发表,不仅是三个中国团队的成功,更为世界特别是中国基因编辑临床研究领域在去年因基因编辑婴儿事件遭受短暂挫折后打了一针强心剂。
NEJM医学前沿特别采访了论文的主要作者之一北京大学邓宏魁教授,以及从事医学伦理学研究的上海仁济医院伦理委员会办公室主任、上海嘉会国际医院伦理委员会副主任陆麒和从事基因编辑研究的中国科学院动物研究所王皓毅教授。
NEJM医学前沿还全文翻译了以CAR T为代表的基因治疗领域翘楚、宾夕法尼亚大学Carl June教授为这篇论文在NEJM撰写的评论。Carl June指出,该研究表明CRISPR应用于人体的安全性可接受;更值得关注的是,经基因工程改造的干细胞在该患者中似乎并无免疫原性;最重要的一点是,试验中未检测出基因组编辑的脱靶效应。
◆◆◆
CRISPR-Cas9首次出现在科学文献中,不过是7年前的事情。甫一问世,它就因功能强大、使用相对简便而迅速成为了分子生物学的利器,也因此激发了医疗界、工业界和风险投资人的无限想象,数个应用CRISPR技术的独角兽公司也应运而生。
去年,还曾出现过以人类生殖为目的的基因编辑事件,引发了包括中国科学家在内的业界广泛谴责(见《人类胚胎基因编辑这个潘多拉的盒子打开后,还能被关上吗》)。尽管CRISPR-Cas9成为全球生物医学界的弄潮儿,但应用该技术的临床试验结果在此前并无权威学术报道。
将天然存在CCR5突变的造血干细胞和祖细胞(HSPC)进行异基因移植后, 可以实现HIV-1的长期清除,因为CCR5是HIV进入细胞的关键辅助受体。那么,用人工破坏CCR5的细胞进行移植,能否使细胞对HIV-1感染在人体内产生抗性?
今天发表的论文给出了肯定的答案。在接受采访时,邓宏魁表示,如何在造血干细胞中进行高效基因编辑一直是该领域实现临床应用的关键瓶颈。在之前的一项研究中,他与合作者建立了能够以27%的效率在人类HSPC内破坏CCR5,且不含有病毒的CRISPR基因组编辑系统。据邓宏魁等发表在Molecular Therapy的结果,在动物模型中,这些CCR5修饰的HSPC稳健地生成了对HIV-1感染具有抗性的人类免疫系统。
邓教授介绍,在NEJM今天发表的研究中,他们对这项技术进行了优化,主要表现为:
1)建立了能进行基因编辑造血干细胞的预处理培养方法;
2)通过非病毒转染的方式将Cas9-gRNA核糖核蛋白复合体递送进细胞,规避了外源DNA的引入;
3)缩短了Cas9在细胞内的持续时间,从而极大的降低了脱靶效应;
4)引入了配对的gRNA策略,并对使用的gRNA进行了截短及修饰,在提高基因编辑效率的同时也降低脱靶效率。
采用了这一改良的技术,研究者将来自健康供者的造血干细胞和祖细胞(HSPC)中的CCR5基因敲除后,再将HSPC移植到一例HIV-1感染合并急性淋巴细胞白血病患者体内。患者的急性淋巴细胞白血病处于完全缓解期,达到完全供者细胞嵌合,并且CCR5敲除的供者细胞持续存在19个月以上,且并未发生与基因编辑相关的不良事件。CCR5敲除的CD4+细胞百分比在抗逆转录病毒治疗中断期间略有增加。
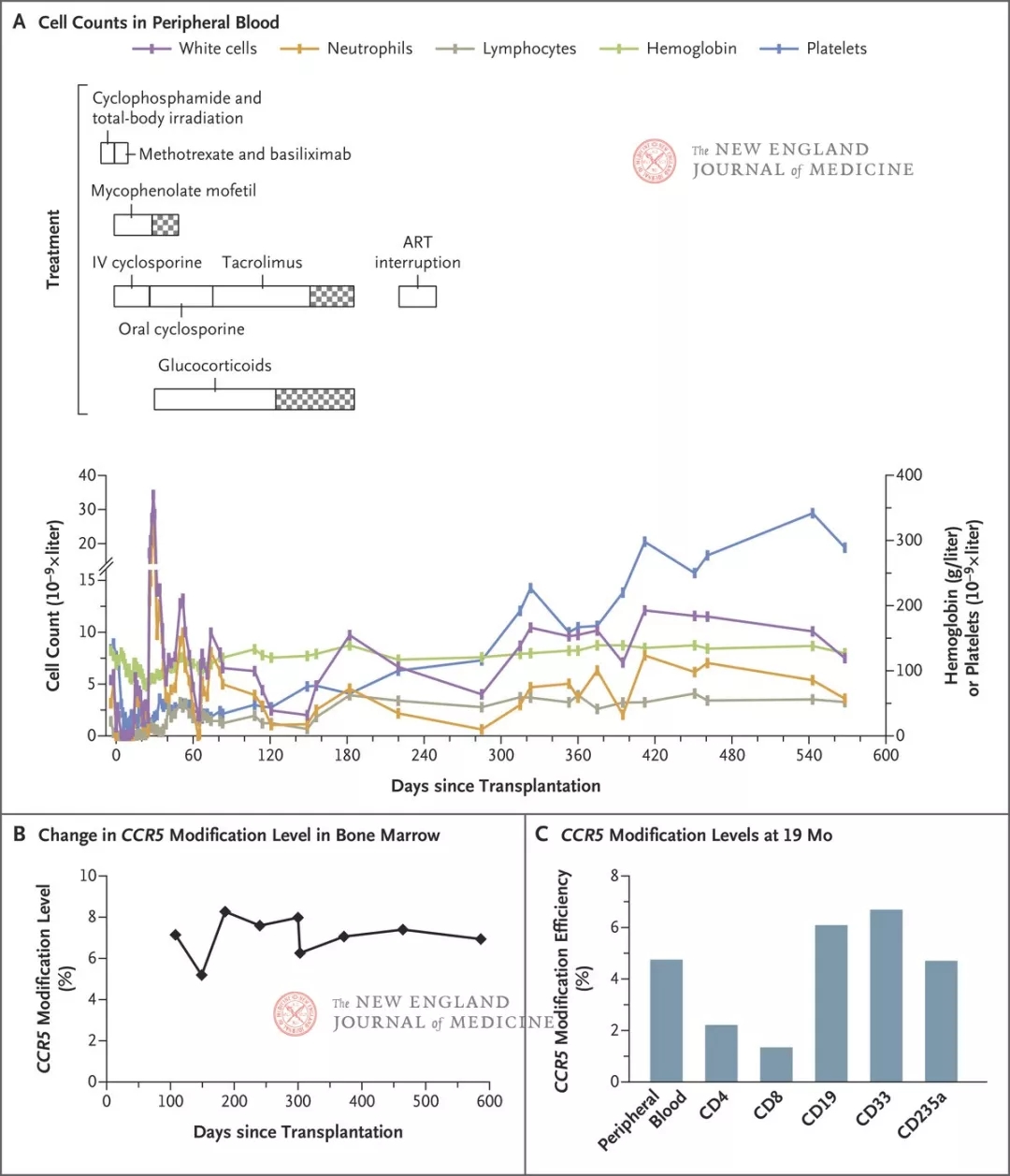
图1. CCR5修饰细胞的植入(来源:DOI: 10.1056/NEJMoa1817426)。图A左侧y轴显示了随时间推移的外周血白细胞、中性粒细胞和淋巴细胞计数,右侧y轴显示了血红蛋白水平和血小板计数的波动。主要预处理方案包括环磷酰胺(第-4和-3日)和全身放疗(第-2和-1日)。免疫抑制治疗包括甲氨蝶呤(第1、3和6日)、巴利昔单抗(第0、4和8日)、霉酚酸酯(从第0日开始,在第31至47日期间逐渐减量)和环孢素(第-1至30日期间静脉[IV]给药,第31至74日期间口服给药)。移植物抗宿主病采用糖皮质激素(甲泼尼龙或泼尼松,第32至124日期间静脉给药,第125至185日期间口服给药且逐渐减量)和他克莫司(第75至156日期间口服给药,第157至185日期间逐渐减量)。抗逆转录病毒治疗(ART)在第221至249日期间中断。棋盘格样式代表减量期。图B显示了在移植后不同时间点,通过深度测序在骨髓有核细胞内检测出的CCR5基因破坏效率。图C显示了在移植后19个月时,外周血样本中各类细胞内的CCR5基因破坏效率。
虽然本文与与去年基因编辑婴儿事件都采用了CRISPR技术编辑相同的CCR5靶点,但显著区别是,本文涉及的是成人造血干细胞。曾在PLoS Biology上撰文评论基因编辑婴儿事件的王皓毅教授说,NEJM发表的研究属于体细胞基因编辑,所导致的突变不会传递给下一代。
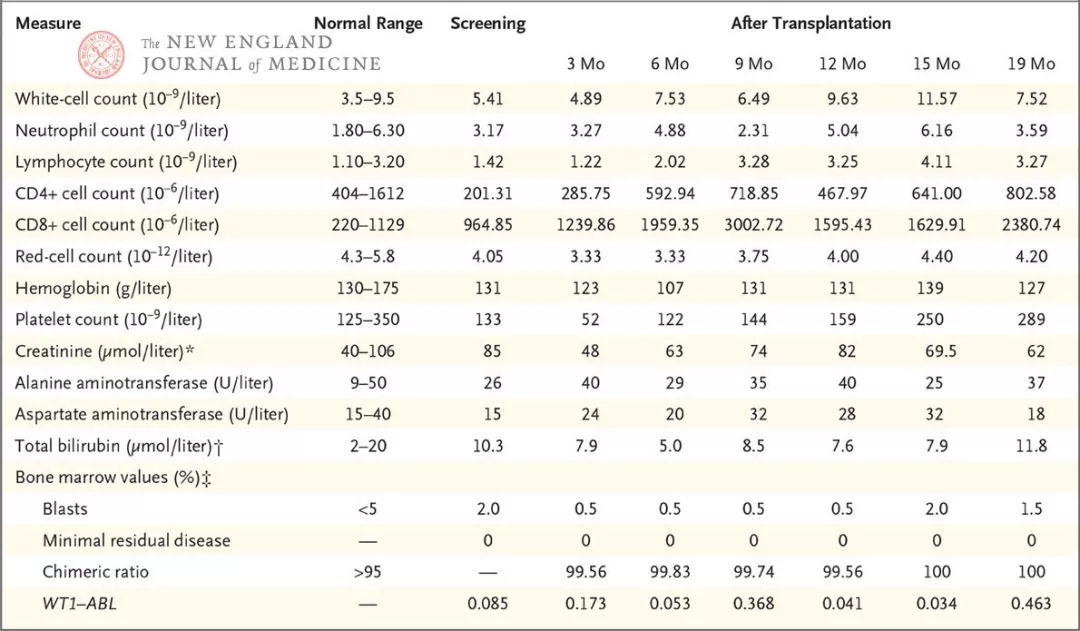
表1. 移植前后的关键实验室数值(来源:DOI: 10.1056/NEJMoa1817426)。* 将肌酐值转换为mg/dL需除以88.4。† 将胆红素值转换为mg/dL需除以17.1。‡ 本试验分别通过形态学、流式细胞术和短串联重复序列测序来确定母细胞、微小残留病变和嵌合率。WT1-ABL是标准化为Abelson基因的肾母细胞瘤基因表达水平。
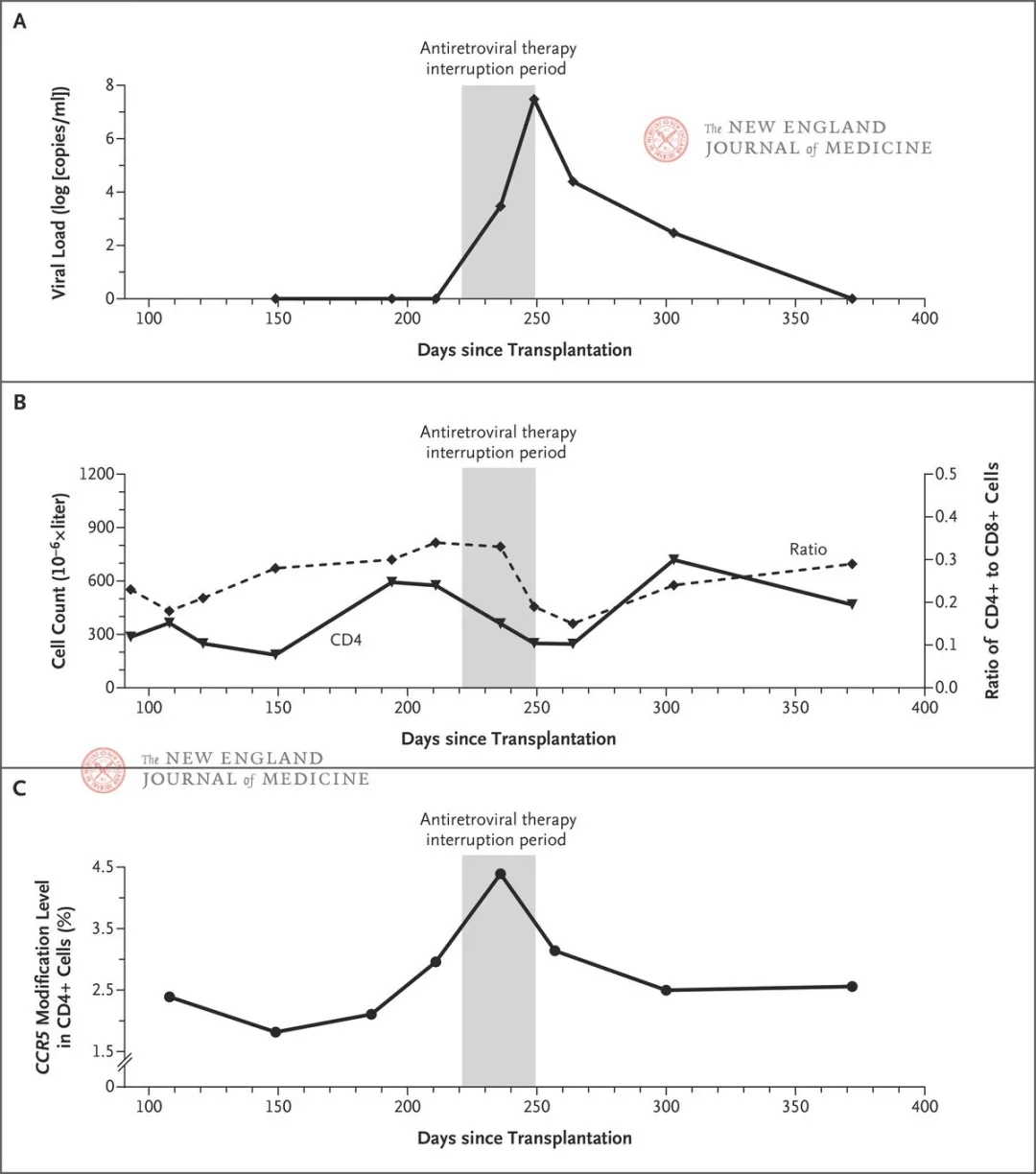
图2. 抗逆转录病毒治疗中断期间和之后的临床结局(来源:DOI: 10.1056/NEJMoa1817426)。图中显示了移植后第3个月至第12个月期间的下列评估结果:病毒载量(图A)、CD4+细胞计数和CD4+细胞/CD8+细胞比值(图B)以及CD4+细胞内的CCR5基因破坏效率(图C)。抗逆转录病毒治疗在第221至249日期间中断。
这项研究早在2017年5月就在世界公认的临床试验注册机构登记,项目参与单位就是NEJM三位通讯作者所在单位。陆麒认为,该文报道的创新性治疗方法,经过了患者的知情同意,符合伦理,而且这篇论文为未来的研究设计进行了“探索性的尝试”,也为该疾病的治疗提供了更多的信息。
总体上,国际同行对以治疗疾病为目的的体细胞基因编辑都持支持态度,但人类治疗的前提是有严谨的临床前试验以及严格遵循伦理学规范。王皓毅认为,无论使用CRISPR还是其他基因编辑工具治疗疾病,都应严格评估潜在风险和预期的临床获益,这一工作对于基因编辑体细胞治疗疾病进行了有益的探索。
邓宏魁教授也强调,为了确保患者的安全,他们在研究中移植了未经过基因编辑的供者细胞,使得基因编辑效率降低,但“初步探索了该方法的可行性和安全性”。他说今后需要进一步提高基因编辑效率及优化移植方案。此外,尽管在该病例中没有发现基因编辑相关副反应,邓宏魁认为“针对脱靶效应和其他安全性评价仍然需要更加长期深入的研究”。
本文的最后作者、通讯作者之一陈虎教授不幸于今年7月因病突然辞世。陈虎教授生前任全军造血干细胞移植中心主任、全军造血干细胞研究所所长等职,曾获得国家科技进步一等奖。我们希望这篇论文的成果能最终为艾滋病等患者带来临床获益,以慰藉英年早逝的陈虎教授。
Carl June教授评论
CRISPR技术的新用途——追寻踪迹难觅的HIV疗法
Emerging Use of CRISPR Technology — Chasing the Elusive HIV Cure
Carl H. June
DOI: 10.1056/NEJMe1910754
由于基因工程技术的进步,一种称为基因编辑或基因靶向的新型基因疗法成为了可能。基因编辑的目的是在单碱基对水平改变细胞内的DNA编码,因此可以将其视为精准治疗的终极形式。在过去二十年间,基因组编辑一直是基础科学研究领域的有力工具。2007年授予Smithies、Capecchi和Evans的诺贝尔生理学或医学奖认可了基因组编辑作为研究工具的重要性。
直至最近,基因编辑的效率仍不足以在临床应用中发挥治疗潜力。然而,可在所需位点切割DNA的人工核酸酶(核酸酶是切割RNA或DNA碱基对的酶)研发成功后,基因靶向效率的问题已得到解决。这些工具包括归巢核酸内切酶、锌指核酸酶、转录激活因子样效应核酸酶和成簇的规律间隔的短回文重复序列(CRISPR)-CRISPR相关蛋白9(Cas9)。临床前研究已测试过将这些平台作为治疗人类免疫缺陷病毒(HIV)感染的基因编辑工具(图3)。
抗逆转录病毒治疗在阻止HIV复制和传播方面非常有效。HIV感染者无法在不接受治疗的情况下达到持续缓解,其中的主要障碍是接受抗逆转录病毒治疗的患者体内有长期存在的HIV病毒库。目前研究者正在探索两种旨在达到持续缓解的方法:清除CD4+ T细胞内具有复制能力的HIV病毒库;在不采取治疗的情况下,不清除HIV而达到控制HIV复制的目的,该方法称为持续病毒学缓解。
清除HIV病毒库的主要策略目前包括基因编辑和异基因干细胞移植。该方法的最先进应用是通过对CCR5基因进行基因组编辑的方式获得HIV抗性。人类遗传学证实我们可以将CCR5作为靶点敲除,因为携带CCR5双等位基因突变,因而对HIV感染具有抗性(因为CCR5蛋白是大多数[但非全部]HIV感染形式的重要辅助受体)的健康人原本已经存在。两例患者从CCR5-Δ32等位基因纯合子的一名供者接受干细胞移植后,目前看来HIV病毒库已被清除。
Xu等在本期NEJM中报告了CRISPR-Cas9基因编辑在人类中的应用。研究者为感染HIV的一例急性淋巴细胞白血病患者选择了一名HLA匹配的干细胞移植供者。研究者应用CRISPR-Cas9技术对供者干细胞进行了基因组编辑,敲除CCR5,之后将干细胞输入感染HIV的受者体内。编辑后的干细胞植入受者体内,达到完全供者细胞嵌合,且目前仍持续。19个月时,白血病处于缓解期,患者仍有HIV感染并接受抗逆转录病毒治疗。
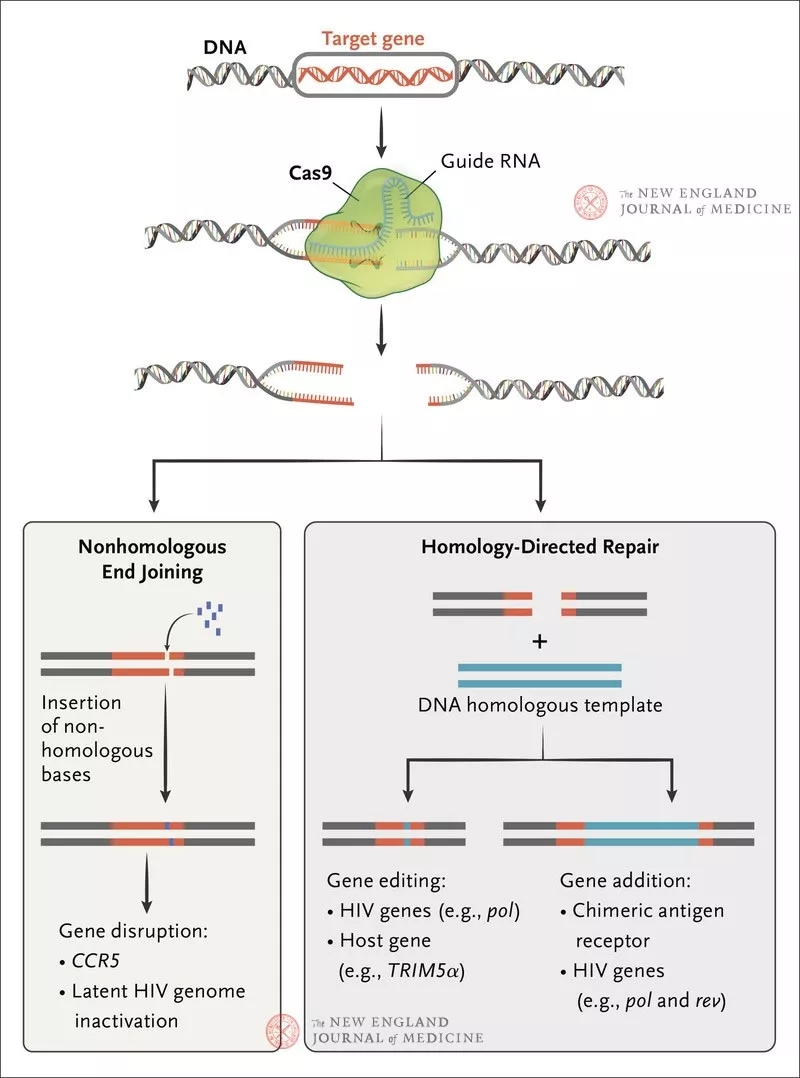
图3. 基因组编辑在清除人类免疫缺陷病毒(HIV)方面的实验性应用。
引导Cas9的RNA复合体在干细胞DNA内产生双链断裂。DNA修复过程最常采用易出错的非同源末端连接,因而导致基因破坏。在Xu等的研究中,CCR5被破坏。或者,如果提供外源性DNA,修复过程可采用同源介导的修复。同源介导的修复可实现精确的基因编辑(使HIV感染减轻)或基因添加(对HIV感染产生免疫力)。
从这些新的研究发现中,我们可以对干细胞编辑的安全性有哪些了解?首先,安全性似乎可接受,尽管数据仅限于一项正在进行的研究中的一份病例报告。其次,经基因工程改造的干细胞在该患者中似乎并无免疫原性。这一点值得关注,因为本研究的CRISPR-Cas9系统所使用的Cas9核酸酶是来自化脓性链球菌,并且鉴于人群普遍暴露于该细菌种类,因此大多数成人已经对Cas9有免疫力。第三,也是最重要的一点是试验中未检测出基因组编辑的脱靶效应。对患者样本进行的全基因组测序未检测出易位或大片段缺失,而它们是Cas9核酸酶诱导的DNA双链断裂修复过程中可能发生的致突变事件。
关于该患者基因组编辑的安全性,我们还有其他需要考虑的事项。修饰后的干细胞实现了稳定植入,但数量不大,占骨髓和血液内有核细胞的5%~-8%。因此,旨在揭示罕见致突变事件的测序分析深度会受到样本量的限制。其次,基因治疗后发生肿瘤的潜伏期在在输入基因修饰的干细胞后可长达31至68个月。因此,我们需要对更多接受更高频率CRISPR-Cas9编辑干细胞移植的患者进行更长期随访,从而确保这一方法的安全性。第三,即使确定基因组编辑具有可接受的安全性,我们仍然必须考虑靶向CCR5的安全性,因为CCR5-Δ32等位基因纯合子的人的寿命比杂合子或CCR5基因座无突变的人要短。
此项研究对干细胞编辑进行了原理论证,我们还将测试与该方法互补或具有更好可扩展性的其他HIV清除方法。使用基于CRISPR-Cas9的基因编辑技术从宿主基因组特异性剪切整合的HIV 1型前病毒DNA的体内方法可能为清除潜伏病毒库提供有力工具(图3)。
最后,这份报告非常惊人的一点是基础科学的进展迅速转化为了1期临床试验。在宾夕法尼亚大学,对于基因组编辑的CD4 T细胞,从验证概念的动物实验转向人体试验花了5年时间。在本研究中,从最初报告CRISPR-Cas9治疗HIV感染的动物研究到此份病例报告和正在进行中的临床试验(ClinicalTrials.gov注册号为NCT03164135)只花了2年时间。这可能表明中国的监管环境使其可以达到比美国更快的转化速度。
在更广泛的意义上,工程细胞疗法的研发周期可能比传统药物的研发周期短。数十年来,HIV-AIDS一直位于细胞和基因疗法的前沿,而且这一趋势在基因组编辑领域仍继续。无论如何,基因组编辑已经使精灵脱瓶而出。
◆背景介绍◆
发现:帮助HIV入侵的“叛徒”蛋白
艾滋病,一种让人谈之色变的病毒型传染病,由人类免疫缺陷病毒(HIV)对人类免疫系统重要的细胞进行感染而致病的。其中后果最为严重的是,它能够感染免疫系统中起关键作用的CD4+T淋巴细胞,从而削弱机体抗感染和癌症的防御功能,最终患者死于严重感染和癌症。
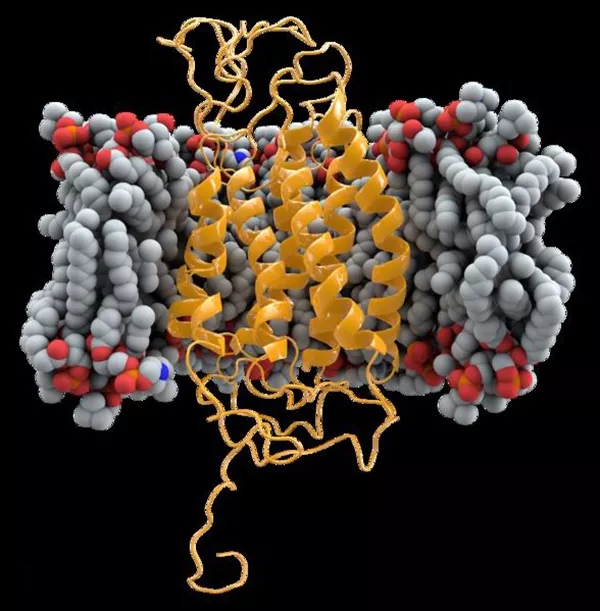 CCR5 图片来源:维基百科
CCR5 图片来源:维基百科
研究学者们发现,在HIV攻陷人体免疫系统的过程中,CD4+T淋巴细胞表面的两种标记蛋白充当了“叛徒”的角色:一个是CD4,另一个就是CCR5。要想阻止HIV病毒的肆虐进攻,治愈艾滋病患者,就必须将相关的“叛徒”蛋白去掉。
这也是关键之处。如果编码CD4或者CCR5蛋白的基因发生功能突变,则艾滋病毒无法感染CD4+T淋巴细胞,人体的免疫系统便有可能躲过HIV病毒的“屠杀”。
随后研究人员发现,目前有大约1%的白人天生对艾滋病免疫。在他们身上的研究发现,CCR5-Δ32基因编码的受体出现了功能突变,让多数HIV病毒“走投无路”。这也意味着说,CCR5-Δ32基因是HIV攻入人体细胞的重要“缺口”。如果该基因发生突变,HIV将难以依赖与生存,人便拥有了不会患艾滋病的超能力。
这便是启发邓宏魁团队开展研究的重要切入点。
启发:“柏林病人”和“伦敦病人”的治愈
自1981年美国发现首例艾滋病开始,近40年的艾滋攻坚战,人类一直处于劣势。直到2007年,事情发生了转机。
2007年,蒂莫西•雷•布朗,一位同时患有白血病和艾滋病的美国男子被称为“柏林病人”。原因在于,他在德国接受了携带CCR5基因突变捐献者的造血干细胞移植手术后,其血液中的HIV病毒竟然得到了有效清除,实现了艾滋病的功能性治愈。“柏林病人”也因此被视为人类治愈的第一例艾滋病病人。
 Ravindra Gupta博士 图片来源:伦敦大学
Ravindra Gupta博士 图片来源:伦敦大学
2019年3月,时隔十二年 ,伦敦大学学院的医学博士Ravindra Gupta和他的团队在在《Nature》杂志(在线版)上的报告中写道:“柏林病人的治愈不是一个偶然现象。” 患有急性白血病和艾滋病的“伦敦病人”在接受CCR5基因突变的干细胞移植后,被完全治愈了。
尽管这一干细胞移植治疗的效果十分显著,但成本也是十分高昂的,且找到CCR5-Δ32基因突变的供者极为困难,为进一步的治疗设下重重障碍。
但这一疗法的成功也为研究人员指明了另一个方向,如能找到有合适配型的供者骨髓,哪怕没有CCR5-Δ32基因突变,也可通过基因编辑,实现对艾滋病的治疗或治愈。但是如何在造血干细胞中进行高效基因编辑,也是实现临床应用的关键瓶颈。
全球首次: CRISPR/Cas9技术治疗“北京病人”
国际上艾滋病治疗的进程日新月异,也是时候放眼国内了。这时,一例与“柏林病人”、“伦敦病人”相似的案例出现在了北京。
2016年5月我国一名27岁的男性被相继诊断出患有艾滋病和急性淋巴细胞白血病。直至2017年,历经1年的艾滋病抗逆转录病毒治疗后的他,情况并没有得到缓解。
是不是可以尝试用同款干细胞移植的方法来对他进行治疗呢?

邓宏魁教授 图片来源:百度百科
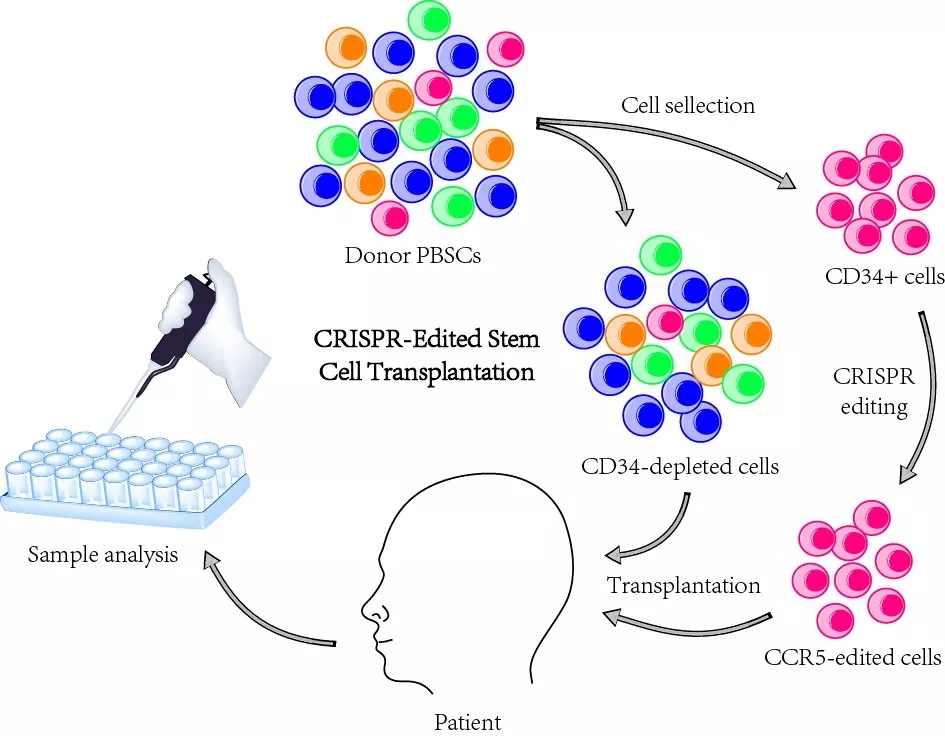
于是,北京大学生命科学学院邓宏魁教授、解放军总医院第五医学中心陈虎教授、首都医科大学附属佑安医院吴昊教授等团队合作,进行了世界首次基因编辑治疗艾滋病和白血病的临床研究。
研究人员利用CRISPR/Cas9技术将供体造血干/祖细胞(HSPCs)的CCR5基因进行了插入敲除,并将其移植到HIV感染伴有急性淋巴母细胞性白血病(Acute lymphoblastic leukemia)的患者体内,进行了19个月的随访观察。
研究结果显示,患者在骨髓移植后淋巴细胞和T细胞亚群的数量出现明显上升,CD4细胞数目在移植后6个月达到正常范围,并在之后的随访阶段一直维持正常水平。
急性淋巴母细胞性白血病仅仅在移植后4周就得到了完全缓解。且随访期间患者没有出现与CCR5编辑相关的副反应。
 HIV病毒 图片来源:pixabay
HIV病毒 图片来源:pixabay
但让人遗憾地是,该研究中HSPCs的CCR5体外敲除效率仍然偏低,仅为17.8%。
并且当科研人员尝试停止使用抗逆转录病毒药物,以检测骨髓移植能否抑制患者体内的病毒复制时,患者体内的HIV病毒量出现了剧烈上升,CD4细胞的数量和比例均降低,CCR5缺失的CD4细胞的比例出现小幅上升,这促使科研人员不得不重启药物治疗程序。
研究者指出,虽然该研究成功的将CCR5敲除的造血干/祖细胞移植到HIV感染者体内,但较低的敲除效率仍然阻碍机体对HIV病毒的有效清除。因此,如何提高CCR5的敲除效率以及效率提高后的安全性仍需要进一步研究。
结语
其实,CCR5作为有效治疗艾滋病的靶点大家并不陌生。
去年年底闹得沸沸扬扬的基因编辑婴儿便也是基于这一靶点进行的艾滋病防御性试验,但因为在人体胚胎上进行基因改造,引发了强烈的伦理争议。此次治疗性试验是在成人体细胞中进行的CCR5靶点改造,有效提高了基因编辑的有效性。
也正如邓宏魁教师所说的那样:近几年基因编辑技术不断发展,相信很快就会有安全且更高效率的基因编辑技术体系被开发出来。现有方法的优化也会多方面提高效率。未来,当基因编辑后的造血干细胞能够产生足够多的带有突变的T细胞抵御HIV时,通过一次治疗便可获得持久性疗效。
◆参考资料◆
[1] CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia
[2] 世界卫生组织网站
[3] Perez, E.E. et al. Establishment of HIV-1 resistance in CD4+ T cells by genome editing using zinc-finger nucleases. Nat. Biotechnol. 26, 808–816 (2008).
[4] Tebas P, Stein D, Tang WW, et al. Gene editing of CCR5 in autologous CD4 T cells of persons infected with HIV. N Engl J Med 2014; 370:901-10.
[5] Lei Xu, Jun Wang, Yulin Liu, et al. CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia. N Engl J Med 2019.
[6] 专家点评NEJM |世界首例!陈虎/邓宏魁/吴昊合作团队报道首例CRISPR编辑干细胞治疗HIV和白血病患者. BioArt.
文章综合整理自“NEJM医学前沿”和“生物探索”公众号
查看更多