查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:东部战区总医院 国家肾脏疾病临床医学研究中心 全军肾脏病研究所 徐峰 焦晨峰 谢红浪 曾彩虹

青年男性患者,确诊胰腺癌后给予吉西他滨联合白蛋白紫杉醇化疗半年,出现双下肢浮肿、少尿伴血压升高,实验室检查发现大量蛋白尿、血肌酐升高,肾活检组织学为血栓性微血管病,结合临床,考虑吉西他滨相关肾损害。

胰腺癌 化疗 吉西他滨 血栓性微血管病 肾活检

病例摘要
病史 男性,36岁,因“确诊胰腺癌半年,化疗4月,血肌酐升高1月”于2020-8-31入院。
患者2020年2月当地体检发现胰腺体尾部囊实性占位后诊断“胰腺癌”,化疗前测血压122/68mmHg,尿检阴性,血常规正常,白蛋白 44.8g/L,血肌酐 58.1μmol/L。2020-3-27开始给予吉西他滨1.6g d1、d8+白蛋白紫杉醇200mg d1、d8化疗,21天/周期,共6次,吉西他滨累计剂量19.2g,化疗第4疗程后复查评估肿瘤缩小,期间监测血压、血肌酐正常。自诉每次化疗后有短期恶心、呕吐不适,无腹痛、腹泻,持续约2~3天后好转。2020-7-16至2020-7-23行第6次化疗后复查Hb 85g/L,WBC 3.24×109/L,PLT 90×109/L,血白蛋白 31.5g/L,第6次化疗后5天患者出现双下肢浮肿、腹胀、尿量减少,头痛,恶心、呕吐,伴有胸闷、干咳,夜间平卧后加重,无肉眼血尿,无视物模糊,无发热。抽搐。上述症状逐渐加重。2020-8-13当地医院测血压190/130mmHg,查尿蛋白+++,尿红细胞 115/ul,血WBC 4.23×109/L,Hb 68g/L,PLT 61×109/L,白蛋白28g/l,肌酐143μmol/L,尿酸 709.5μmol/L,LDH 1010U/L(正常值109-245U/l)。给予降压、输注白蛋白、红细胞悬液、复方甘露醇等处理。2020-8-24复查Hb 65g/L,PLT44×109/L。白蛋白31g/L,肌酐332μmol/L,LDH 3505U/l。为进一步诊治收住入院。
个人史 吸烟史10余年,约半包/天,戒烟1年,饮酒史10余年,偶尔饮酒。
既往史和家族史 无特殊。
体格检查 体温:36.8℃,脉搏:78 次/分,呼吸:18次/分,血压:170/108mmHg,发育正常,贫血貌。全身浅表淋巴结无肿大。甲状腺不肿大,未触及结节。双肺呼吸音清晰,未闻及干湿啰音和胸膜摩擦音。心律齐,各瓣膜区未闻及心脏杂音。腹部平软,无压痛及反跳痛,肝脾肋下未触及,移动性浊音阴性。双下肢轻度浮肿。

血常规:Hb 61 g/L,WBC 4.15×109/L,中性粒细胞比例55.9%,淋巴细胞比例 26.5%,PLT 100×109/L,网织红细胞百分数5.41%。外周血涂片:红细胞碎片易见。
尿液:尿量1400ml/日,尿蛋白5.44g/24小时,尿沉渣红细胞67.5/ul,混合型,尿白细胞9.1/ul;α2-M 4.2mg/L,C3 23.95mg/L,RBP 16.8mg/L,NAG酶 28.8U/g·Cr,尿渗量527mOsm/kg·H2O。
血生化:Alb 32g/L,Glb 29.6g/L,尿素 27.7 mmol/L,Scr 404.7μmol/L,UA 665μmol/L,谷丙转氨酶 39 U/L,谷草转氨酶47 U/L,甘油三脂 2.87 mmol/L,胆固醇5.31 mmol/L, 钠 134 mmol/L,钾 4.3 mmol/L,氯 104 mmol/L,钙 2.18 mmol/L,磷2.13 mmol/L,总二氧化碳 19.5 mmol/L; PTH 165.30pg/ml,25羟维生素D 7.53ng/ml、C反应蛋白 5.9mg/L。空腹、餐后2小时血糖、糖化血红蛋白正常。乳酸脱氢酶2507U/L、肌红蛋白66.7ng/ml、CK-MB<0.5ng/ml、肌钙蛋白I 0.01ng/ml、脑利钠肽前体1060pmol/L。
免疫学检验:直接和间接抗人球蛋白试验阴性、抗不规则抗体筛查阴性、血清酸化溶血试验阴性。游离血红蛋白 240.6mg/L,血清结合珠蛋白 145.3ng/L。补体C3 0.878g/L,C4 0.181g/L,补体因子H、补体因子H抗体、补体因子I、补体C3转化酶抗体均正常;ADAMTS13活性 56.4%(正常值68-131%),ADAMTS13抗体179.79ng/ml(正常值131.25-646.5ng/ml);AECA阳性 1:160;VEGF 88.93pg/ml(正常值0-142pg/ml) pANCA、cANCA 阴性。抗核抗体(ANA)、抗双链脱氧核糖核酸抗体(Ads-DNA)、抗核抗体谱、ACL、,抗C1q抗体阴性,抗β2GP1 14.38 RU/ml;血IgG 11.9g/L,IgA 2.04g/L,IgM 0.562g/L,IgE 145IU/ml,ASO 123IU/ml,RF<20IU/ml,IgG4 440mg/L。外周血淋巴细胞亚群:CD3 873个/ul,CD4 508个/ul,CD8 356个/ul,CD19 131个/ul,CD20 132个/ul;血游离轻链:κ链 29.4mg/L、λ链 46.1mg/L、κ/λ比值 0.64。免疫固定电泳图谱未见明显异常单克隆免疫球蛋白条带。
肿瘤标志物:甲胎蛋白 2.9ug/L、癌胚抗原 0.82ug/L、铁蛋白1033.5ug/L、β2-微球蛋白>10mg/L、CA19-9 5.66U/ml、CA125 145.60U/ml、CA72-4 13.81U/ml、CA50 3.59U/ml、CA24-2 2.88IU/ml。
传染病四项:阴性。

双肾B超:左肾106mm×49mm×53mm,右肾112mm×43mm×56mm,皮质厚度不清,皮质回声稍增强,皮髓界限清楚。
CT腹部:胰尾部多房囊性灶,与胰管分界不清;脾大,脾周多发血管影;腹腔少许渗出,腹盆腔积液。
上腹部MRI平扫+增强:胰腺癌化疗后:胰尾部多房囊性灶;脂肪肝;脾大,脾静脉闭塞可能,脾周多发侧枝血管影;腹腔积液,腹腔少许渗出。
头颅MRI平扫:鼻中隔偏曲,左侧下鼻甲肥大,双侧筛窦炎,脑实质未见明显异常;
心脏超声:左房大,左室壁增厚,轻度二尖瓣反流,肺动脉收缩压增高并轻-中度三尖瓣反流,少量心包积液,肺动脉收缩压59mmHg,射血分数66%,未见占位。
眼底:视乳头边界清,黄斑区中心凹反光消失,视网膜可见散在片状出血,动静脉比例1:2,动脉硬化程度2级。

光镜 皮质肾组织1条,33个肾小球中1个球性废弃,1个节段硬化,1个节段纤维细胞性、1个纤维性新月体,余肾小球系膜区轻度增宽,系膜基质增多,毛细血管袢开放欠佳(图1A),部分球袢皱缩明显,袢内单个核细胞5~15个,部分球袢内见红细胞聚集。PASM-Masson:肾小球较多外周袢分层(图1B)。肾小管间质中度急性病变,多灶性肾小管上皮细胞刷状缘脱落,伴轻度慢性病变,多处小灶性肾小管萎缩、基膜增厚,间质较多单个核细胞浸润,纤维化+,亦见多处小灶性水肿。小动脉节段透明变性,偶见内膜增厚。
免疫荧光 冰冻切片荧光染色IgG、IgA、IgM、C3、C1q、Fibrin、κ轻链、λ轻链均阴性。
电镜 电镜下观察1个肾小球。肾小球系膜区轻度增宽,系膜细胞2~3个,基膜样物质增多,系膜区少量电子致密物沉积。肾小球毛细血管袢开放好,多处基膜内皮下区域增宽、疏松,见细胞成分插入,个别外周袢向尿极延伸,内皮下少量电子致密物。肾小球足细胞足突融合,约20~30%,胞浆少量微绒毛化。间质灶性水肿。
小结:血栓性微血管病(吉西他滨相关)。
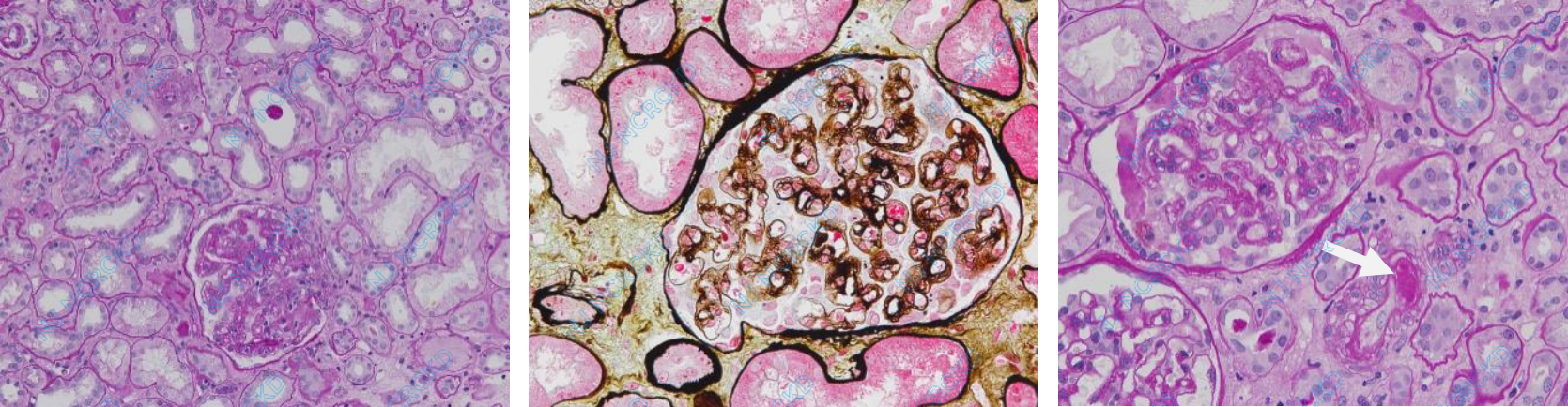
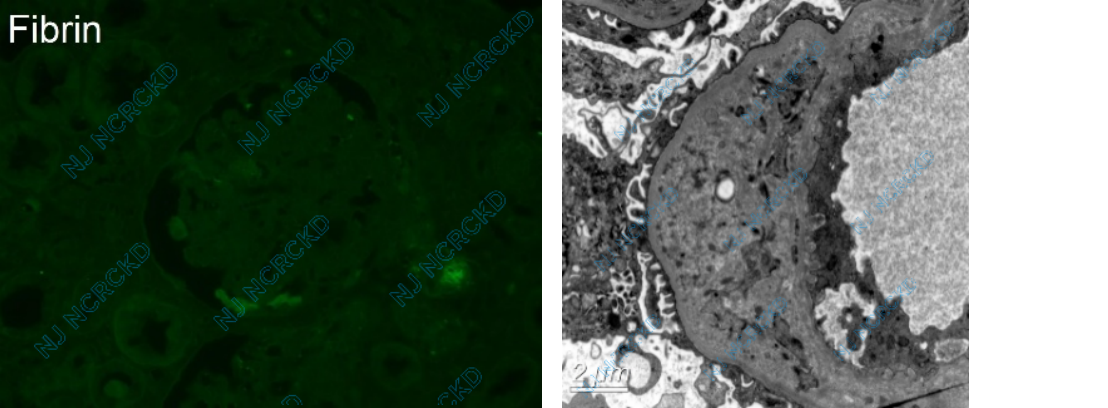
图1A:肾小球毛细血管袢开放欠佳,灶性肾小管上皮细胞刷状缘脱落(PAS 200×);B:肾小球较多外周袢分层(PASM-Masson 400×);C:小动脉节段透明变性(白色箭头)(PAS,400×);D:肾组织Fibrin染色阴性(IF,400×),E:多处基膜内皮下区域增宽、疏松,内皮下见密度减低的物质分布,并见新的基膜形成(®)(EM)。
入院后予以甲泼尼龙40mg/日、输注新鲜冰冻血浆(2900ml)、降压、改善贫血、保肾等治疗。2020年9月5日开始CRRT治疗。后患者尿量增多,肾功能好转。9月17日摆脱透析。化疗方案调整为folfox方案(奥沙利铂+亚叶酸钙+氟尿嘧啶)。2021年1月25日门诊复查尿蛋白定量0.96g/d,尿红细胞阴性,Hb 89g/L,PLT 148×109/L,肌酐126μmol/L。

讨论
本例患者为青年男性,胰腺癌化疗病情稳定,化疗过程中出现双下肢浮肿、血压高,实验室检查发现微血管病性溶血性贫血(MAHA),红细胞碎片易见,血小板减少,LDH升高,肾脏表现为大量蛋白尿,镜下血尿,血肌酐升高,肾活检组织学见肾小球TMA样病变,肾小管间质急性损伤,免疫荧光阴性。超微结构观察肾小球毛细血管袢内皮下区域增宽、疏松,新的基膜形成,系膜区和内皮下少量电子致密物分布,符合TMA。
TMA的病因众多,可分为原发性和继发性,原发性TMA包括溶血尿毒综合征(HUS)和血栓性血小板减少性紫癫(TTP)。溶血尿毒综合征包括典型HUS和不典型HUS(aHUS),前者为分泌志贺毒素的大肠埃希菌感染所致,后者和补体旁路途径的异常有关。TTP和血管性血友病因子裂解酶(ADAMTS13)的缺乏和活性降低有关。另外感染、自身免疫性疾病、移植(包括骨髓和实体器官移植)、妊娠、毒素、放射、恶性肿瘤和药物等是导致TMA的继发病因。本例患者病程中没有肠道感染的病史,补体和补体调节因子均未见异常,ADAMTS13活性略有下降,并未达到诊断TTP的标准。同时结合临床,自身免疫性疾病、移植、妊娠、毒素、放射等因素均可排除。患者有明确的转移性胰腺癌病史,并且在治疗过程中出现血栓性微血管病,因此考虑TMA与恶性肿瘤或其治疗有关。
恶性肿瘤特别是伴有多处转移时会导致TMA,腺癌是肿瘤相关TMA患者中最常见的肿瘤类型,其中胃癌最常见,其次是乳腺癌,前列腺癌和肺癌,在胰腺癌、肝癌以及血液系统肿瘤如淋巴瘤、白血病和多发性骨髓瘤中也有报道。肿瘤相关TMA的机制尚不明确,目前认为有以下可能:1、腺癌产生的黏蛋白(Mucin)对受损的内皮细胞产生有害作用,影响vWF的产生和释放,2、全身微血管转移,微血管肿瘤栓塞会导致红细胞破坏和血小板的消耗,引起微血管病性溶血,3、产生ADAMTS13抗体,导致ADAMTS13缺乏,损伤内皮细胞,但是肿瘤相关TMA患者通常没有ADAMTS13缺乏和ADAMTS13抗体阳性,因此这一机制可能性较小,4、骨髓受到侵犯时,异常血管生成、肿瘤快速生长以及继发性的骨髓纤维化,导致骨髓血管内皮细胞损伤,释放超大vWF多聚体(ULVWF),导致血管内血小板聚集和血栓形成。肿瘤相关TMA常发生于肿瘤广泛转移时,因此肿瘤相关TMA通常预后不佳。本例患者为胰腺癌伴多处转移,但是经过化疗后病情相对稳定,肿瘤标志物下降。肿瘤相关TMA的可能性不大。
抗肿瘤治疗药物是导致肿瘤患者TMA更常见的原因,目前已发现有多种抗肿瘤药物与TMA有关,大致可以分为两种类型:Ⅰ型包括所有化疗药物,如丝裂霉素C、吉西他滨、奥沙利铂等,这些药物导致的肾脏损伤可能与累积剂量有关,通常有比较明显的血液学证据,如微血管病性溶血性贫血、血小板减少等,Ⅱ型包括所有抗血管内皮生长因子(抗VEGF)的药物,如贝伐珠单抗,酪氨酸激酶抑制剂等,这类药物通常与累积剂量无关,而且可能没有明显的血液学证据,仅表现为局限于肾脏的TMA(表1)。此外一些非抗肿瘤药物也和TMA有关,例如免疫调节剂如他克莫司、西罗莫司,抗血小板药物如氯吡格雷和噻氯吡啶,干扰素,降脂药,抗病毒药,非甾体抗炎药等,详细询问患者的用药情况对于判断导致TMA的具体药物原因非常重要。目前认为药物导致TMA的机制有以下可能:1、产生ADAMTS13抗体,促进ULVWF增多,2、产生补体和补体调节因子抗体,3、抑制VEGF,4、直接内皮细胞毒性。经过仔细询问,本例患者病程中并没有上述非抗肿瘤药物和抗VEGF药物,ADAMTS13抗体和补体相关抗体阴性,血VEGF正常。在治疗过程中使用了吉西他滨和紫杉醇,其中吉西他滨是导致TMA的常见药物,患者出现症状也与患者抗肿瘤治疗存在时序性相关。因此本例考虑吉西他滨相关的TMA。
吉西他滨是一种胞嘧啶核苷衍生物,结构类似于阿糖胞苷,在体内由脱氧胞嘧啶激酶活化,抑制细胞DNA合成并引起细胞凋亡,属于细胞毒性药物,用于治疗转移性胰腺癌、转移性非小细胞肺癌、复发性或难治性卵巢癌、乳腺癌、膀胱癌以及其他多种恶性肿瘤。吉西他滨的主要不良反应包括骨髓抑制、流感样综合征和皮疹,而导致血栓性微血管病的病例报道也逐渐增多,TMA的发作时间比较多样,停药后1天至数月后均可发生TMA,文献报道吉西他滨诱发TMA的发生率约为0.015%~0.31%,中位累积剂量为20g/m2(9-56g/m2)。本例患者累积剂量为10.2g/m2。随着吉西他滨在肿瘤治疗中应用指征的扩大,以及对其可能导致TMA认识的提高,发生率可能比认为的更加常见。Desramé等人研究系列中吉西他滨相关TMA的发生率为2.2%,作者建议在吉西他滨治疗期间进行系统的临床和实验室筛查,可以更早地诊断和治疗。当吉西他滨治疗剂量达到10g/m2时,就需要警惕TMA的发生。新发高血压或者高血压加重、外周水肿或全身浮肿被认为是提示吉西他滨相关TMA的早期临床指征。贫血和血小板减少需要与骨髓抑制的副作用进行鉴别,网织红细胞、乳酸脱氢酶、血涂片观察红细胞碎片有助于鉴别。
吉西他滨导致TMA的机制有如下可能,大剂量的使用可直接损伤内皮细胞,释放大量ULVWF,激活凝血因子,导致血小板聚集和血栓形成。此外吉西他滨也可能通过免疫机制介导内皮细胞损伤,如产生ADAMTS13抗体,导致ADAMTS13活性下降;激活补体旁路途径,产生膜攻击复合物损伤内皮细胞;活化单核细胞、中性粒细胞,导致血小板的活化和聚集,产生针对多种细胞的抗体,导致内皮细胞和微血管损伤。
出现吉西他滨相关TMA时,首先需要立即停用吉西他滨,并按需控制血压、输注新鲜冰冻血浆、血浆置换或免疫吸附,此外类固醇激素、依库珠单抗、利妥昔单抗也有一定的疗效。疗效的差异性可能与损伤机制的不同有关。补体旁路途径异常活化的患者,依库珠单抗可能有效,存在ADAMTS13抗体时,需要血浆置换,而如果仅有ADAMTS13活性下降,可补充新鲜冰冻血浆。多数情况下立即停药并给予相应治疗是有效的,但是也有相当一部分患者预后不良,再次使用吉西他滨可能会导致复发,患者应避免再次使用吉西他滨。Glezerman等人总结了29例吉西他滨相关HUS,诊断后立即停用吉西他滨,19例患者肾功能完全或部分恢复, 7例患者进展至ESRD,3例患者为CKD。本例患者立即停用吉西他滨,予以甲泼尼龙、降压、输注新鲜冰冻血浆、改善贫血、CRRT等治疗,患者尿量增多,肾功能好转,蛋白尿部分缓解,肾功能也有所改善。
需要注意的是,吉西他滨造成的血管毒性作用并不仅仅是TMA,还包括静脉血栓、动脉栓塞、血管炎样改变、毛细血管通透性增加等(表2)。特别是合并使用其他抗肿瘤药物如铂类药物时,血栓和其他血管并发症会增加。因此对于吉西他滨的血管损伤需要注意全面评估。对于有心脏病、肺部疾病、外周血管疾病以及自身免疫性疾病等基础疾病的患者,使用吉西他滨需要慎重考虑。
小结:吉西他滨在治疗肿瘤中的应用日趋广泛。除了骨髓抑制、流感样综合征、皮疹等常见副作用外,临床医师需要警惕其造成的血管并发症,其中TMA是其比较常见的血管并发症之一。早期症状为新发高血压或高血压加重、水肿,多数患者表现为溶血性贫血、血小板减少和肾脏损伤,肾活检可以进一步明确诊断。
表1 Ⅰ型和Ⅱ型肿瘤药物相关TMA的特点
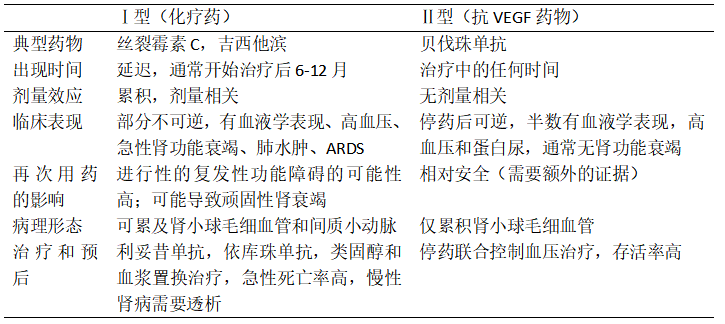
表2 吉西他滨相关血管/血栓事件的病理生理学分类

来源:东部战区总医院供稿,摘自《肾脏病与透析肾移植杂志》
查看更多