查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2023年上半年,关于ILD的研究有一些实质性的进展突破。具体的前沿信息包括了:在经历新冠和甲流感染时,ILD患者该如何面对?随着AI在各行各业的运用,在诊断纤维化性ILD时 AI HRCT会有怎样的优势?可以改善癌症患者预后的免疫检查点抑制剂(ICI),在使用期间常发生ICI相关性肺炎,有哪些因素会导致这种肺炎的发生?我们特邀复旦大学附属中山医院的金美玲教授,为大家进行逐一解答。
复旦大学附属中山医院

复旦大学附属中山医院 变态反应科/呼吸科 主任医师,博士生导师
复旦大学附属中山医院变态(过敏)反应科主任
中国医师协会变态反应医师分会副会长
中国罕见病联盟呼吸病学分会副主委
上海医师协会变态反应医师分会会长
上海医师协会整合医学分会副会长
上海医学会呼吸分会哮喘学组副组长
在哮喘等呼吸过敏性疾病、呼吸罕见病及肺癌全程管理方面有深入研究
荣获上海医师协会第三届“仁心医者”杰出专科医师奖
金美玲教授访谈视频
患有间质性肺疾病(ILD)的人群是病毒感染的脆弱人群。一旦ILD患者感染病毒后,和没有感染的患者相比,感染后的急性加重风险增加,生存率也更低1,2。在新冠病毒感染之后,ILD患者将面对的是更差的预后以及更高的死亡风险3,4。因此,在新冠流行期间,ILD患者需要采取比较全面的管理方案,有效降低因病毒感染导致的急性加重风险。(如下表1)
表1. 新冠流行期间ILD患者的管理

近来,有学者运用人工智能(AI),改变了医学影像分析方法,提高了ILD患者的诊断和预后水平,诊断准确率高达78%-91%7。
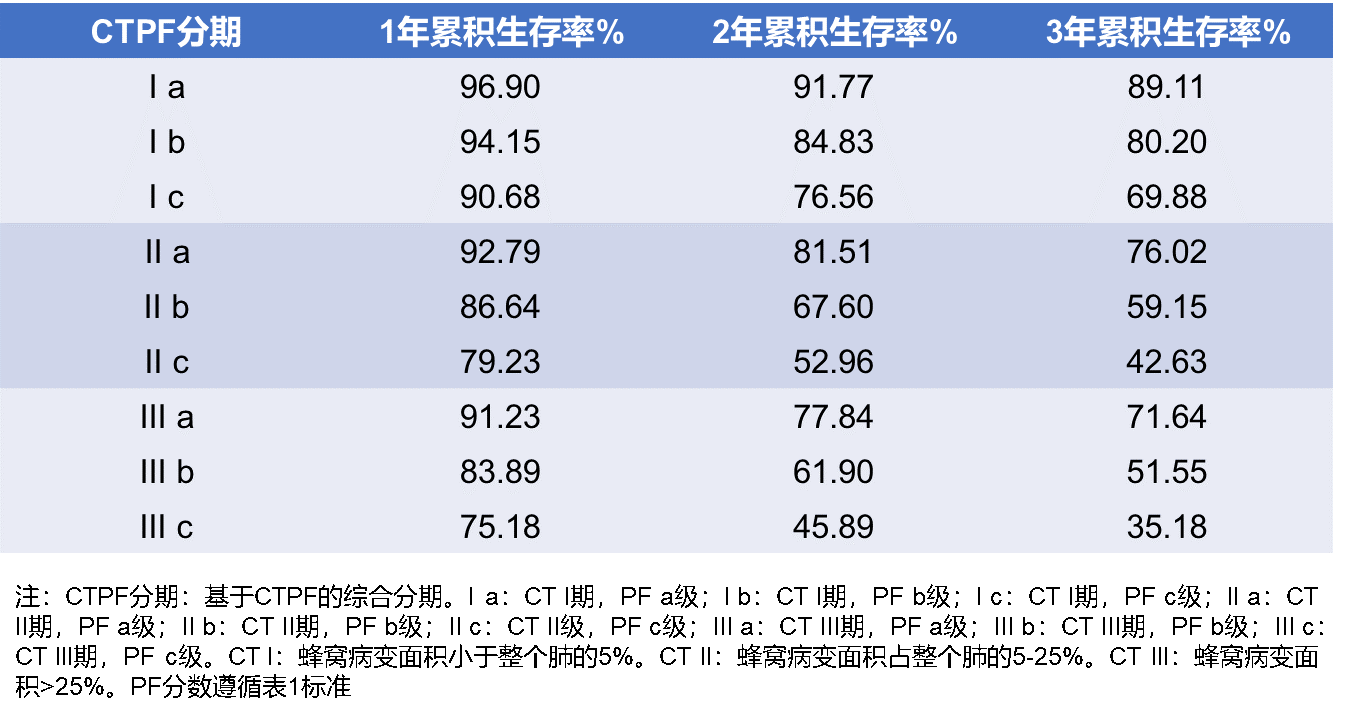
上海肺科医院团队研究开发了一种新的IPF患者死亡风险预测模型——CTPF模型,这项模型通过PF(肺功能、生理功能)分级以及基于AI的HRCT肺纤维化分级(表2),有效地评估IPF患者的疾病严重程度并预测死亡风险(表3),且相对于其他评估方法而言,具有参数全面、操作简便、精确度高、便于临床应用等优点8。
表2. CTPF模型:肺纤维化分期和严重度分级评估方法

表3. CTPF模型预测不同CTPF分期患者的1年、2年和3年累积生存率
免疫检查点抑制剂可显著改善癌症预后;然而,ICI治疗期间常发生ICI相关性肺炎(CIP),严重级别的CIP可能导致过早死亡。目前对于检查点抑制剂相关肺炎(CIP)的治疗建议主要是免疫抑制治疗,特别是对于对皮质类固醇反应差和肺炎病程较长的患者,也需要抗纤维化药物。这是因为纤维化改变在CIP的病理演变中起着重要作用9。
目前有3项研究对CIP发生的危险因素进行了探索,以便可以提前识别疾病。一项观察性、回顾性病例对照研究,发现年龄≥65岁、吸烟、COPD、鳞状细胞癌、既放疗均与CIP的发生呈独立相关10(表4);肺气肿、ILD、胸腔积液、有ICI期间放疗史和ICI单药治疗与重度CIP发生呈独立相关10(表5)。
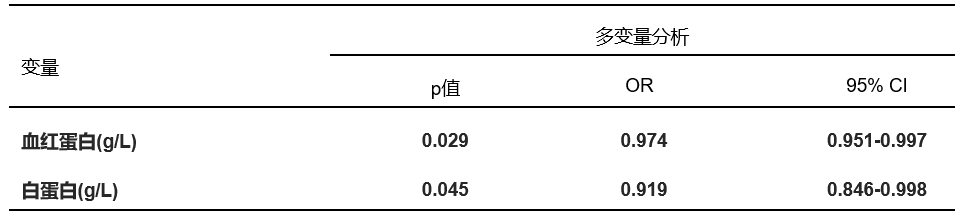
另外一项研究表明,在血清学指标中,治疗前低水平的血红蛋白(HB)和白蛋白(ALB)是CIP的独立危险因素11(表6)。另外还有研究显示,乳酸脱氢酶(LDH)水平>320 U/L是难治性CIP的独立危险因素(OR,8.889;95% CI: 1.294-61.058;P = 0.026)12。
因此,对于ICI治疗的肿瘤患者,应当警惕CIP的发生,早期识别危险因素,早期进行相应治疗。
表4. 总CIP发生的潜在风险因素Logistic回归分析
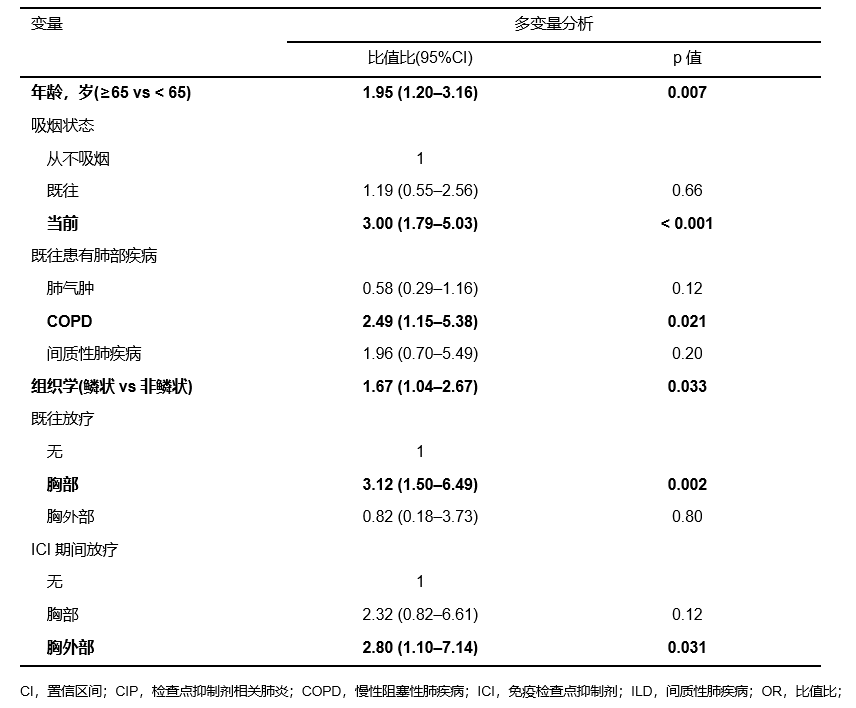
表5. 重症CIP的独立危险因素多变量分析

表6. CIP发生的风险因素分析
接下来我们看看2023年上半年关于CTD-ILD相关的热点信息。为了规范临床的诊断与治疗,改善患者预后,日本和美国分别发表了关于结缔组织病相关间质性肺疾病(CTD-ILD)及系统性硬化症相关间质性肺疾病(SSc-ILD)的专家共识13,14。我们特邀上海交通大学附属仁济医院的陈盛教授与我们分享这两项共识的重点内容。
上海交通大学附属仁济医院

主任医师,教授,博士生导师
上海交通大学附属仁济医院风湿免疫科副主任
美国国立卫生研究院博士后
中国医师协会风湿病分会委员
中国女医师协会风湿免疫专委会常委
中华医学会心身分会风湿病学组委员
上海医学会风湿病分会委员
上海医师协会风湿病分会委员
陈盛教授访谈视频
该共识声明于2023年1月发布,从6个关键流程上介绍了CTD-ILD管理的方案。主要流程如下(图1):
CTD患者发生ILD的风险增加。
-对于出现持续性呼吸道症状的CTD患者应怀疑存在ILD;
-胸部的X线检查、听诊、CT和/或HRCT是CTD患者ILD的有效筛查工具,也可考虑检测涎液化糖链抗原(KL-6)。
-HRCT和多学科讨论在诊断ILD起关键作用,此外还可考虑血清生物标志物(KL-6、表面活性蛋白D(SP-D)等;鉴别诊断可用支气管肺泡灌洗。
-评估严重程度可考虑HRCT、用力肺活量(FVC)、肺一氧化碳弥散功能(DLco)、6分钟步行试验(6MWD)、血氧饱和度(SpO2)、动脉血气、患者报告的呼吸困难结局等。
-急性/亚急性进展期的CTD-ILD患者,建议每隔几天或每月进行1次HRCT检查;如果存在ILD进展风险,每1-3个月进行1次胸部HRCT,如果无进展,每6-12个月1次。
-对于CTD-ILD患者,至少每年检测1次FVC、KL-6、SP-D和胸部HRCT。
-考虑进行综合评估(呼吸道症状、患者生活质量、胸部HRCT、FVC、DLco和KL-6)、疾病进展、个体化的风险-收益评估、FVC、多学科讨论、疾病严重程度评估等;
-如果是急性/亚急性病程,通常在ILD发作后或在其急性加重后立即开始治疗。
-评估进展需综合考虑症状、肺功能及HRCT纤维化程度的恶化;
-在ILD诊断的1个月内因呼吸衰竭需要吸氧的患者属于快速进展的ILD患者。

图1:CTD-ILD管理方案
陈盛教授访谈视频
共识建议所有的SSc患者,可以通过胸部听诊、肺功能检查(PFT)、胸部HRCT、肺动脉高压(PAH)等筛查ILD。(图2)
以下患者建议考虑治疗:
-FVC<80%且有任何程度的ILD或症状、HRCT显示全肺受累范围>20%、HRCT显示全肺受累范围>10%伴PFTs异常;
-高危患者(早期弥漫性皮肤病)伴轻度ILD(<10%);
-SpO2出现劳力性缺氧。(图2)
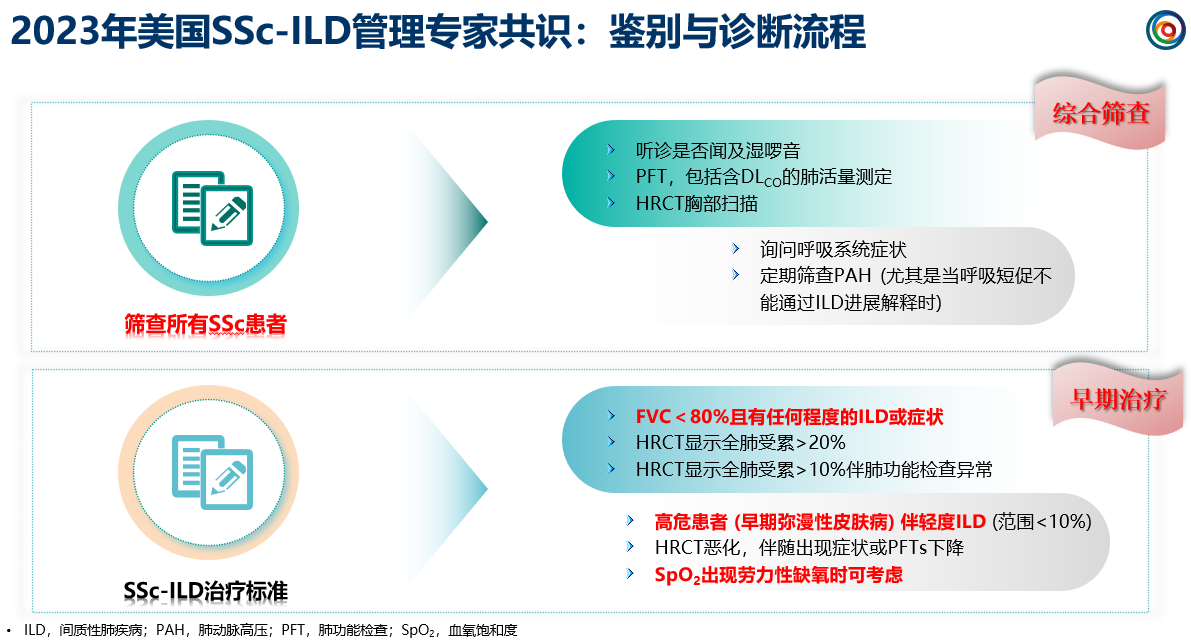
图2:鉴别与诊断流程
-初始治疗:霉酚酸酯(MMF)作为初始治疗。尼达尼布可作为MMF/CYC的附加治疗;
-进展期治疗:对于接受免疫抑制治疗后仍发生进展性纤维化性ILD、免疫治疗无法耐受、晚期侵袭性ILD的患者,尼达尼布是一种治疗选择;
-长期治疗:对于需要长期ILD且不适宜免疫抑制剂治疗的患者可使用尼达尼布单药治疗。(图3)
-随访时观察PFT、症状、HRCT随时间的变化、HRCT特征及随时间的变化;
-评判治疗是否成功:FVC、DLco、HRCT、6MWD、症状、运动后氧饱和度稳定或改善;
-在疾病稳定超过2年后,可考虑减量/中断治疗。(图3)

图3:治疗及随访推荐
两项共识围绕筛查、诊断、治疗和随访等方面对CTD-ILD及SSc-ILD患者的诊疗提出规范性的建议,供临床医生在临床实践中参考,以满足患者的需求,改善患者预后情况。
2023年5月19至24日适逢美国胸科学会(ATS)年会在美国华盛顿盛大召开,世界各地呼吸医学领域专家汇聚一堂,共同探讨整个呼吸医学领域的最新科学和临床研究进展。我们特邀上海瑞金医院的周敏教授,为大家盘点本次ATS大会中一些关于进展性肺纤维化(PPF)临床治疗的新数据。
上海交通大学附属瑞金医院

主任医师,教授,法国居里研究所博士后
瑞金医院呼吸与危重医学科副主任,博士生导师
主要从事慢性气道疾病、肺部感染及肺癌的临床研究
中华医学会呼吸病分会工作秘书,呼吸治疗学组副组长
中国医师协会呼吸分会慢阻肺委员会委员、政策委员会副主委
中华预防医学会呼吸专委会委员
上海医学会呼吸病分会委员和慢阻肺学组副组长
上海女医师协会肺部肿瘤专委会副主任委员
发表论文100余篇,SCI论著近50余篇,主编或参编多部专著
主持科技部慢病重大专项1项,子课题1项,国家自然基金3项等课题
获中国医师协会呼吸分会优秀中青年医师奖、上海市科委优秀学科带头人;上海市杰出专科医师奖等
周敏教授访谈视频
研究1:INBUILD亚组分析:尼达尼布对PPF合并肺气肿患者FVC下降的影响
目前关于肺气肿对PPF患者FVC下降影响的证据很少。在尼达尼布治疗PPF患者的INBUILD研究中,根据基线时是否存在肺气肿以及肺气肿的程度进行分组(肺气肿程度及肺纤维化合并肺气肿(CPFE)指数(=2.84+[0.90×FVC%预测值]-[0.60×FEV1%预测值]-[0.44×DLco%预测值])(CPFE<5%、≥5–<10%、≥10%),对各亚组中尼达尼布的作用进行了评估。结果表明,在INBUILD研究中,与安慰剂相比,无论是否存在肺气肿及肺气肿的程度如何,尼达尼布均减缓了FVC下降(图4)15。证实了尼达尼布对合并肺气肿的PPF患者的疗效。
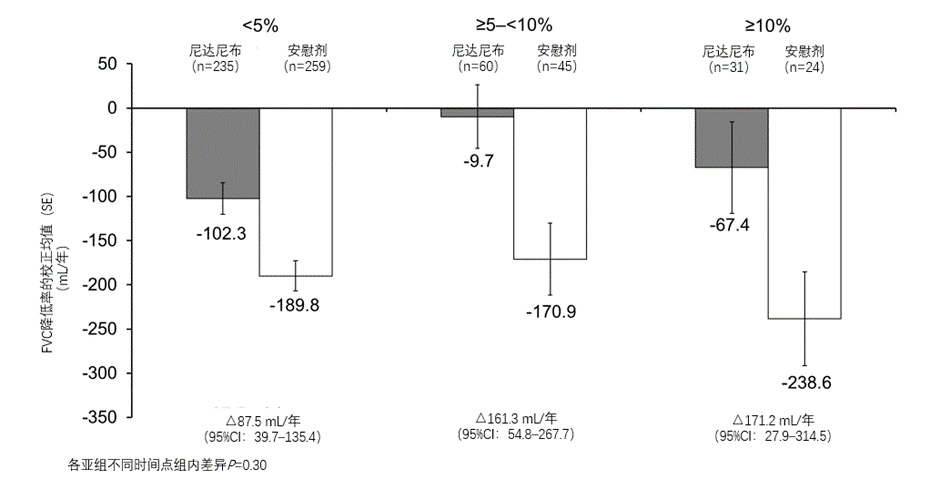
图4:按基线CPFE指数显示的52周内FVC(mL/年)的下降率
在INBUILD研究中纳入了不同ILD诊断亚组的PPF患者,本研究探讨了尼达尼布对5个亚组的循环生物标志物水平的影响——过敏性肺炎(HP)、特发性非特异性间质性肺炎(iNSIP)、未分类的IIP、自身免疫性疾病相关ILDs和其他ILDs。
结果发现,在总体人群中,与安慰剂相比,尼达尼布治疗第52周,涎液化糖链抗原-6(KL-6)、肺泡表面活性蛋白D(SP-D)、CA-125和CA19-9相对于基线的变化倍数显著降低;无论ILD诊断如何,与安慰剂组相比,尼达尼布均降低了循环上皮损伤生物标志物的水平16。(图5)
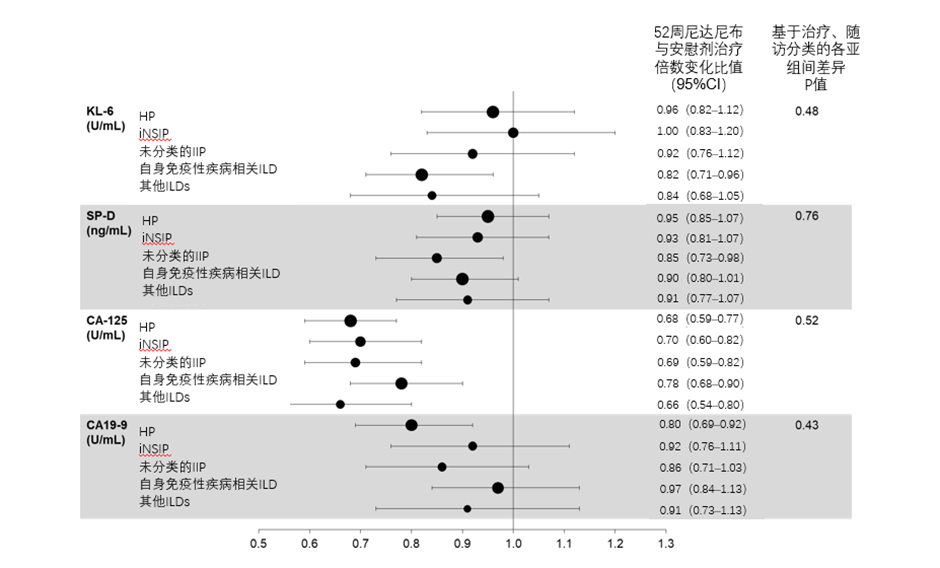
图5:尼达尼布与安慰剂治疗的患者第52周循环生物标志物较基线的倍数变化
磷酸二酯酶(PDE4)是参与调节细胞内信号的酶,有四种不同的PDE4亚型,PDE4A、PDE4B、PDE4C和PDE4D,分布在不同器官和组织中,其中PDE4B在免疫细胞和肺中高表达,抑制PDE4B会增加细胞内环磷酸腺苷(cAMP)水平,影响炎症以及纤维化过程(如:抑制中性粒细胞中的促炎介质释放、肺内嗜酸性粒细胞浸润和巨噬细胞的活性,抑制成纤维细胞增殖和功能,以及细胞外基质合成),这使得PDE4B成为治疗肺纤维化的潜在靶点17,18。(图6)
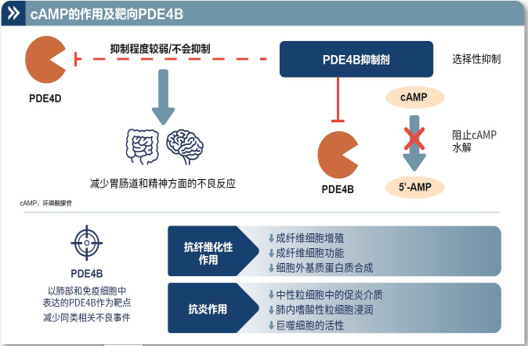
图6:PDE4B抑制剂作用机制
BI 1015550是磷酸二酯酶4B(PDE4B)优先抑制剂,可预防肺功能减退,并且在单药治疗或与尼达尼布联合使用中,可能为PPF患者提供额外的治疗选择。一项双盲、随机、多中心、安慰剂对照III期研究(FIBRONEER-ILD™,NCT05321082)将评估BI 1015550在PPF患者中的疗效和安全性。计划纳入1401例患者,以1:1:1的比例随机分配至18 mg BI 1015550每日两次(BID)组、9 mg BI 1015550 BID组或安慰剂治疗组,联合标准治疗,至少治疗52周(图7)。研究于2022年10月启动并开始入组,预计在2023年年底前完成入组,主要研究终点为自基线到第52周FVC的绝对变化,期望能发掘使用BI 1015550作为PPF患者治疗新选择的可能性19。
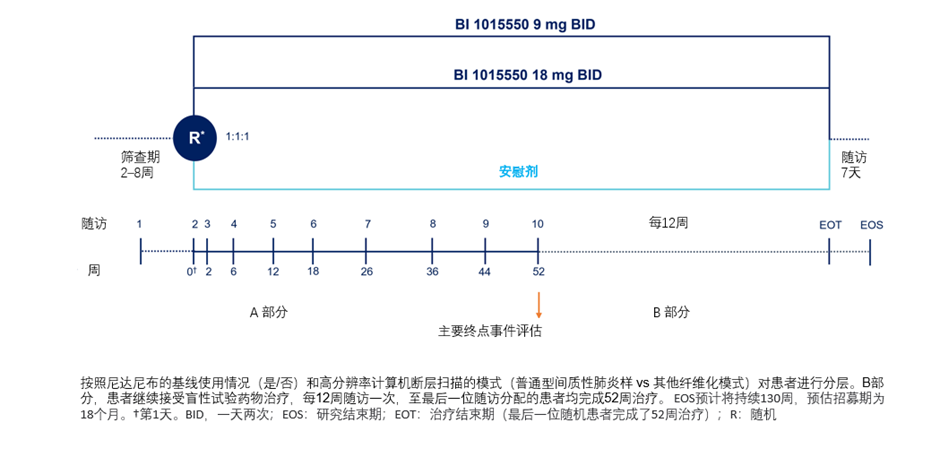
图7:BI 1015550患者入组计划
参考文献:
1. 马兆娟等. 实用医学杂志,2017,33(06):997-1000.
2. Saraya T, et al. Respir Med. 2018 Mar;136:88-92.
3. Ouyang L, et al. Int Immunopharmacol. 2021 Nov;100:108145.
4. Drake TM, et al. Am J Respir Crit Care Med. 2020 Dec 15;202(12):1656-1665.
5. Wong AW, et al. Chest. 2020 Sep;158(3):1069-1078.
6. George PM, et al. Lancet Respir Med. 2020;8:807–815.
7. Soffer S, et al. Acad Radiol. 2022 Feb;29 Suppl 2:S226-S235.
8. Wu X, et al. Front Pharmacol. 2022 Apr 26;13:878764.
9. Pan L, et al. Front Immunol. 2023 Jan 10;13:1072612.
10. Deng H, et al. Clin Drug Investig. 2023 May;43(5):347-357.
11. Liu X, et al. Front Oncol. 2023 Apr 26;13:1145143.
12. Tan P, et al. J Immunother. 2023 Feb-Mar 01;46(2):64-73.
13. Kuwana M,et al. Expert Rev Respir Med. 2023 Jan;17(1):71-80.
14. Rahaghi FF, et al. Respir Res. 2023 Jan 9;24(1):6.
15. Vincent Cottin, Kevin R Flaherty, et al. 2023-ATS.
16. Toby M Maher, R Gisli Jenkins, et al.2023-ATS.
17. Kolb M, et al. Eur Respir Rev. 2023 Feb 21;32(167):220206.
18. Herrmann FE, et al. Front Pharmacol 2022;13:838449.
19. Toby M. Maher, Shervin Assassi, et al. 2023-ATS.
审批编号:SC-CN-13156
有效期至:2024.6.29
仅供相关医药专业人士进行医学科学交流
查看更多