查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






近年来,世界范围内恶性肿瘤的发病率不断攀升,肿瘤患者接受治疗过程中出现的心血管损伤也越来越成为业内关注的热点话题。本期友谊“心”视野即与大家谈谈肿瘤治疗中需要关注的心血管问题。
作者:首都医科大学附属北京友谊医院 赵树梅 李虹伟
祸不单行!
笔者所在医院曾收治过一位女性患者,36岁,大学教师,主因无痛性颈部淋巴结肿大9个月于血液科住院治疗,确诊为霍奇金淋巴瘤。
患者既往体健,否认高血压、糖尿病病史,否认慢性心、肝、肺、肾等疾病史。
入院后给予标准的ABVD(表柔比星、博来霉素、长春新碱、达卡巴嗪)化疗方案治疗。
治疗过程中监测血常规,心电图,胸片及肝、肾功能等。该患者标准疗程、标准剂量化疗历时近7个月结束,无不适症状。化疗结束后1个月,患者出现喘憋、不能平卧、浮肿等症状,呈进行性加重的趋势,于心内科进一步治疗。
患者相关检查结果见图1~5。超声心动图示:左房4.52 cm;左室舒张末内径6.17 cm;左室射血分数(LVEF)40%。左心增大,LVEF值减低,左室整体室壁运动减弱。结合病史、经系列心脏检查,排除其他原因,考虑为化疗药物相关的心肌损伤。
(点击可查看大图,下同)
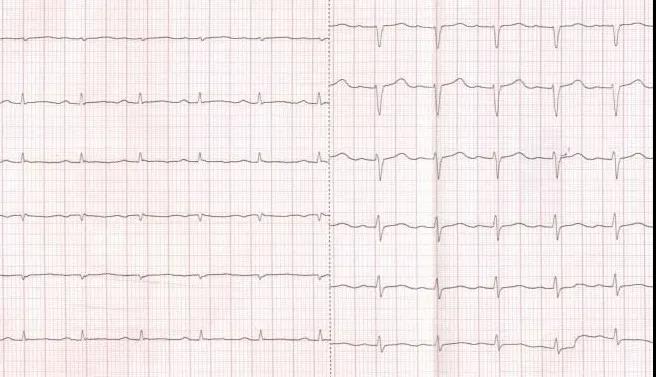
图1 化疗前首次记录心电图
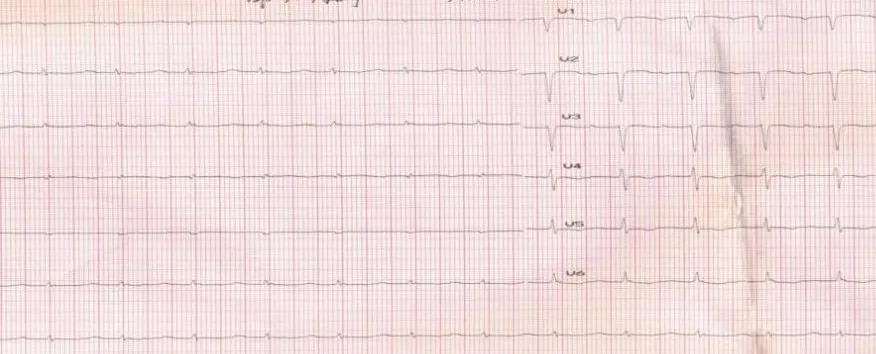
图2 出现喘憋症状后,转入心内科首次心电图:I°AVB,T波改变,R波降低
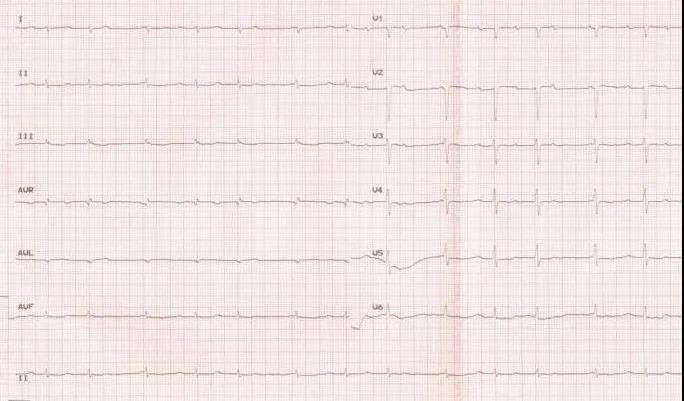
图3 于心内科住院期间,病情进展记录心电图:II°AVB
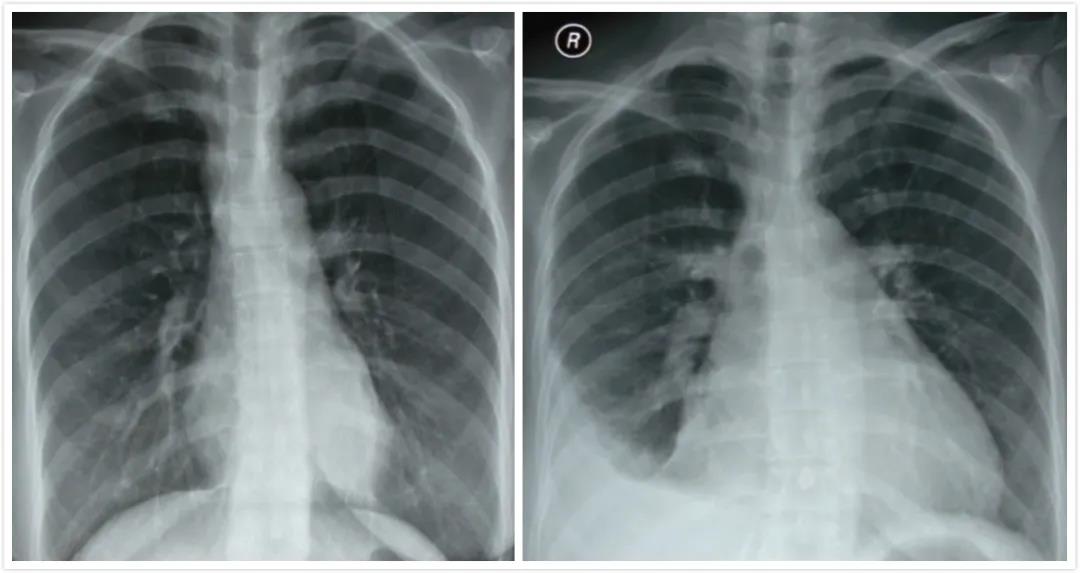
图4 化疗前首次胸片;图5 出现喘憋症状后,于心内科住院期间复查胸片
患者转入心内科后病情进行性加重,全力治疗后患者喘憋及低血压无法控制,呈现顽固性心力衰竭表现,最终治疗无效去世。回顾患者的疾病过程,从发现淋巴瘤到去世历经19个月,其中正规化疗7个月,淋巴瘤病情已达缓解,却因顽固性心力衰竭去世,从出现心力衰竭症状到去世仅2.5个月。由此可见,肿瘤治疗过程中的心血管并发症常常左右着肿瘤患者治疗的转归,是值得深入探讨的临床问题。
2019年美国癌症治疗与生存统计报告显示,目前美国已有约1690万恶性肿瘤幸存者,而幸存者大都面临着肿瘤治疗相关心血管并发症的问题。研究发现,抗肿瘤药物及放射治疗使肿瘤幸存者出现心血管并发症的风险显著增加,如冠心病、心律失常、心脏瓣膜病、心力衰竭的发生风险明显升高。
同时,心血管疾病已经成为肿瘤患者重要的死亡原因。一项女性乳腺癌的研究纳入63566例患者,中位治疗时间达9年,发现心血管疾病是造成患者死亡的首要原因,而癌症本身仅为第二位。由此可见,肿瘤患者的心血管并发症是迫切需要解决的问题,需要心脏病学和肿瘤学之间的合作。近年来出现了一个相对新兴的学科领域——肿瘤心脏病学,概括来说,肿瘤心脏病学涉及的范畴包括肿瘤患者的心血管并发症,心血管疾病患者的肿瘤治疗,以及肿瘤患者的心血管疾病治疗等,具有深远的临床意义。
恶性肿瘤治疗中
常见的心脏损害
恶性肿瘤治疗的主要措施包括手术治疗、化学治疗、放射治疗、靶向治疗和免疫治疗等。肿瘤治疗破坏和杀死肿瘤细胞的同时,也会造成心脏细胞损害。2016年欧洲心脏病学会(ESC)发布的癌症治疗与心血管毒性意见书(以下简称2016 ESC意见书)中,将肿瘤治疗相关心血管并发症分为9大类:心肌损伤和心力衰竭、冠脉疾病、瓣膜病、心律失常(特别是QT间期延长)、高血压、血栓栓塞性疾病、外周血管病和卒中。
其中,心肌损伤和心力衰竭是最常见、最严重的心血管并发症,发生的时间及严重程度差异较大。根据美国标准的定义,肿瘤治疗相关左心功能损害是指与基线或抗肿瘤治疗前相比,左心室功能显著下降;LVEF下降超过10%且低于53%;超声心动图斑点追踪检查可显示早期心功能改变,表现为整体纵向应变(GLS)达到-19%。
抗肿瘤药物引起的左心功能损伤可分成两型,见表1。Ⅰ型损伤主要见于蒽环类药物,可引起心肌细胞超微结构改变,如空泡化、肌纤维排列紊乱、坏死。Ⅰ型损伤常呈进展性,不可逆,可导致难治性心力衰竭甚至死亡。损伤的发生常与药物的累积剂量有关,如多柔比星累积剂量400 mg/m2时,损伤发生率为3%~5%;累积剂量达700 mg/m2时,损伤发生率为18%~48%。
表1 抗肿瘤药物心功能损害分类和特征
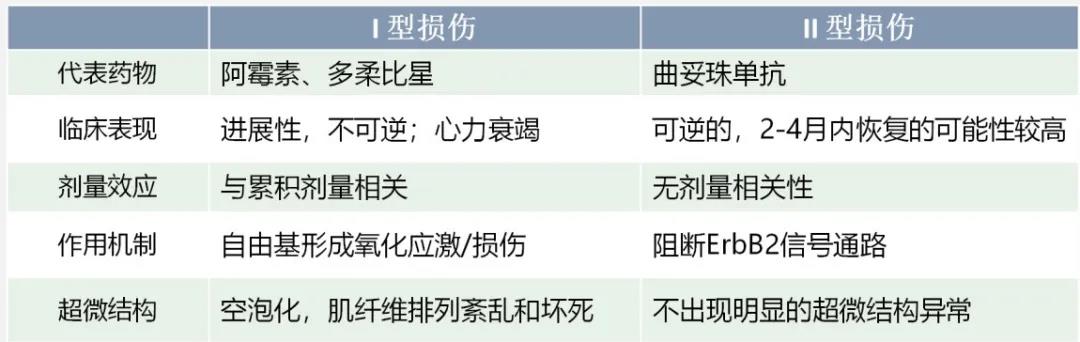
Ⅱ型损伤一般不出现明显的心肌超微结构异常,2~4个月内心功能恢复到基线的可能性较大。
肿瘤相关心功能损害的监测手段包括超声心动图、心脏磁共振检查(CMR)、放射性核素显影(MUGA)以及血清生物学标志物检测等。
常规M型和二维超声心动图是监测和评估常用的影像学方法,斑点追踪成像技术通过测量不同的形变参数(如收缩期应变峰值、峰值速率),评估心肌形变、整体和局部运动功能。
GLS是早期识别亚临床左室功能损害的最佳参数,GLS比基线水平下降>15%考虑发生了心肌损伤。
CMR能够准确反映心功能状态,提供更多心肌组织方面的信息。造影剂增强的CMR在识别病因及心脏微小结构病变方面更具独特的优势。
MUGA测量LVEF具有较高的准确性,但存在放射性暴露,通常作为补充检查手段。
生物学标志物是早期识别、监测心脏毒性作用的有效指标,如脑钠肽(BNP)和N末端B型脑钠肽前体(NT-proBNP)、肌钙蛋白I(TNI)等,相关指标升高是心肌损害发生发展的标志。
资料显示,抗肿瘤治疗可导致冠脉病变、心绞痛甚至心肌梗死。曾有研究观察了452例女性乳腺癌患者,入组患者均接受卡培他滨(氟嘧啶衍生物)治疗,其中22例(4.9%)患者出现心肌缺血症状,表现为胸痛、呼吸困难或心悸;11例患者(2.4%)出现心电图改变,表现为心房颤动,ST段压低,T波异常;2例患者(0.4%)发生心肌梗死。
前瞻性研究显示,抗肿瘤药物导致心肌缺血的发病率约为10%~18%(包括24小时动态心电图发现的无症状性心肌缺血)。肿瘤相关心肌缺血临床症状往往表现为非典型症状或静息性心绞痛。氟嘧啶及其衍生物是致心肌缺血最常见的药物,纵隔或左胸放疗可显著增加冠脉病变及心肌缺血的发生率。心肌缺血发生的机制目前尚不完全明确,可能涉及血管内皮毒性作用,血液高凝状态或肥大细胞介导的超敏反应等。
肿瘤治疗可诱发各种类型的心律失常,窦性心动过缓、房室传导阻滞、心房颤动和室性心动过速最常见。心律失常分为原发性和继发性两大类,前者是由于化疗药物作用于某些离子通路,直接导致心律失常;后者主要继发于药物导致的心肌病变、心功能不全、高血压等因素。原发性与继发性心律失常有时难以界定,但是继发性心律失常更常见,其中QT间期延长值得关注,常继发于治疗后左室功能障碍、心肌缺血、电解质紊乱和代谢异常等因素,继而出现各种类型室性心律失常,甚至室性心动过速和心室颤动。
放射性治疗能够诱导炎症反应,激活促成纤维因子,导致血管内皮和微血管损伤,诱导氧化应激反应,出现各种类型的心血管损伤。放疗急性损伤主要由放射损伤和即刻的炎症反应导致;而放疗慢性损伤往往不可逆,可能影响多个心脏结构,包括冠脉、心肌、心包、瓣膜和心脏传导系统;其中冠脉损伤最为常见和明显,特别是左侧胸部放疗。
抗肿瘤药物引起心脏损害常见于传统抗肿瘤药物(如蒽环类)、分子靶向药物和免疫检查点抑制剂。分子靶向药物的主要代表有曲妥珠单抗、贝伐珠单抗等,其中前者可能通过HER2通路影响神经调节蛋白和心肌基因表达,参与氧化应激介导的心肌细胞损伤;临床上曲妥珠单抗相关心脏毒性主要表现为心功能不全和心力衰竭。免疫检查点抑制剂(ICIs)也是一类重要药物,其相关进展推动了抗肿瘤治疗的革命性发展。ICIs通过免疫相关机制识别和破坏肿瘤细胞,然而ICIs可能在靶外器官(如心脏)中诱导免疫相关的不良事件。心脏损害的机制可能涉及活化的T细胞攻击正常组织、自身抗体增加及炎性细胞因子增加等。ICIs心脏损伤最常见的表现是心肌炎,尽管发生率不高,但死亡风险较高。
本文开篇介绍患者心脏损害的发生主要源于蒽环类药物。蒽环类药物是临床上应用最广泛的一类抗肿瘤药物,是治疗血液肿瘤和实体肿瘤的基石,但也是文献报告心脏损害最常见的药物,代表药物为多柔比星。概括来讲,蒽环类药物引起的心脏毒性可分成3类:①急性反应,给药后的几小时或几天内出现,常表现为心电活动传导紊乱和心律失常,极少数表现为心包炎和急性左心衰竭。②慢性反应,化疗1年内出现,表现为左心功能障碍,最终出现心力衰竭。③迟发性反应,化疗后数年出现,表现为心功能不全、心力衰竭、心肌病、心律失常等。
一项纳入了630例乳腺癌和肺癌患者的回顾性研究显示,接受多柔比星化疗后,累积剂量达到550 mg/m2时,心力衰竭的发生率为26%。其中年龄是重要的危险因素,>65岁的人群中,心力衰竭的发生风险更高。
蒽环类药物心血管损伤的确切机制尚不完全清楚,可能涉及多因素。目前广泛接受的观点是药物作用使得活性氧(ROS)生成增加,氧化应激反应增强,导致DNA损伤和线粒体功能不全。此过程中铁离子与药物形成复合物发挥着重要作用。近来研究发现,拓扑异构酶2(Top2)是蒽环类药物介导心血管毒性的重要调节因子。动物研究显示,心肌细胞Top2β敲除可保护小鼠免受多柔比星诱导的线粒体功能损伤及心血管毒性反应。
病理学方面,光镜下蒽环类药物治疗后会出现心肌水肿,心肌细胞消失,间质纤维化及细胞器改变;电镜下可见心肌纤维溶解,纤维束广泛缺失,线粒体裂解及心肌细胞内空泡形成等改变。尸检资料证实,接受蒽环类药物治疗的肿瘤患者,心肌组织会出现肌溶解、灶性心肌坏死、弥漫性或灶性心肌纤维化等改变。
心血管风险的管理
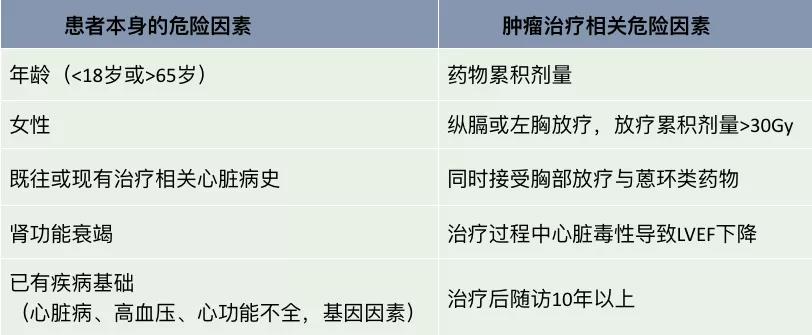
确定肿瘤治疗方案前,应考虑到可能出现的心血管损害,对患者进行基线心血管风险评估,识别危险因素及高危患者,见表2。对于高危患者,应当妥善制定肿瘤治疗方案,包括药物种类、给药方式和疗程时间等,尽可能避免肿瘤治疗衍生的心血管损害。其次,需加强药物心脏毒性的监测,如定期检查超声心动图,测定血清生物标志物水平等。此外,有些患者需给予相应药物进行干预治疗。
表2 危险因素评估
根据2016 ESC意见书推荐,肿瘤治疗相关心功能损害,如果仅表现为GLS下降,目前尚无证据支持给予特殊心脏保护的干预。而对于明确的化疗相关心力衰竭患者,需按照现行心力衰竭指南的推荐,给予优化药物治疗,如血管紧张素转换酶抑制剂(ACEI)、β受体阻滞剂等。同时与肿瘤科专家讨论调整化疗方案,包括使用心脏毒性小的药物(如脂质体剂型药物)或保护性药物(如右丙亚胺)等。
右丙亚胺可以有效地预防蒽环类药物所致心脏毒性,目前已纳入欧美指南推荐。右丙亚胺的保护机制源于其可与游离铁离子螯合,可以从蒽环类螯合物中夺取铁离子,从而抑制螯合物通过促进自由基产生带来的心脏毒性。此外,研究显示右丙亚胺本身具有清除自由基和抗氧化的作用。但需要注意的是,右丙亚胺能够预防蒽环类药物心脏毒性,其本身并不能治疗蒽环类药物导致的心肌损伤和心力衰竭。
查看更多