查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





肝细胞癌(HCC)是全球癌症相关发病率和死亡率的主要原因之一。目前可用于HCC诊断或预后的生物标志物如甲胎蛋白的准确性有限。肝活检组织可以揭示肿瘤生物学特性,但由于侵袭性和肿瘤种植风险并未被常规使用,尤其是在早期患者中。循环肿瘤细胞(Circulating tumor cells,CTCs)是来源于原肿瘤或转移灶的循环中的癌细胞,通过液体活检检测CTC对于促进HCC的精准治疗方面有巨大的潜力。
既往多项研究显示CTCs的定量丰度,以及CTCs间的生物学特征和基因组异质性,可以预测HCC患者的疾病预后和对治疗的反应。2020年8月加州大学洛杉矶分校发表的一项研究显示HCC CTC中PD-L1表达或与预后及免疫检查点抑制剂的应答相关。
CTC生物学特性和临床意义概述
HCC表现出上皮特征,表面表达上皮标志物如EpCAM和CK,及肝细胞特异性标志物如ASGPR和GPC3。HCC细胞以不同的方式进入血液成为CTCs,进入循环后,大多数CTCs会被失巢凋亡、剪切应力或免疫攻击破坏。存活下来的CTCs和CTC簇可以通过各种不同的富集技术从外周血中收集和分离,帮助HCC的早期检测、预后判断和分子表征。CTC来源于原发肿瘤内的细胞和转移部位内的细胞。因此,使用CTCs进行液体活检不应仅仅被视为实际活检的创伤较小的替代方法,而是获得对全身异质性肿瘤细胞全面了解的一种方式。
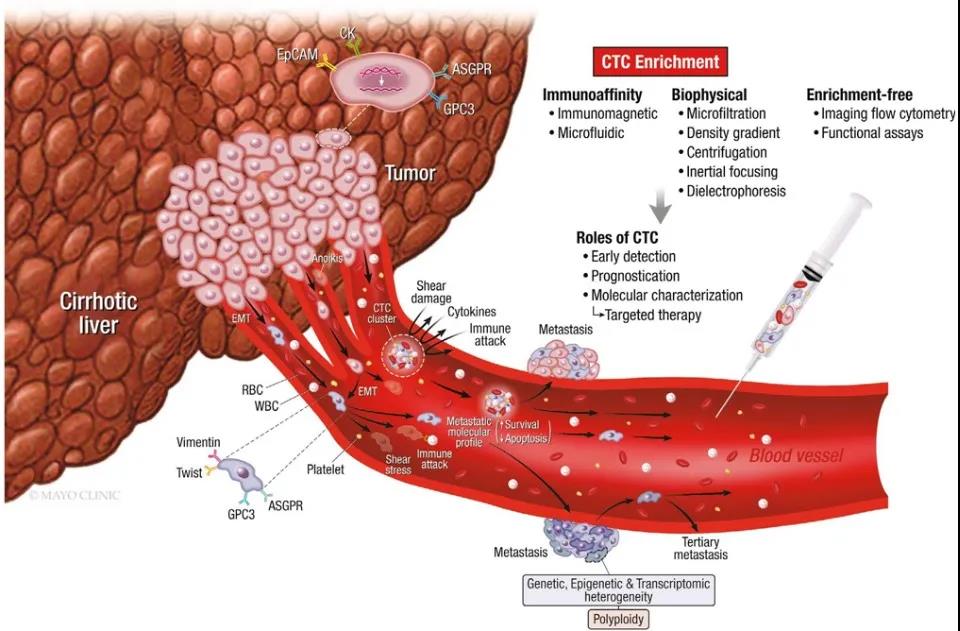
图1 HCC中的循环肿瘤细胞
液体活检的另一个基石ctDNA,是无细胞DNA(cfDNA)的一部分,它起源于濒死的肿瘤细胞或已经吞噬肿瘤细胞的巨噬细胞。ctDNA已经用于治疗反应监测或早期发现复发,并确定特定的突变来做出治疗决策。但目前还不清楚ctDNA是否准确地代表了活跃增殖和转移的肿瘤细胞的基因组成, ctDNA可能不成比例地代表了来自“较弱”肿瘤细胞的DNA,这些细胞更容易死亡,并将其内容物释放到循环中。与ctDNA相比,CTCs的主要优势是捕获了完整的、有活力的肿瘤细胞。
CTCs在HCC诊断,预后的治疗监测中的应用
常用的基于免疫亲和的CTCs富集方式在HCC CTCs富集中被广泛应用,如以EpCAM为单一标记物的CellSearch捕获系统以及以多种复合标记物CTC捕获系统(例如NanoVelcro CTC Assay,标记物:EpCAM, ASGPR, and GPC3)已被广泛应用于HCC患者CTCs的捕获。既往多项研究显示CTCs的定量丰度,以及CTCs间的生物学特征和基因组异质性,可以预测HCC患者的疾病预后和对治疗的反应(详细数据见参考文献1表2)。
2020年8月加州大学洛杉矶分校发表的一项研究显示HCC CTC中PD-L1表达或与预后及免疫检查点抑制剂的应答相关
该研究利用NanoVelcro CTC Assay平台捕获富集CTCs,检测表达PD-L1的HCC-CTCs,并研究其作为预后和预测生物标志物的作用。对87例HCC患者(49例早期、22例局部晚期和16例转移性)、7例肝硬化患者和8例健康对照的前瞻性队列进行CTCs计数/表型分析,检测表达PD-L1的HCC-CTCs,并研究其作为预后和预测生物标志物的作用。
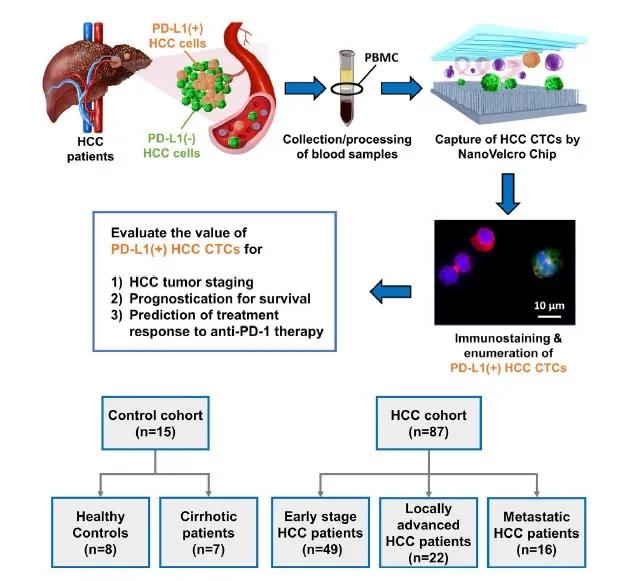
图2 总体研究设计和HCC患者入组对照患者概述
CTC生物学特性和临床意义概研究结果述
2015年4月至2017年11月期间,前瞻性的纳入组102例受试者。8例受试者为健康对照,7例受试者患有肝硬化但无HCC,87例受试者患有HCC(49例早期HCC,22例局部晚期HCC和16例转移性HCC)。
87例HCC患者中有84例(96.6%)检测到CK + CTCs(中位数 = 6,IQR = 3-10,范围 = 0-27)。中位CK + CTCs计数与更晚的疾病分期相关(早期 vs. 局晚期和转移性, P < 0.001)。PD-L1 + CTCs主要在局部晚期和转移性HCC患者中观察到,并准确区分早期和晚期/转移性疾病,AUROC为0.807。*P < 0.001。87例HCC患者中31例(35.6%)检测到PD-L1 + CTCs。在49例早期HCC患者中的4例(8.2%)、22例局部晚期患者中的12例(54.5%)和16例转移性患者中的15例(93.8%)中检出了PD-L1 + CTCs。在任何健康对照或肝硬化患者中均未发现PD-L1 + CTCs。PD-L1 + CTCs的存在准确区分了早期HCC患者与局部晚期或转移性HCC患者,敏感性71.1%,特异性91.8%,AUROC为0.807(95%可信区间[CI]= 0.707-0.907,P < 0.001)。
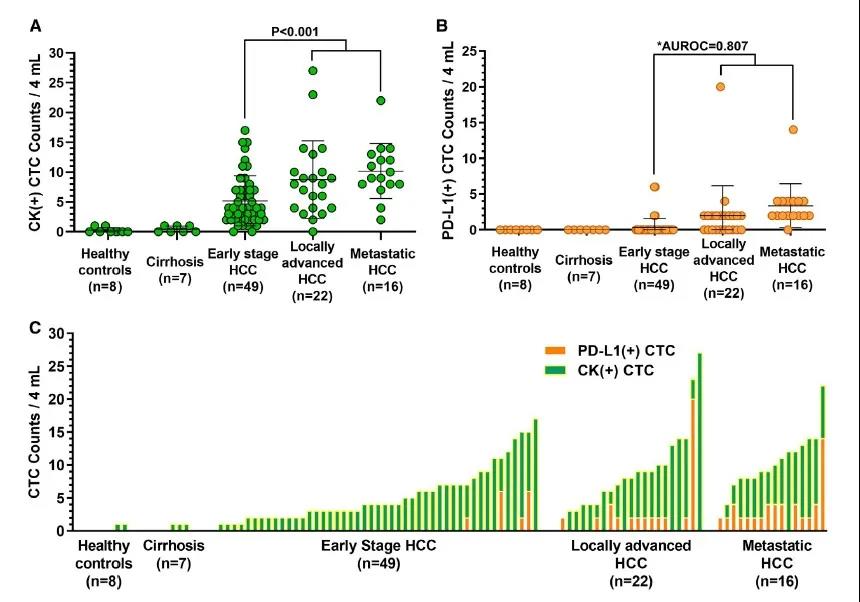
图3入组患者每4 mL静脉血中标准
CK + CTCs(A)和PD-L1 + CTCs(B)的CTCs计数
利用P-spline plot,确定了最佳CK + CTC cutoff值为7,OS有明显差异(4A)。HCC患者有超过7个CK + CTCs(中位OS = 29个月,12个月KaplanMeier生存率 = 62%),与有7个或更少CTCs的患者(未达到中位OS,12个月Kaplan-Meier生存率 = 84%,P = 0.006)相比,生存率显著更低(图4A)。
在研究期间,31例PD-L1 + CTCs患者中有17例(54.8%)死亡,56例无PD-L1 + CTCs患者中有11例(19.6%)死亡。PD-L1 + CTCs患者的OS显著差于无PD-L1 + CTCs患者(中位OS = 14.0个月vs.未达到中位OS;HR = 4.0,95%CI = 1.8-9.2,P = 0.001(图4B)。在多变量Cox回归分析中,存在4个或更多PD-L1 + CTCs仍然是OS的独立预测因素(HR = 3.22,95%CI = 1.33-7.79,P = 0.010)(详细信息见参考文献2表3)。
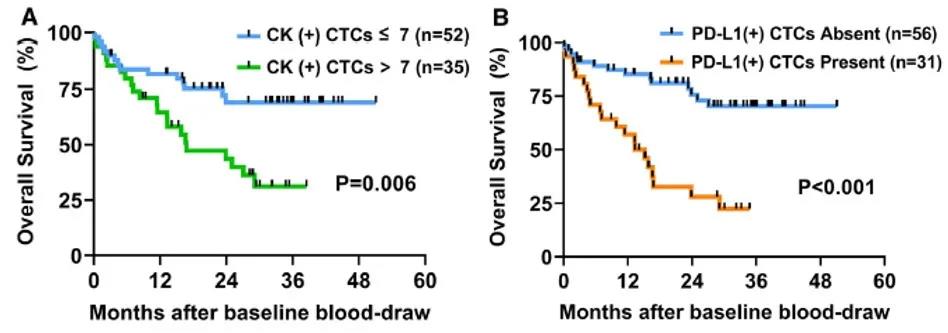
图4 CK + CTCs(A)和PD-L1 + CTCs(B)
HCC患者的OS分析
在接受抗PD-1治疗的10例患者亚组中,PD-L1 + CTC状态与疗程之间的关联如图5所示。9例患者接受nivolumab治疗,1例患者接受pembroilzumab治疗。5例患者对抗PD-1治疗产生应答(平均治疗持续时间为588天),而其余5例患者治疗失败(平均治疗持续时间为106天)。在接受免疫治疗的10例患者中,6例患者在基线时存在PD-L1 + CTCs,其中5例治疗有效;其余1例PD-L1 + CTCs患者治疗失败。相反,所有4例未出现PD-L1 + CTCs的患者均为无应答者,至死亡的中位时间为10.4个月。所有无应答者均在开始治疗后4个月内进展,除1例(H222)外,所有患者均在15个月内死亡。
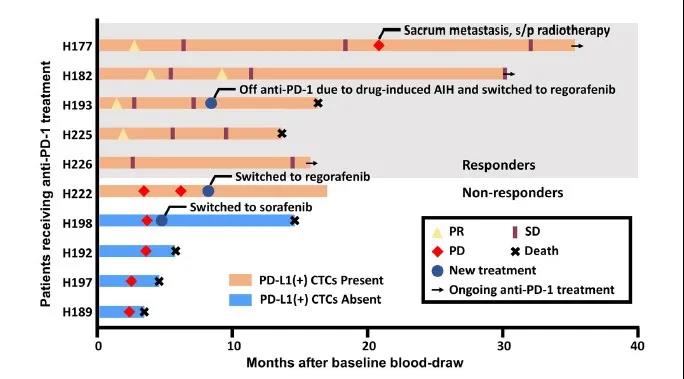
图5 接受PD-1抑制剂HCC患者游泳图
该研究报道了一种CTCs检测方法,用于表达PD-L1的HCC CTCs的表型分析。PD-L1 + CTCs主要见于晚期HCC,在控制了终末期肝病模型、甲胎蛋白和肿瘤分期后,可独立预测OS。在接受抗PD-1治疗的HCC患者中,PD-L1 + CTCs的存在与有利的治疗缓解之间存在强相关性。
数十年的研究使CTCs在HCC患者中的临床效用取得了显著进展。CTCs作为液体活检的一种形式,在促进HCC患者实施精准医疗方面具有巨大潜力。CTCs已经获得FDA批准,用于转移性乳腺癌和结直肠癌患者的疾病监测和预后判断,目前正在进行一项美国国立卫生研究院申办的临床试验(NCT02973204),旨在研究CTCs和ctDNA作为HCC的临床支持工具。在CTCs被广泛用于HCC的临床之前,仍然存在重大挑战。除了CTC检测和分离的技术挑战外,还有众多的CTC检测方法,每种方法都有自己的样本制备、富集和分析的方案。需要有一个灵敏度高、特异性强的标准化检测方案,通过统一的CTC检测平台及更大样本量的多中心、前瞻性研究来实现,这可以为研究结果提供有效的验证。
来源:锐医同行

查看更多