查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





据世界卫生组织国际癌症研究机构发布的2020年最新全球癌症负担数据显示:2020年全球胃癌新发病例数108.9万,死亡病例数76.8万,其中中国胃癌新发病例47.8万(占43.9%),胃癌死亡病例37.3万(占48.5%)。中国用占世界1/5的人口“承包”了近1/2的胃癌新增病例数和死亡病例数。

随着基因测序技术的发展,胃癌的精准治疗时代已经到来,可以借助分子分型进行胃癌的诊疗。现阶段HER2阳性、微卫星不稳定(MSI)、PD-L1表达三种分子标志物已经被用来指导临床用药。
今天,我们就来聊一聊胃/胃食管结合部癌(下文简称“胃癌”)靶向治疗的研究进展与未来研究的发展方向。
一、分子分型
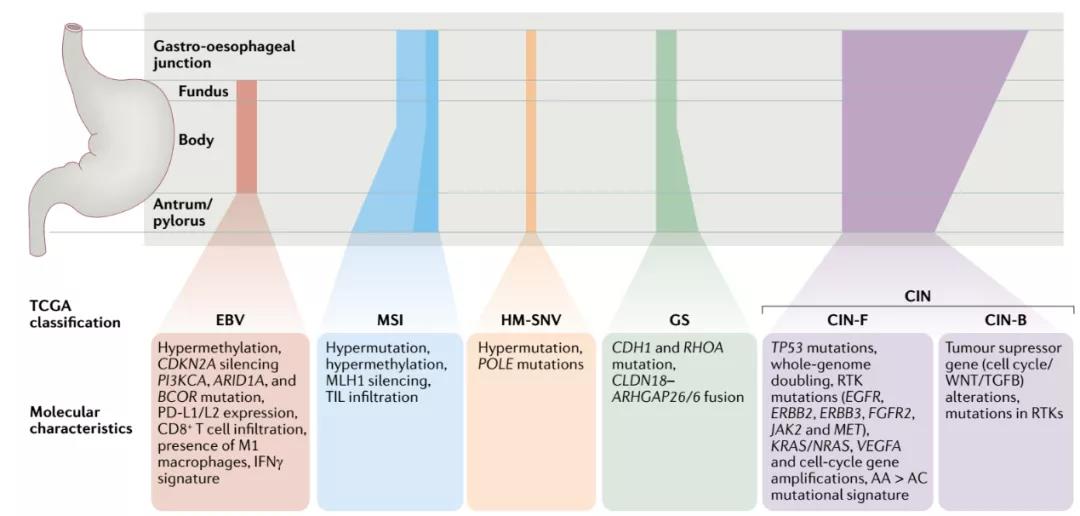
图1 TCGA胃癌亚型分子特征
TCGA研究根据聚类结果将原发性胃癌分成4个亚型,分别EB病毒感染(EBV)、MSI、染色体不稳定(CIN)及基因组稳定(GS)。
EBV型胃癌常见于胃底与胃体,组织学表现为高度免疫细胞浸润并伴随PD-L1和PD-L2高表达。分子层面除了CpG岛甲基化特征外,常含有PIK3CA, ARID1A, BCOR突变。
MSI型胃癌由于DNA错配修复(MMR)相关蛋白存在突变或被抑制表达,所以出现MSI表型,近15% MSI-H胃癌与林奇综合征相关。组织内有大量淋巴细胞浸润,并高表达PD-L1等免疫检查点蛋白。
CIN型胃癌染色体非整倍性,占胃癌亚型约50%。该亚型常伴有TP53突变,酪氨酸激酶受体基因(EGFR, ERBB2 FGFR2等)扩增,KRAS, NRAS, VEGFA等基因变异。
除以上3种亚型外无明显特征的胃癌被归为GS型胃癌。四种亚型中GS型胃癌预后最差,而EBV型预后最好。
二、生物标志物
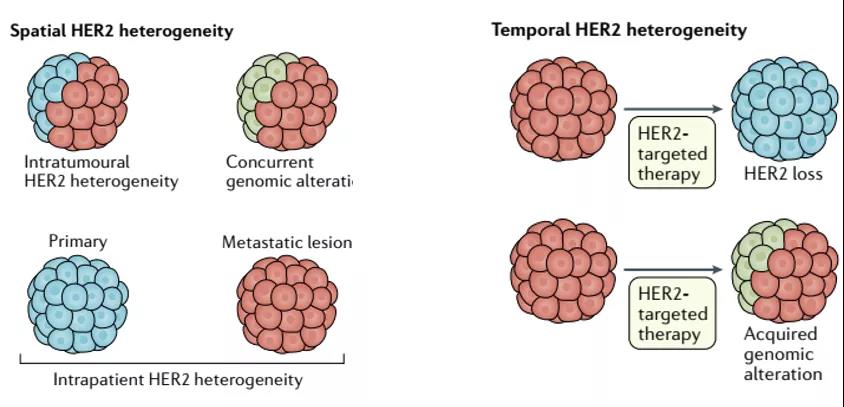
图2 HER2表达的时空异质性
胃部肿瘤内存在高度的基因型及表型异质性,常被认为是导致其针对生物标志物疗法失败的原因。
例如,针对HER2的靶向疗法,可能会清除表达HER2的肿瘤细胞,但无法抑制HER2阴性细胞的增殖。在约30%的HER2阳性患者中,接受含曲妥单抗治疗时会产生这种现象。
因此,需要有新的药剂和方法去克服HER2表达的异质性。在其他的靶向疗法中也存在类似的耐药性机制,如针对EGFR扩增、FGFR2融合、MET扩增的疗法。ctDNA分析也正在被整合到靶向治疗临床试验中,用于重新入组那些肿瘤组织活检生物标志物阴性的患者。
三、靶向治疗
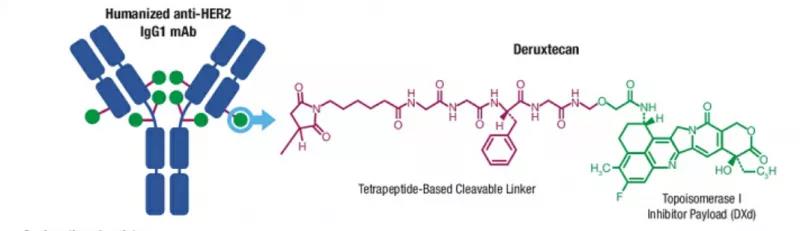
图3 T-DXd结构示意图
HER2靶向治疗
HER2在15%~25%的胃癌人群中高表达。经过临床实践,HER2阳性定义为IHC2+/FISH阳性(ERBB2: CRP17比例≥2.0)或IHC3+(>30%肿瘤细胞阳性)。
曲妥单抗联合化疗现在是HER2阳性胃癌患者的标准一线治疗方法。其他靶向HER2的临床试验也在逐步开展,如拉帕替尼与卡培他滨和奥沙利铂联合作为一线治疗;帕妥珠单抗和曲妥单抗联合5-Fu和顺铂作为一线治疗;拉帕替尼联合紫杉醇作为二线治疗等。
新的HER2靶向药物试图克服固有的和后天的耐药性。其中一种方法是开发曲妥珠单抗-伊立替康类化疗药物的偶联药物(T-DXd),这是一种抗体-药物结合物(ADC),这种药物具有旁观者杀伤作用,因为释放的药物会影响周围的细胞,包括那些缺乏HER2表达的细胞,由此产生的细胞死亡可能会促进抗肿瘤免疫。
妥卡替尼,是小分子酪氨酸激酶抑制剂,与曲妥珠单抗联用靶向HER2不同位点,研究显示可以显著改善胃癌PDX模型,相关Ⅱ/Ⅲ期临床试验正在进行中。另一种新型试剂ZW25是一种基于Zymeworks的AzymetricTM 平台的双特异性抗体,其可以同时结合HER2的两个非重叠表位,称为双互补位结合,可以双重阻断HER2信号,具有更强的抗HER2驱动肿瘤生长的作用。
FGFR2靶向治疗
FGFR2扩增发生在约5%的胃癌中,并常见于CIN和GS亚型,通常预后不佳。靶向FGFR2扩增药物在陆续开发中。
泛FGFR TKI药物AZD4547在临床Ⅱ期试验中失败;Futibatinib在临床前研究中显示出对FGFR1-4的高选择性抑制并不可逆地抑制FGFR2,相关临床Ⅱ期试验正在开展中,用于测试在FGFR变异的肿瘤中的药物疗效。Bemarituzumab靶向FGFR2b剪切异构体,在Ⅰ期临床试验中28例FGFR2扩增患者中的5例对药物响应良好。
EGFR靶向治疗
约5%~10%的胃癌存在EGFR扩增或过表达,与较差的预后相关。大型随机临床试验未能证明在不经筛选的人群中EGFR靶向药物对患者的生存有明显的益处。EGFR扩增常伴随ERBB2, KRAS, NRAS, MYC和CCNE1的扩增及KRAS和GNAS的突变,这种伴随突变被认为是可能的耐药机制之一。为了克服对EGFR靶向治疗的耐药性,几种策略正在开发中,包括整合抗EGFR抗体和ADC。
MET靶向治疗
MET靶向治疗已经在MET阳性胃癌患者的大随机队列中进行了多次探索,但这些药物到目前为止都没有改善总生存(OS)期。MET第14号外显子跳跃被鉴定为一个有价值的标志物,可能会在将来的试验中指导分组。ctDNA分析发现MET D122bV/N/H和Y1230C突变是耐药产生的原因。
抗血管生成治疗
胃部肿瘤常分泌促血管生长因子,但临床研究表明在化疗中加入贝伐珠单抗作为一线治疗,与单纯化疗相比,未能证明OS期有明显改善。相比之下,抗VEGFR2抗体雷莫芦单抗在二线治疗中与紫杉醇联合治疗以及作为单一治疗显著改善OS期。在国内进行的一项随机Ⅲ期试验中,与安慰剂相比,选择性抑制VEGFR2的阿帕替尼也改善了先前接受过至少两种化疗的患者的OS期。但遗憾的是目前没有明确的预测疗效标志物,临床试验只能在不加区别的患者中进行。
PARP抑制剂
在7%~12%胃癌中,可以发现同源重组缺失(HRD)相关的特征,在3%的胃癌中可以发现HRD相关基因的胚系突变。然而,胃癌与HRD的临床相关性尚不清楚。在一项试验中,患者接受PARP抑制剂奥拉帕利联合紫杉醇,结果显示严重的杂合性缺失与OS期的延长有关,这意味着HRD或其他形式的基因组不稳定性可能作为生物标志物。
Claudin18.2靶向治疗
Claudin18.2是细胞间连接的组成成分,在胃癌、特别是弥散性胃癌中高表达。在GS亚型中存在高比例的CLDN18–ARHGAP26/6融合。Zolbetuximab靶向Claudin18.2治疗晚期胃癌患者,临床获益率达到23%。
Claudin18.2表达水平可以作为用药标志物。针对该靶点的临床试验在火热进行中。
ICIs
在一项临床试验中纳武利尤单抗在作为第三线或后一线治疗,与安慰剂相比,延长了患有胃癌的亚洲患者OS期。在一项全球Ⅱ期研究中,28例胃癌患者接受抗PD-1抗体帕博利珠单抗作为三线的治疗方案,客观缓解率(ORR)为11.6%,在PD-L1+患者中ORR为15.5%。MSI-H病患者预后较好、PD-L1表达高(CPS≥10)和TMB(≥10 mut/Mb)的趋势表明,这些生物标记物可以用于选择可能受益于ICI的患者。
四、生物标志物实验匹配
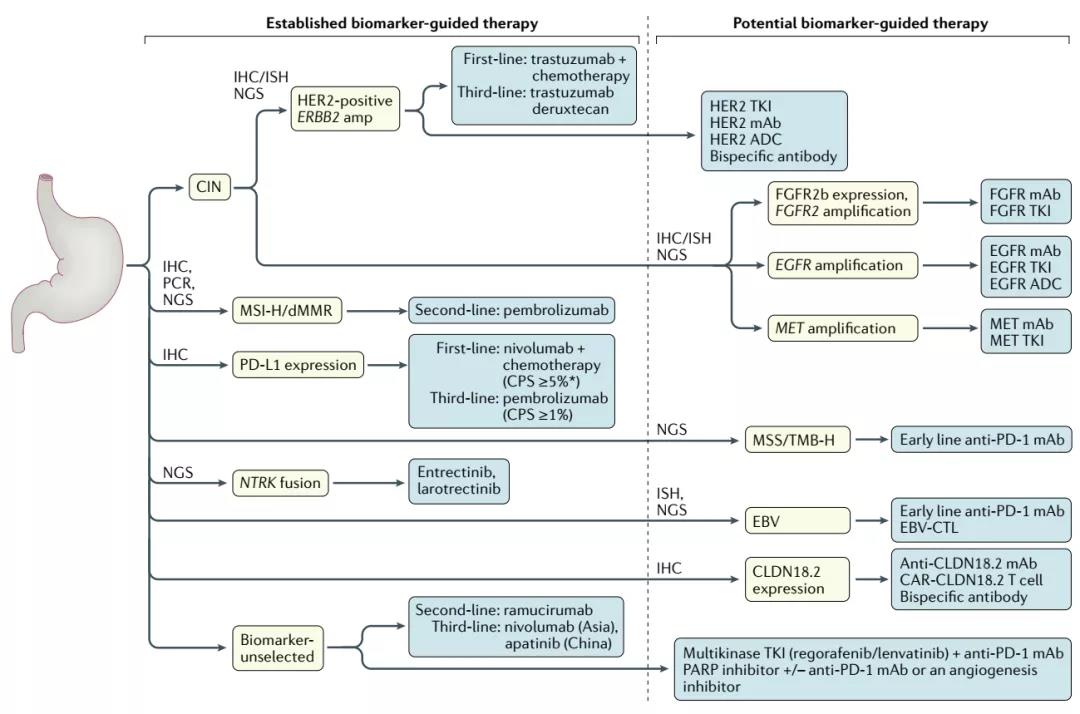
图4 基于生物标志物的靶向治疗
高通量测序技术的可用性和相应靶向治疗的发展,改变了胃癌患者的分子分层。基于生物标志物检测,患者可以更有针对性的接受最适合的靶向治疗与试验入组。
在一线治疗之前,应进行特定的分子检测,如HER2或PD-L1的IHC和基于PCR的MSI检测,以选择可能受益于HER2靶向治疗或ICI的患者。
多项研究证明,ctDNA测序是有用的,不仅有助于在一线治疗前确定可用药靶标变异,而且可以作为描述克隆进化和耐药机制的方法,包括疾病进展后的肿瘤异质性改变。
应用多模式分子分析还可以为新型生物标志物指导的治疗策略提供理论基础;并且提高我们对其他非直接靶向生物标志物的理解,使这些标志物与治疗效果或耐药性关联。
求臻医学 平台发布
查看更多