查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





前言:
PD-L1高表达是患者较为适合免疫治疗的金标准。在keynote024研究中,帕博利珠单抗单药治疗PD-L1≥50%的晚期非小细胞肺癌患者,5年的OS率高达29.6%!创造了非靶向肺癌人群的新高生存记录。
但最近的部分研究提示,PD-L1高表达并不是一把“万能钥匙”,部分PD-L1高表达的患者对PD1/PDL1免疫治疗并不起效,甚至部分还会发生“超进展”!让人大为意外!这是什么原因呢?下面展示的案例就是一位PD-L1100%表达的患者在使用免疫治疗后迅速出现超进展!一起解读一下!

案例展示
1.先患甲状腺癌,再患肺癌,位置原发不明!
一名66岁的非裔美国女性,有25年的吸烟史、2型糖尿病和原发性血小板增多症,最初表现为右锁骨上淋巴结肿大。该患者几年前患过甲状腺乳头状癌,接受了甲状腺全切除术,随后接受了放射性碘消融术治疗后痊愈。当时的病理是右侧锁骨上颈部肿块活检最初报告为低分化乳头状癌,伴有间变性改变。但此次病理提示为肺腺癌。免疫组织化学(IHC)染色显示TTF-1的强弥漫性核性反应和CK7的强细胞质染色,甲状腺球蛋白和CK20为阴性。全身PET-CT显示纵隔淋巴结肿大,但没有原发性肺部病变。支气管内超声引导细针淋巴结活检提示肺源性低分化腺癌,IHC染色下TTF-1和Napsin-A呈阳性,甲状腺球蛋白和PAX-8呈阴性。检测患者的EGFR、ALK或ROS1突变显示,没有基因突变或重排。最终患者诊断为一侧不明的IIIB肺腺癌。
2.同步放化疗,达到安全缓解,维持13个月不复发!
确诊后,由于病灶局限,患者接受了胸部和右颈部肿块的同步放化疗,并接受了两个周期的卡铂和紫杉醇辅助化疗。该治疗耐受性良好,并且肿瘤全消。这种状态维持了13个月未复发。
3.复发伴脑转移,具有多种不明意义突变,且PD-L1100%表达!
在13个月后,胸部、腹部和骨盆CT复查显示患者隆突下和肺门淋巴结病肿大。PET-CT显示高代谢。支气管镜下4L淋巴结针吸活检证实为复发性肺腺癌。通过二代测序对活检组织进行的分子测试(NGS)报告提示患者出现了3种突变(ERBB3 H292Y突变、STK11 A218Lfs* 69突变、TP53 R283P突变,AKT1、MYC、NTRK1的扩增以及5种未知意义的变体ATM P604S, ATM R832C、BRCA2 S2835P、 CDKN2B D86N和MLH1 R487Q。此外,PD-L1 (22C3)在测试呈现高表达,肿瘤比例评分为100%,强度为3+。
4.行脑部放疗,并全身使用免疫治疗,2周期用药后迅速超进展!
脑核磁发现5毫米增强的左岛叶病变,周围有血管源性水肿,可能有转移。患者接受了左侧岛叶病变的1次立体定向放射外科手术(SRS),总放射剂量为20 Gy。此次,患者的疾病分期转化为IV期,被诊断为IVB TxN3M1c期,肺腺癌。
完成脑部SRS后,患者开始每3周使用标准剂量免疫治疗。在第一周期治疗后,产生了轻度腹泻和关节僵硬等微小的副反应。在使用第二个周期后出现恶心和疲劳,但用药2周后患者因呼吸急促而入院。胸部CT和超声心动图显示大量心包积液和大量右侧胸腔积液。
进行了紧急心包穿刺术和胸腔穿刺术引流术排出积液,对胸腔积液进行细胞学检查显示为恶性肿瘤,与低分化癌一致。心包液被送往基础医学,PD-L1 (22C3)检测报告为阴性结果,肿瘤比例评分为0%,但剩余样本不足以进行额外的DNA检测。胸部肿瘤委员会审查了该患者的病例,并同意因HPD(超进展)原因应停用免疫治疗。
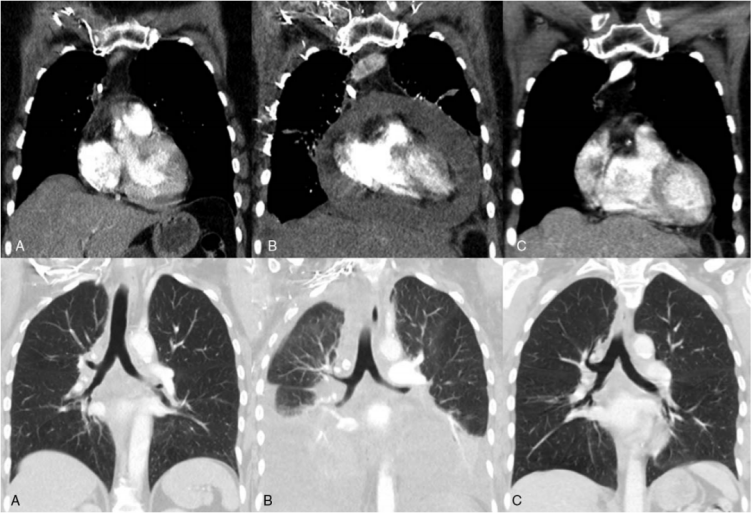
A 使用免疫治疗前;B使用免疫治疗后超进展;C改为化疗后控制
5.改为化疗后,病情控制,并维持长期稳定!
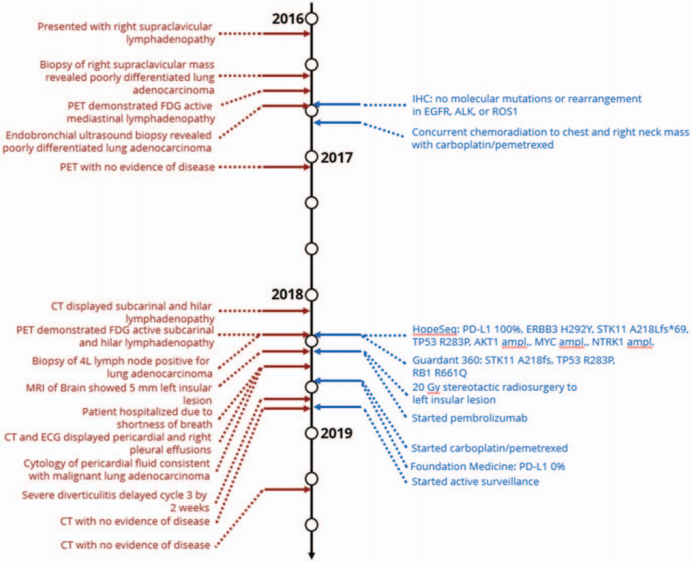
患者更改治疗为卡铂(AUC 5)和培美曲塞(500 mg/m2)每3周一次。2周期治疗后患者出现了严重憩室炎,接受了环丙沙星和甲硝唑的抗生素治疗,第三个周期化疗因此延迟了2周。在第三周期化疗后患者停止了治疗,后定期复查;患者维持无病状态长达20个月。下图为患者的整个治疗史。
讨 论
患者PD-L1全阳表达,但在免疫用药的第5周发展为超进展。在2个新的转移部位观察到超进展现象,出现大量心包和胸腔积液。分析“反常”表现的背后原因,作者指出两点:
(1)PD-L1表达的丢失是免疫治疗耐药的原因。
本例患者最大的特点就是PD-L1在免疫用药前后的表达变化。从初始的表达100%,到超进展后重测PD-L1表达0%。出现了一个完全逆转的PD-L1表达丢失。这种在免疫治疗过程中PD-L1表达丢失的现象并不少见。在一项对3例患者的事后分析中显示,3名非小细胞肺癌患者在接受免疫治疗后出现PD-L1表达的下降甚至丧失。一例PD-L1表达从75.6%下降到13.2%、一例从100%下降到58.8%。第三名患者的PD-L1表达从98%降至< 1%。PD-L1表达的丧失可能是用免疫抑制剂治疗的非小细胞肺癌和其他癌症,对免疫疗法产生耐药性的机制之一。甚至或许PD-L1消失的速度可以作为HPD的一个指标。在HPD和免疫治疗失败的病例中,需要进一步研究PD-L1丢失的机制。
(2)STK11可能与患者超进展相关!
该患者NGS和液体肿瘤活检均显示STK11和TP53突变。与其他STK11突变相比,STK11 / TP53共突变,与STK11其他共突变相比,具有更长的OS。最近,一项研究证明在非小细胞肺癌中STK11和超进展之间的联系,其中(3/ 16) HPD患者发生STK11突变,而(0/28)没有HPD。虽然这3例患者有KRAS突变肿瘤,但另一项研究报告显示,STK11突变肿瘤相对于非STK11突变的患者,对免疫的疗效明显减低(0% (0/11) vs. 34.5% (19/55)),且中位PFS (1.7 vs. 19.3个月)和OS (11.1 vs. 26.5个月)更短。
在一项更大的队列研究中,377例转移性非小细胞肺癌患者接受了免疫治疗、含铂双重化疗(卡铂或顺铂)和培美曲塞治疗,102名STK11基因改变的患者具有更低的ORR (32.6% vs. 44.7%)、明显较短的mPFS (4.8 vs. 7.2个月)和mOS (10.6 vs. 16.7个月)。STK11和KEAP1共突变发生在约13%的肺癌中,肿瘤突变负荷中位数高于整体均位水平(9.4 vs. 6.1),但是在接受PD1/PDL1免疫治疗时,PFS和OS降低。
可以说,STK11突变患者代表了晚期肺癌中一类亟须新治疗策略的患者亚型。持续的STK11突变与患者发生超进展也是非常有相关性的。
除了分析患者为什么“反常”出现超进展外,作者还提及一点,患者在免疫发生超进展后该换为化疗,在仅治疗3周期的情况下,疗效显著,并维持了长达20个月以上的无病状态,提示免疫后使用化疗,疗效佳!这在部分研究中也得出过相似的结论。可以开展更大型得到研究对免疫后挽救化疗的疗效进行验证和评定,便于我们更好地安排临床治疗顺序。
该案例给了我们很多“既定思维”下的“突破”,提示我们在免疫治疗中仍需不断总结,细致分析,减少每一位患者的治疗失误,积跬步而致长远,捍卫每一位患者的生命!
来源:找药宝典

查看更多