查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2025年7月10日,由北京大学肿瘤医院沈琳教授团队牵头在国际重磅期刊《自然医学》(Nature Medicine)在线发表的研究首次全面报道了我国首创EGFR×HER3双抗ADC(BL-B01D1)药物在Ib期研究中晚期食管鳞癌患者的有效性和安全性,对于食管鳞癌靶向治疗具有突破性意义。

2025年7月16日,沈琳教授带领国际团队在Nature Medicine在线发表CLDN18.2 ADC IBI343治疗晚期胃或胃食管交界处腺癌(G/GEJ AC)国际多中心I期临床研究数据。此次数据发表标志着中国研究者带领国际多中心团队在抗肿瘤新药研发的取得了又一重大成就。基于该数据,IBI343已于2024年启动一项国际多中心临床III期研究(G-HOPE-001,NCT06238843),有望为晚期G/GEJ AC治疗带来高效低毒的新选择。

研究1
研究设计
本研究是一项全国多中心、开放标签、Ib期研究。研究人群是标准治疗失败的晚期食管鳞癌。设立了2.0 mg/kg和2.5 mg/kg共2个剂量组,分别在D1和D8给药,每3周为一个治疗周期。研究的主要终点是2期推荐剂量(RP2D),次要终点包括安全性、有效性、药代动力学和抗药抗体。探索性终点包括生存数据和疗效标志物探索。
研究结果
从2022年12月12日至2023年12月4日,共纳入82例晚期食管鳞癌患者接受BL-B01D1治疗,其中2.0 mg/kg组22例,2.5 mg/kg组60例。62.2%患者既往接受过2线及以上治疗,95.1%患者对于既往免疫治疗已耐药。数据截至2024年9月30日,仍有11例患者在组继续用药。
安全性方面,在2.5 mg/kg组,最常见的不良反应包括贫血(85.0%)、血小板减少(58.3%)、白细胞减少(56.7%)以及中性粒细胞减少和恶心(均为46.7%)。在≥3级TRAE中,最常见的是贫血(28.3%),其次是白细胞减少和血小板减少(均为18.3%)和中性粒细胞减少(16.7%)。在2.0 mg/kg组,最常见的不良反应为贫血(86.4%)、白细胞减少和乏力(均为45.5%)、血小板减少(40.9%)以及中性粒细胞减少和恶心(均为31.8%)。在≥3 级TRAE中,最常见的是贫血(27.3%)、淋巴细胞计数减少(13.6%)以及白细胞减少和中性粒细胞减少(均为9.1%)。
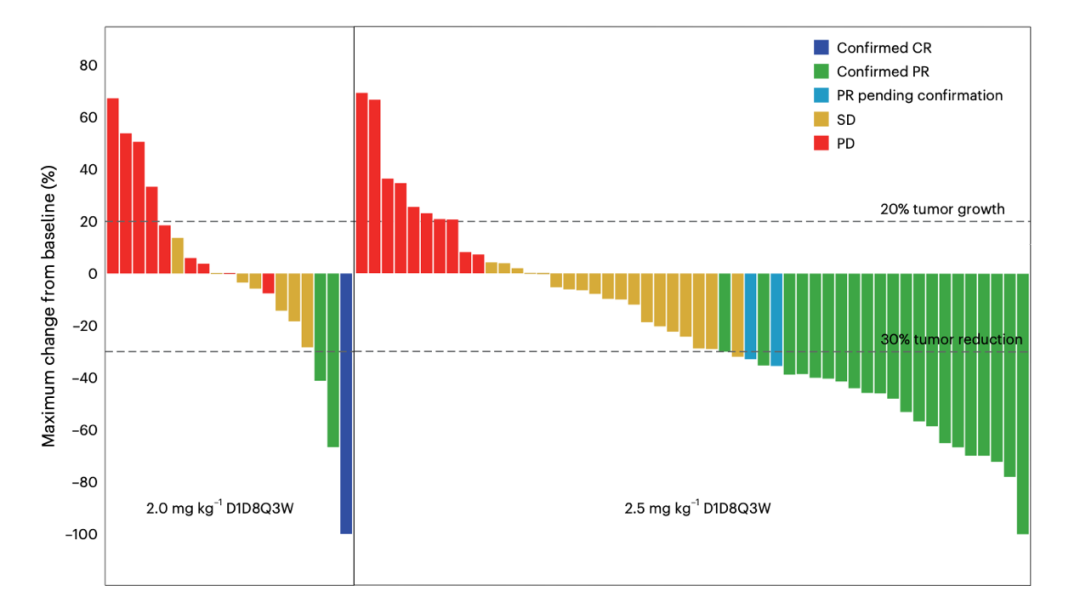
疗效方面,共73例患者具有可评估疗效,整体ORR 32.9%。2.5 mg/kg剂量组和2.0 mg/kg剂量组的疗效对比,ORR 39.6%对15.0%,DCR 79.2%对50.0%,中位PFS期 5.4个月对2.7个月,中位OS期 11.5个月对5.6个月。
综合比较2.5 mg/kg和2.0 mg/kg,两剂量组不良反应均可控,但2.5 mg/kg疗效相对更优。因此最终选择2.5 mg/kg D1D8 q3w作为食管鳞癌患者的RP2D。
研究结论
BL-B01D1在晚期食管鳞癌患者,尤其是既往免疫治疗失败的患者中表现出可控的安全性和令人鼓舞的抗肿瘤活性,实现了晚期食管癌鳞癌靶向治疗新突破。目前由沈琳教授牵头的BL-B01D1在晚期食管鳞癌二线的3期随机对照研究BL-B01D1-305研究(NCT06304974)正在全国多中心进行广泛开展,我们期待更进一步的循证医学结果,为更多晚期食管鳞癌患者带来福音。
研究2
本研究是一项国际多中心Ⅰ期临床研究(NCT05458219),旨在评估IBI343在晚期实体瘤患者中的安全性、耐受性和初步疗效。
研究共纳入116例晚期2线及以上治疗失败的G/GEJ AC受试者(8例为剂量递增阶段,108例为剂量扩展阶段)。研究分析了6 mg/kg、8 mg/kg两个剂量组CLDN18.2高表达(定义为≥75%肿瘤细胞中CLDN18.2染色强度≥2+)可评估受试者的疗效数据。
6 mg/kg剂量组
6 mg/kg剂量组(31例)中,15例患者达到部分缓解 (PR),确认的客观缓解率(cORR)为32.3%(95%CI:16.7~51.4),DCR为90.3%(95%CI:74.2~98.0)。中位随访时间为10.6个月,中位PFS期为5.5个月,OS期数据尚未成熟,预期的中位OS期已超过10.8个月(95%CI:6.8~NC)。
8 mg/kg剂量组
在8 mg/kg剂量组(17例)中,cORR为47.1%(95%CI:23.0~72.2),DCR为88.2%(95%CI:63.6~98.5)。中位PFS期为6.8个月(95%CI:2.8~7.5),中位OS期未达到。
安全方面
所有受试者中(116例,含8例剂量递增阶段受试者),66.4%(77/116)受试者发生≥3 级治疗期间不良事件(TEAE)。最常见的≥3级TEAEs是中性粒细胞计数降低(28.4%)、白细胞计数降低(25.9%)和贫血(16.4%)。≥3级胃肠道不良事件极少,其中≥3级恶心发生率仅1.7%。未报告任意级别的间质性肺疾病。治疗相关的毒性在充分的支持治疗中可得到缓解,患者整体耐受良好。
综合药代动力学、暴露-反应、安全性和疗效数据,研究最终确定IBI343的推荐剂量为6 mg/kg,为国际多中心III期研究提供了支持,IBI343高效低毒精准治疗有望在未来成为晚期胃癌患者的治疗新选择。
之前,沈琳教授在接受中国医学论坛报采访时曾表示“近年来,北肿消化团队紧密围绕临床实际需求,系统性地构建了标准化的临床研究体系。包括建立高质量的临床队列、完善数据库、制定规范化治疗方案、发展更贴近临床实际的拟人化肿瘤模型库等。相较于既往基于长期传代细胞系的研究模型(其与真实人体疾病特征存在较大差异),这一新体系的构建是团队共同努力的成果,旨在为药物研发和治疗策略探索提供更可靠、更具临床转化价值的平台。目前,团队凝聚了从60后到00后的几代科研与临床工作者,通过不懈的积累,已初步形成了涵盖基础研究到临床应用的完整研究链条。”我们相信,基于前期的系统部署与不懈努力,团队已迎来研究收获的重要阶段。
综合整理自北京大学肿瘤医院临床试验机构、北大医学科研、中国医学论坛报、肿瘤界
查看更多