查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





亲爱的读者朋友,您的意见对我们非常重要!为了更好地了解您的需求,提升文章内容质量,诚邀您花几分钟参与本次有奖问卷调研。参与者有机会获得精美奖品!

上期回顾

消化道困难内镜黏膜下剥离术(ESD)通常指病变位置特殊、解剖结构复杂、病变范围大或伴有瘢痕/浸润等因素导致操作难度显著增加的病例。这类手术对术者的技术、经验及团队配合要求极高,需要结合病变特点制定个性化策略。
以下是针对困难ESD的操作经验、技巧及应对策略:
(1)口腔、喉咽部
人体口腔咽喉示意图展示了从口腔到咽喉的解剖结构,主要包括口腔区(唇、齿、舌、硬腭、软腭、悬雍垂等)和咽喉区(鼻咽、口咽、喉咽、会厌、声带、食道及气管入口),各结构协同完成呼吸、吞咽、发音等功能。
口腔及咽喉部解剖结构复杂,操作空间狭窄小,内镜下治疗往往需要特殊器械及较精湛的内镜技术。
口腔及咽喉部的解剖特殊性是操作难点的核心,术前需重点评估:
① 空间限制:口腔(舌、颊黏膜、牙龈)、口咽(软腭、扁桃体、咽后壁)、喉咽(会厌、梨状窝)及喉部(声带、室带)空间狭小,内镜操作角度受限,视野暴露困难。
② 毗邻结构风险:舌部靠近舌动脉、舌下神经;咽喉部紧邻颈内动脉、喉返神经、气道(气管入口),剥离过深可能导致大出血、声音嘶哑或气道梗阻。
③ 黏膜特性:口腔黏膜角化层较厚,咽喉部黏膜薄且血供丰富,易出血;声带黏膜下组织菲薄,过度剥离可能影响发声功能。
图1 口腔硬腭早期癌ESD
图2 下咽部及左侧劈裂早期癌ESD
(2)食管上段及颈段、食管环周病变
食管上段及颈段位于咽喉部下方,邻近气管、主动脉弓、甲状腺等重要结构,管腔直径较细(通常<2 cm),内镜操作时旋转、进退空间极小,器械易与管壁碰撞,增加黏膜损伤风险。颈椎生理弯曲导致内镜插入角度受限,尤其环周病变须360°剥离时,难以获得理想视野,易出现“盲区”。
颈段食管黏膜较薄,黏膜下组织疏松且血管丰富,剥离时易发生出血;同时,该区域黏膜与固有肌层粘连较紧密,分离时易损伤肌层,甚至导致穿孔。环周病变常累及食管全周,病变与正常组织界限模糊,剥离过程中易偏离黏膜下层,增加穿孔或残留风险。
食管环周早期癌ESD
(3)贲门及胃食管结合部(GEJ)
贲门是食管与胃的交界,其核心功能是通过下食管括约肌(LES)防止胃内容物反流。ESD 操作可能损伤 LES,导致术后胃食管反流病(GERD)发生率升高(约10%~20%)。此外,贲门区黏膜下血管丰富(如胃左动脉分支),剥离时易发生出血,且血管位置深,止血难度大。贲门区黏膜下层较薄,与固有肌层粘连紧密,剥离时易损伤肌层导致穿孔。同时,该区域淋巴管和神经分布密集,病变浸润深度的判断(如早期癌是否累及固有肌层)依赖内镜超声(EUS)等精准评估。贲门后方紧邻胰腺、脾脏,侧方有肝左叶和膈肌,术中穿孔可能引发纵隔感染或腹腔感染,需紧急外科干预。
胃底贲门早期癌ESD
(4)胃体小弯侧/胃角
胃体小弯侧紧邻胃左动脉分支,黏膜下血管网丰富,剥离时出血风险显著增加。胃角作为胃体与胃窦的交界,呈锐角结构,常规内镜难以接近病变,尤其在处理后壁或小弯侧病变时视野受限。日本学者提出双弯曲内镜技术(如 GIF-2TQ260M),通过第二弯曲部调整方向,可从切线方向暴露病变,显著改善操作视野。
胃角早期癌ESD
(5)十二指肠(尤其是球部及乳头周围)
肠壁菲薄:十二指肠肌层厚度仅 0.5~1mm(仅为胃壁1/3厚度),操作中易穿孔,穿孔风险极高。毗邻重要结构:与胰腺、胆总管、腹主动脉等紧密相邻,剥离时需避免损伤。空间狭窄:肠腔迂曲、蠕动频繁,内镜操控难度大。
十二指肠降段乳头对侧巨大早期癌ESD
(6)大肠肝曲、脾曲及回盲部
肠腔急弯、肠壁薄,镜头易顶压肠壁导致穿孔,回盲瓣附近病变暴露困难。
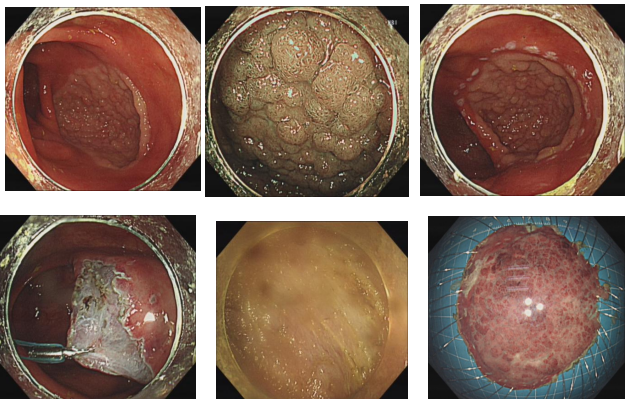
(1)巨大病变(直径>4 cm):
挑战:黏膜下注射范围广、剥离时间长,易出现水垫消散、层次模糊,完整切除率低。
横结肠中段近环周LST-G-H病变ESD
(2)瘢痕化病变(既往活检/电切术后)
挑战:黏膜下纤维化导致“抬举征”阴性,剥离层次不清,易损伤固有肌层。
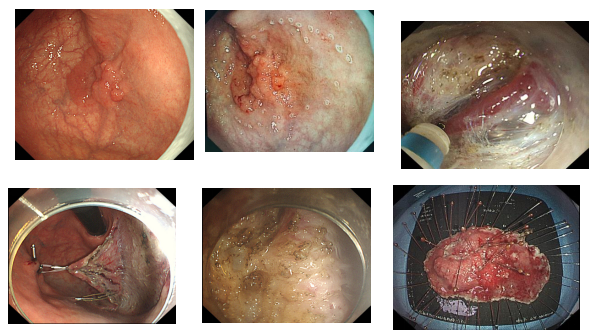
(3)复发或残留病变:
瘢痕组织粘连,正常黏膜与病变边界不清,剥离易遗漏。
直肠肛管带瘢痕LST-G-M病变ESD
(1)多模态内镜评估
① 高清白光+NBI/BLI:判断病变边界、表面微血管结构(如胃病变的MS 分型、食管的IPCL分型、大肠的JNET分型等);
② 超声内镜(EUS):明确病变浸润深度(如 SM 层浸润范围)、与固有肌层的关系,排除淋巴结转移;
③ CT/MRI:评估消化道外侵犯或淋巴结情况(尤其适用于怀疑浸润性癌的病例)。
(2)制定手术预案:
① 预估剥离难度,准备特殊器械(如带注水功能的刀具、OTSC夹);
② 规划剥离顺序(如先易后难、分块剥离),确定是否需要联合其他技术(如黏膜预切开、隧道法)。
(1)刀具选择
① IT刀系列(如 IT-2、IT-nano):适合瘢痕化病变的钝性分离,减少垂直损伤;
② Dual刀:细刀头(直径 0.4mm)适合精细切开(如十二指肠乳头周围);
③ Flush刀/爱尔博水刀/波科活水刀:边注水边剥离,维持水垫,减少热损伤(尤其适用于薄肠壁)。
(2)辅助工具
① 特殊透明帽:前端斜面型透明帽、锥形透明帽等便于推开皱襞,暴露剥离视野;
② 带槽活检钳:用于精准牵拉病变边缘,形成有效张力;
① 液体选择
② 注射策略
多点分层注射:先在病变边缘黏膜下层注射,再向中央补充,必要时在固有肌层表面注射(“双水垫法”);
标记联合注射:电凝标记点可同时作为注射点,减少重复进针损伤。
①预切开技术
对于边界不清的病变(如复发灶),可先在病变外正常黏膜做环形预切开,再向中央剥离;
十二指肠病变:采用“倒U形切开”(从口侧开始切开),避免镜头压迫肠壁。
②困难部位切开技巧
贲门倒镜切开:取左侧卧位,镜头贴近胃底,利用透明帽推开贲门黏膜,刀头与黏膜呈 15°~20° 角快速切开;
食管上段病变:使用前端带软头的透明帽,轻柔推送食管壁,避免暴力损伤。
① 层次判断
瘢痕区域:以黏膜肌层断裂处为标志,沿固有肌层表面钝性分离,避免进入肌层;
巨大病变:采用 “隧道法”(先切开一侧边缘,形成黏膜下隧道,逐步向对侧剥离),保持视野清晰。
② 张力管理
动态牵拉:助手用抓钳夹持病变边缘,随剥离进度同步提拉,避免过度牵拉导致黏膜撕裂;
重力辅助:通过调整患者体位(如左侧卧位→仰卧位→右侧卧位),利用病变重力自然展开剥离面。
① 预防性止血
剥离前对可见血管(如SM层粗大血管)先行电凝标记;
使用“非接触式电凝”(如氩气刀)处理创面渗血,减少热损伤范围。
② 穿孔紧急处理
小穿孔(<3 mm):立即用止血夹 “荷包缝合”,夹闭时从穿孔边缘正常组织开始,逐步向中心拉拢;
较大穿孔:使用OTSC夹或尼龙绳联合金属夹闭合,术后禁食+胃肠减压,必要时胸腔/腹腔引流。
(1)解剖预演
术前通过 CT/MRI 三维重建,明确病变与周围结构(如下咽梨状窝与喉返神经、口腔舌体与舌动脉)的关系,标注 “危险区”(如舌根部血管密集区、梨状窝尖部)。
(2)器械与体位的 “个性化选择”
① 内镜选择:咽喉部用治疗型胃镜(直径 9.8~11 mm) 或喉镜辅助内镜(前端可弯曲角度更大);口腔病变可用细径内镜(直径 5~6mm) 减少对舌体的压迫。
② 辅助工具:必备带吸引通道的切开刀(如Dual刀、Flush 刀),咽喉部空间小,需边操作边吸引分泌物 / 血液;口腔操作需配合开口器(如Davis开口器)暴露术野,避免牙齿遮挡。
③ 体位调整
下咽病变:患者取“头低脚高位(15°)”,利用重力使咽喉部黏膜舒展,扩大操作空间;
口腔病变(如颊黏膜):头偏向对侧,使病变区朝上,便于内镜垂直观察。
(1)食管上段、颈段病变的剥离策略
①体位调整:左侧卧位时气管插管气囊压迫食管右前壁,改为平卧位可使气囊移至气管前壁,减轻压迫。但需警惕气管插管移位风险。
②水压法与牵引技术:通过水射流功能分离黏膜下层,结合带线钛夹分次牵引,可打开剥离层面。但多次牵引可能增加费用,需权衡利弊。
③超细内镜与机器人辅助:超细胃镜(直径<6mm)可减少对狭窄管腔的刺激,尤其适用于食管入口及环周病变。机器人辅助系统(如达芬奇 SP)通过机械臂精准操作,改善狭窄空间的视野控制,已在部分中心尝试应用于颈段 ESD,但设备成本较高。
(2)环周病变的剥离策略
① 环周病变需完整剥离全周黏膜,但若一次性环形切开,易导致食管腔狭窄、黏膜缺血性坏死,增加穿孔风险。临床多采用 “分次剥离” 或 “螺旋式剥离”,但操作难度高,需精准控制剥离范围和深度。
② 病变累及食管上段时,靠近咽喉部,患者易出现恶心、呕吐等反应,影响操作稳定性;同时,内镜与器械的配合空间有限,难以完成精细动作(如止血、切开)。
(3)出血与穿孔的处理
① 食管上段血管丰富(如甲状腺下动脉分支),剥离时易发生出血,且视野暴露差,止血难度大(如电凝止血可能损伤深层组织)。
② 该区域食管壁较薄,一旦发生穿孔,由于邻近纵隔,感染易扩散,且缝合修补困难(位置深、操作空间小),可能需要中转外科手术。
(4)术后狭窄的预防
环周病变剥离后,食管黏膜缺损范围大,术后瘢痕形成易导致管腔狭窄,严重影响患者进食。尽管可采用球囊扩张、激素注射等预防措施,但食管上段狭窄的处理效果较差,复发率高。
(1)顺行与逆行结合:对于贲门环周病变,可采用 “顺行切开 + 逆向剥离” 策略。例如,先从口侧(食管侧)切开黏膜,利用重力使病变下垂,再反转内镜从胃侧剥离,改善视野。
(2)黏膜下注射技术:使用玻璃酸钠混合液(含靛胭脂)进行黏膜下注射,形成足够的抬举空间,减少肌层损伤风险。术中需多次补充注射,维持剥离平面清晰。
(3)出血的预防与控制
①浅层电凝剥离:采用高火电凝模式,贴近黏膜下层偏上位置剥离,避免深部分离损伤大血管。对于直径>2mm 的血管,需预防性钛夹夹闭或热活检钳烧灼。
②创面处理:术后对裸露血管 “零容忍”,可喷洒止血粉或使用生物胶覆盖创面,降低迟发性出血风险。
(1)锐角结构与视野暴露
胃角作为胃体与胃窦的交界,呈锐角弯曲,常规内镜难以垂直接近病变,尤其在处理后壁或小弯侧病变时视野受限。双弯曲内镜技术(如 GIF-2TQ260M)通过第二弯曲部调整方向,可从切线方向暴露病变3。此外,带线钛夹牵引(牙线连接钛夹牵拉病变边缘)能显著改善胃角小弯侧的操作空间,缩短手术时间并降低穿孔风险。
(2)黏膜下纤维化与溃疡瘢痕
胃角病变常合并溃疡瘢痕,黏膜下层纤维化严重,剥离平面难以建立。“内镜隧道式黏膜下剥离术(ESTD)”通过建立黏膜下隧道,沿瘢痕外侧切入,可减少肌层损伤并提高整块切除率。多中心研究证实,ESTD 在胃角巨大病变(>3cm)中的剥离速度是传统 ESD 的2倍,且穿孔率降低 50% 以上。
(3)血管密集与出血风险
胃体小弯侧紧邻胃左动脉分支,黏膜下血管网丰富。预防性止血策略包括:对直径>2 mm 的血管术前钛夹夹闭,剥离时使用海博刀(Hybrid刀)在黏膜下层偏上位置操作,减少血管损伤。术中出血发生率近 100%,但通过热活检钳电凝或止血粉喷洒可有效控制。
(1)精准评估:术前通过 EUS 明确病变浸润深度、范围及与周围组织关系,排除深层侵犯。
(2)创新牵引:采用圈套器镜外牵引、混合注射液(透明质酸钠 + 靛胭脂)抬举黏膜等技术,暴露剥离平面。
(3)精细剥离:使用可注水切开刀、CO2 注气等减少热损伤,预处理血管以降低出血风险。
(4)创面处理:钛夹封闭创面,术后口服抑酸药(如艾普拉唑)2 个月,预防迟发性出血及穿孔。
(5)操作要点
① 少注气,保持肠腔萎陷,减少肠壁张力;
② 乳头周围病变:先暴露乳头开口,用 Dual 刀 Nano 沿病变边缘 0.5 cm 处切开,剥离时避免损伤胆总管开口;
③ 术后常规放置鼻胆引流管(预防迟发性穿孔导致的胆汁性腹膜炎)。
(1)三者均存在管腔弯曲角度大(肝曲、脾曲呈 “锐角”)、操作空间受限、内镜稳定性差、毗邻重要结构(血管、脏器、瓣膜等)等问题,通用原则包括:优先选择治疗型肠镜(镜身更柔韧、抬钳器功能更灵活),配合可旋转切开刀(如 Dual 刀、IT-2 刀)或带水射流功能的器械(水刀辅助黏膜下分离);术中需持续保持清晰视野(高频冲洗 + 精准吸引),避免盲目切割;黏膜下注射需 “足量、分层”,优先使用高抬举性溶液(如生理盐水 + 甘油果糖 + 靛胭脂),确保病变与肌层充分分离(抬举征阳性)。
(2)结肠肝曲 ESD
肝曲位于右半结肠,连接升结肠与横结肠,内侧毗邻肝脏,管腔呈 “钝角” 弯曲,病变易累及弯曲顶点或两侧肠管。
注射点需覆盖病变全周,尤其弯曲顶点的黏膜下组织较薄,需重点注射(避免直接注射至肌层导致穿孔);
剥离顺序:优先从升结肠侧或横结肠侧的“直段”病变开始(易建立操作平面),逐步向弯曲顶点推进;剥离时保持内镜与病变 “共轴”(即内镜前端正对剥离面),通过旋转镜身 + 调整抬钳器,使切开刀始终与黏膜下平面平行(避免斜向切割肌层)。
风险防控:肝曲内侧肌层贴近肝脏,穿孔风险高:若发现肌层裸露,立即停止剥离,用止血夹预防性夹闭;横结肠侧病变可能累及肠系膜血管分支,剥离时遇粗血管(>1mm)需先电凝后切断,或用止血夹预处理。
(3)结肠脾曲 ESD
脾曲连接横结肠与降结肠,左侧毗邻脾脏及脾血管,管腔呈 “锐角” 弯曲(角度常 < 90°),且降结肠起始段较固定,操作空间更狭窄。黏膜下注射需重点强化脾曲内侧(靠近脾脏侧),因该区域黏膜下组织菲薄,易与肌层粘连;剥离方向:从降结肠侧(较直、易操作)向横结肠侧推进,剥离至弯曲顶点时,需将内镜前端 “嵌入” 弯曲处,通过抬钳器微调切开刀角度(避免刀头指向脾侧肌层)。
(4)回盲部剥离技巧
若病变位于盲肠壁(远离回盲瓣):从病变边缘向中心剥离,保持刀头与盲肠纵轴平行(盲肠肌层较薄,避免垂直切割);若病变累及回盲瓣:优先剥离盲肠侧病变,再处理瓣叶上的病变(剥离瓣叶时需 “浅层次” 切割,保留瓣膜肌层功能);靠近阑尾开口时,需要沿开口边缘 “弧形剥离”(开口处黏膜下与阑尾根部相连,避免直线切割导致开口撕裂)。
(1)复发性病变处理
① 黏膜下注射与标记
在瘢痕边缘正常黏膜处多点注射,形成 "液体垫" 以分离瘢痕与肌层。若注射后无明显抬举,可改用针状刀沿瘢痕边缘纵向切开,辅助分离。
标记范围需扩大至瘢痕外 5~10mm,确保完整切除潜在浸润病灶。
② 分层剥离策略
瘢痕浅层剥离:采用“啄切法”,每次切割深度控制在 0.5~1 mm,避免一次切入过深。遇到坚韧纤维条索时,可先电凝使其软化后再剥离。
瘢痕深层处理:贴近黏膜下层操作,利用电刀侧方接触瘢痕组织,通过短脉冲电流(功率 20-30W)逐层离断粘连。若肌层暴露,需立即凝固预防穿孔。
(1)粘连松解技巧:
①复发病灶常与前次手术瘢痕粘连,可先在瘢痕边缘正常黏膜下注射,形成“人工腔隙”后,用针状刀沿瘢痕 - 正常组织交界逐层分离。
②对于致密粘连,可采用“逆向剥离法”:从瘢痕远端正常黏膜开始,向瘢痕中心推进,减少张力导致的穿孔风险。
(2)减少热损伤
①重复 ESD 时,瘢痕区域对热更敏感。建议使用混合电流模式(切割+凝固),功率设置为切割 20W + 凝固 15W,避免过度碳化。
②采用 "非接触式凝固":电刀距离组织 1~2 mm 激发,利用热传导封闭微小血管,减少直接接触导致的穿孔。
(3)CO2 注气应用
全程使用 CO2 注气,可显著降低气腹压力,减少穿孔后张力性气胸风险。尤其在食管上段操作时,CO2 吸收快,能有效避免纵隔气肿。
(1)熟练掌握 “三手操作”(持镜、递刀、牵拉),尤其在倒镜或狭小空间中,需精准传递器械并保持视野;
(2)快速更换注射针或止血夹,缩短手术时间。
(1)持续监测血氧饱和度、心率、血压,警惕二氧化碳气腹导致的酸中毒(可通过负压吸引排空气体);
(2)十二指肠或胃底病变操作时,注意观察患者有无胸痛、皮下气肿(提示穿孔可能)。
若剥离过程中发现病变浸润深度超过 SM2、穿孔无法内镜下闭合,或出血难以控制,需果断终止手术,转为外科治疗。
利用离体猪食管/胃/肠进行困难部位模拟(如贲门倒镜剥离、十二指肠乳头切开),熟练掌握刀头方向与张力控制。
(1)初级:掌握胃体大弯侧平坦型病变;
(2)中级:挑战胃角、胃底及直肠病变;
(3)高级:专攻食管上段、十二指肠及瘢痕化病变。
术前与病理科、外科沟通,明确病变性质与切除边界;术后联合病理评估,制定后续治疗方案(如追加外科手术)。
记录每例困难 ESD 的操作时间、出血量、并发症及处理细节,分析可优化环节(如器械选择、剥离顺序)。
1.避免盲目追求完整切除:对于浸润性癌或抬举征阴性病变,需优先考虑患者安全,避免过度剥离导致严重并发症;
2.技术局限性认知:困难 ESD 的穿孔率可达 5%~10%,需与患者充分沟通风险,权衡内镜治疗与外科手术的获益。
通过精细化评估、个体化策略及精湛的操作技巧,困难 ESD 可在严格把控风险的前提下实现较高的切除成功率,为复杂消化道病变提供微创治疗选择。
POEM经验及操作技巧 | 中日携手・遵医领航⑪
作者:遵义医科大学附属医院 张华

查看更多