查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






美国芝加哥当地时间5月31日~6月4日,第55届美国临床肿瘤学会(ASCO®)隆重召开。本届年会的主题为“为患医治,以患为师(Caring for Every Patient, Learning from Every Patient)”,我们由此可以充分体会,全世界临床肿瘤学家对于患者的关爱之情及谦卑之心。
作为临床肿瘤学界最负盛名的国际学术交流平台,来自全世界共约32,000名肿瘤学家,汇聚于芝加哥麦考密克(McCormick)大厦,分享近一年来肿瘤学领域的最新进展,交流诊治经验。
本次年会上超过2400篇研究在会议现场进行报告,《中国医学论坛报》记者,一如既往奔赴会议现场,携手参会的中国专家代表,为您带来第一手的会议现场报道,精彩不容错过!

在当地时间6月3日上午进行的“肺癌(非小细胞肺癌)”口头报告专场,将报告研究“在MET14外显子突变的进展期非小细胞肺癌(NSCLC)患者中,苯扎米特(INC-280)的疗效数据——来自Ⅱ期 GEOMETRY mono-1研究”(摘要号9004),“特泊替尼(tepotinib)在MET14外显子突变NSCLC的Ⅱ期研究(摘要号9005)”以及“MET14突变肺癌患者对MET抑制剂的耐药机制”(摘要号9006),本报特邀中国医学科学院肿瘤医院段建春副主任医师针对上述研究进行了点评。

研究简介

题目 在MET14外显子突变的进展期NSCLC患者中,INC-280的疗效数据——来自Ⅱ期 GEOMETRY mono-1研究
背景
INC-280是一种高选择性间质-上皮细胞转化因子(MET)抑制剂。GEOMETRY mono-1研究的前期数据显示,(队列4)对于接受过1~2线治疗的MET14外显子突变NSCLC,INC-280获益明显,安全性佳;(队列5b)对于初治患者则表现出更高的客观缓解率(ORR)。
方法
GEOMETRY mono-1是一项Ⅱ期多中心、多队列研究,共设有6个队列,在MET14外显子突变或MET扩增的进展期NSCLC患者中评估了INC-280的疗效。入组标准包括:年龄≥18岁,ECOG评分0~1分,间变性淋巴瘤激酶(ALK)及表皮生长因子受体(EGFR)野生型,ⅢB/Ⅳ期NSCLC。经中心试验室确认的MET14外显子突变(不考虑MET扩增状态/基因拷贝数)NSCLC患者,被分入队列4或5b,接受INC-280 400 mg Bid治疗。主要研究终点是由独立评审委员会(IRC)根据RECIST1.1标准评估的ORR。次要研究终点为缓解持续时间(DOR)。
结果
截至2018年11月8日,共97例MET14外显子突变的NSCLC患者可评估疗效(队列4中69例;队列5b中28例)。队列4中ORR为39.1%(27.6-51.6),队列5b为71.4%(51.3-86.8)。尽管在分析时,数据尚未成熟,DOR结果仍值得期待,中位DOR在队列4为9.72个月(4.27-11.14),队列5b为8.41个月(5.55-NE);中位无进展生存(PFS)期在队列4 为5.42个月(4.17-6.97),队列5b为9.13个月(5.52-13.86)。安全性可控,在全组人群(315例)最常见的不良反应(AE)(所有级别≥25%)包括外周水肿(49.2%),恶心(43.2%)和呕吐(28.3%),且多为1/2级。
结论
该数据证实,对于MET14外显子突变的进展期NSCLC患者,INC-280是一种有前景的新型治疗药物(无须考虑治疗线数),不但可以使患者获得深度持久的疗效,而且安全性可控。
题目 Tepotinib在MET14外显子突变NSCLC的Ⅱ期研究
背景
据报道,MET14外显子跳跃突变(METex14)发生于3~4%的NSCLC患者,该驱动基因对MET抑制剂敏感,可方便的经液体活检(LBx)检出。
方法
在EGFR/ALK野生型进展期NSCLC患者中,经中心实验室通过LBx(≥60例) 或肿瘤组织标本(TBx)(≥60例, 两种标本均可提供者优选)行基于RNA的MET14突变检测,给予阳性者tepotinib500 mg QD治疗直至疾病进展,或不能耐受不良反应或撤出知情同意。主要研究终点为经IRC评估的ORR。次要研究终点为经研究者评估(INV)的ORR和安全性。
结果
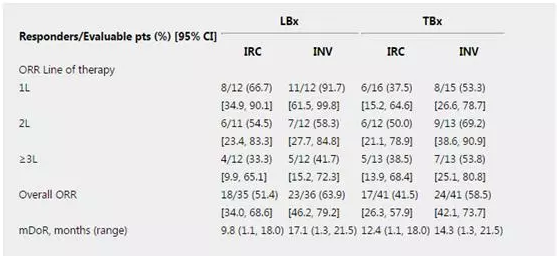
截至目前,共入组85例患者(55例LBx患者,52例TBx患者)。 至2018年10月16日,在35例可评估的LBx患者中(≥2次基线后评估或因任何原因停止治疗),ORR分别为51.4%(由IRC评估)和63.9%(由INV评估)。在41例可评估的TBx患者中,ORR分别为41.5%(由IRC评估)和58.5%(由INV评估)。中位DOR和不同治疗线数的ORR见表1。在可评估安全性的69例患者中,治疗相关不良反应(TRAE)的发生率(≥10%)为外周性水肿(47.8%),腹泻 (18.8%),恶心(15.9%)和乏力(10.1%)。未出现4级或危及生命的TRAE。2例患者(2.9%)发生导致永久性停药的TRAE(1例为间质性肺炎,1例为腹泻和恶心)。
结论
Tepotinib对于MET14外显子突变(经LBx或TBx检测)的NSCLC患者,无论治疗线数如何,均具有显著疗效和较长的DOR。药物安全性可控,目前入组仍在进行中。

题目 MET14突变肺癌患者对MET抑制剂的耐药机制
背景
MET14外显子突变代表一类新型的肺癌驱动基因。MET酪氨酸激酶抑制剂(TKI)对这类患者有效,但ORR有限(30%~40%),这可能与部分患者存在原发耐药有关。此外,更多见的是部分患者初始治疗有效,但之后发生无可避免的获得性耐药。本研究试图探索该组患者可能的耐药机制。
方法
该研究对存在MET14突变且接受了至少一种MET TKI治疗的Ⅳ期肺癌患者进行研究,收集肿瘤和(或)血浆标本,优先配对TKI治疗前后标本的收集。肿瘤组织标本进行靶向质谱分析(Nantomics)和DNA-(包括MSK-IMPACT)/基于RNA(MSK-Fusion)的二代测序(NGS)。对血浆cfDNA进行靶向NGS检测。评估患者靶向治疗的ORR和PFS(RECIST v1.1)。
结果
共74例患者接受了MET TKI治疗(接受过1种TKI 患者55例,≥2种TKI患者19例)。91%的患者接受克唑替尼作为一线TKI。在肿瘤组织中,TKI治疗前的MET水平(范围 0~2120 amol/ug)与预后相关。在可检测出MET组中,ORR为63%(7/11),中位PFS 6.9个月;未能检测MET组中的ORR为0%(0/5),中位PFS 4.6个月( HR 0.3)。TKI治疗前RAS通路的活化与疗效相关,KRAS/NF1/RASA1突变中ORR为0%(0/6),而其他患者的ORR为29% (25/87)。TKI使用前KRAS的表达水平亦存在相似结果,在具有可检测的KRAS水平的16例患者中,KRAS≥700 amol/µg患者的ORR为0% (0/2),而KRAS<700 amol/µg患者的ORR为50% (7/14)。在29例患者中,观察到获得性耐药(根据Jackman标准),其中9例患者有治疗前后的配对标本。在2例患者(22%)中发现与靶点相关的获得性耐药机制,MET D1228N (1例), HGF扩增 (1例)。在5例(44%)患者中,观察到可能与靶点无关的获得性耐药机制,KRAS G13V (1例),RASA1 S742* (1例),MDM2扩增(2例),EGFR扩增(1例)。
结论
在MET14突变的肺癌人群中,缺乏MET表达或RAS通路活化与MET TKI疗效差有关。在<25%的患者中发现了与靶点相关的获得性耐药,HGF扩增是一种新的耐药机制。与靶点无关的原发性/获得性耐药可以通过RAS/MDM2/EGFR通路激活。
专家点评
最新研究提示,INC-280及tepotinib在MET14突变NSCLC患者中前景值得期待,而在肿瘤组织中可检测到MET水平患者的疗效明显优于无法检测到MET水平的患者。
MET被认为是继EGFR、ALK和c-ROS原癌基因(ROS1)之后又一重要的NSCLC分子治疗靶点。MET14外显子突变患者在一些临床试验及个案报道中显示出对MET抑制剂良好的疗效。不同文献报道MET14外显子突变发生比例不同,在NSCLC中的总发生率为3~6%,在肺腺癌的发生率为3~4%,在肺肉瘤样癌的发生率可高达22%。既往研究发现,MET14外显子突变患者往往年龄更大,且更倾向于同时伴有MET基因扩增及MET蛋白过表达。在Profile1001研究中,入组了21例MET14外显子突变患者,结果显示,克唑替尼对该类患者的有效率为44%,疾病控制率为50%,PFS数据尚未成熟。
作为一个值得关注的靶点,在今年ASCO会议上,有两项研究分别公布了各自对MET14外显子突变的初步结果。摘要9004中的研究显示,INC-280作为一种高选择性MET抑制剂,对MET14外显子突变的进展期NSCLC具有优越的数据,在后线治疗中,ORR可接近40%(队列4),而在初治患者中(队列5b)则高达71.4%。虽然数据尚未成熟,但目前已显示出较好的DOR(两组队列分别为9.72和8.41个月)和PFS(分别为5.41和9.13个月)。药物的安全性可控,大部分患者发生的不良反应均为1/2级。INC-280已成为MET14外显子突变NSCLC患者值得期待的又一个新型靶向药物。
摘要9005中则报道了另外一个针对MET抑制剂tepotinib对MET14突变患者Ⅱ期临床研究的初步数据。该研究的设计亮点在于,入组时既可接受肿瘤组织标本检测,也可接受液体活检。基于晚期NSCLC患者肿瘤组织标本获取的困难及肿瘤组织量的有限性,这在很大程度上给予更多患者接受精准治疗的机会。研究结果显示,无论基于液体活检,还是组织活检,tepotinib对MET14突变的进展期NSCLC患者均有良好的ORR和较长的DOR。药物的安全性可控,未观察到危及生命的严重不良反应。这项Ⅱ期研究仍在入组进程中。
但正如同EGFR/ALK/ROS1通路一样,MET抑制剂治疗也会面临原发耐药和获得性耐药问题。摘要9006中揭示了MET抑制剂对MET14突变患者原发耐药与获得性耐药的可能机制。研究发现,与EGFR敏感突变丰度对EGFR TKI疗效的提示作用类似,在肿瘤组织中可检测到MET水平患者的疗效明显优于无法检测到MET水平的患者。该发现提示,肿瘤组织中存在可作用的靶点并具有一定的丰度,才能获得更好的疗效。BENEFIT研究中提示的,“同时合并其他驱动基因的EGFR敏感突变患者对EGFR TKI的疗效欠佳”这一现象,在本研究中也得到了进一步体现。如文中所述,同时合并其他驱动基因的变异,如RAS通路的活化及KRAS的表达水平,往往预示着患者对MET抑制剂的疗效欠佳。对于获得性耐药,MET TKI的耐药机制也分为与靶点相关的耐药机制和与靶点无关的旁路耐药机制。但鉴于病例数有限,尚需更多的人群数据。
综上所述,精准医学发展到如今,越来越多精准靶点的发现及检测,显著改善了NSCLC患者的预后。对于MET14外显子突变,有前景的新药不断涌现,而对其耐药机制及相应治疗策略的探索,已提上议事日程。未来还有更多更长的路,我们将继续砥砺前行。

作者 | 段建春(中国医学科学院肿瘤医院)
编辑 | 郝冉(中国医学论坛报)
查看更多