查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2020 年 1 月 31 日,国际知名学术期刊《Science》杂志上发表了美国约翰霍普金斯大学Suzanne L. Topalian 等研究人员总结了肿瘤免疫治疗中的新辅助检查点阻断研究。
背景:靶向程序性死亡1(PD-1)与其配体PD-L1和PD-L2相互作用的免疫疗法开创了现代肿瘤学时代。PD-1通路是肿瘤微环境(TME)中局部免疫抑制的关键介质,但也可调节次级淋巴组织中针对肿瘤抗原的T细胞启动。在其他治疗无效的晚期不能手术的癌症中,阻断淋巴细胞上PD-1受体或肿瘤和/或免疫细胞上PD-L1配体[抗-PD-(L) 1]的药物可介导肿瘤消退。 尽管抗-PD-(L) 1治疗具有广泛活性,被视为癌症治疗的“共同点”,但许多肿瘤表现出新发或获得性耐药。在新辅助(术前)环境下使用抗-PD-(L) 1疗法,当肿瘤可能“可切除治愈”时, 提出了一种潜在的解决方案。这种方法与乳腺癌和肺癌的术前化疗有大量的肿瘤学先例,将病理学缓解与长期临床结局改善相关联。我们的综述重点关注PD-1通路阻断时代新辅助免疫疗法的发展,强调免疫学机制、临床开发和病理学缓解评估的特殊考虑。
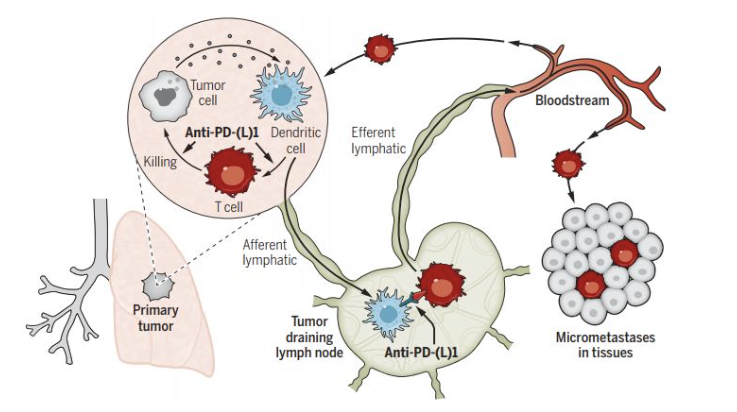
新辅助 PD-(L) 1 阻断后增强全身抗肿瘤 T 细胞免疫的两种潜在机制。PD-(L) 1 阻断可导致肿瘤微环境中肿瘤特异性 T 细胞克隆的“原位”扩增。这种扩增和激活主要由肿瘤中表达 PD-L1和 PD-L2 的树突状细胞驱动。肿瘤特异性浸润淋巴细胞可能代表初始 T 细胞或 PD-1 通路阻断前已对肿瘤抗原“致敏”的 T 细胞。此外,起源于肿瘤的含肿瘤抗原的树突状细胞拾取肿瘤抗原并转移到肿瘤引流淋巴结,在那里它们以无效或耐受的方式将抗原呈递给肿瘤特异性T细胞。PD-(L) 1 阻断可在此时起作用,增强肿瘤特异性 T 细胞的生产性刺激或部分逆转耐受诱导。激活的T 细胞通过输出淋巴管进入循环,然后进入组织。
进展:PD-1通路对T细胞启动、效应功能和耗竭的免疫学效应表明新辅助免疫疗法与化疗的不同机制。新辅助化疗可以在术前“减灭”肿瘤,而新辅助免疫疗法旨在增强针对肿瘤抗原的全身免疫,消除微转移肿瘤沉积物,否则这些肿瘤沉积物将是术后复发的来源。此外,在原发性肿瘤存在时新辅助PD-(L) 1阻断,与切除后仅针对微转移疾病的辅助治疗相反,利用原 发性肿瘤中存在的较高水平内源性肿瘤抗原来增强T细胞启动。
我们讨论了支持新辅助PD-(L) 1阻断可能促进全身抗肿瘤免疫的两种不同但并不相互排斥的模式的科学证据。首先,抗-PD-(L) 1使已经存在于TME中的肿瘤特异性细胞毒性T细胞恢复活力,引起其激活、增殖和转运到微转移沉积物。其次,肿瘤引流淋巴结(TDLN)似乎是抗-PD-(L) 1活性的焦点,其中树突状细胞向T细胞呈递肿瘤抗原增强;然后这些肿瘤特异性T细胞进入血流并迁移到肿瘤部位。微转移的破坏是新辅助PD-1阻断应导致可手术患者的无复发和总生存率提高的核心概念,否则这些患者在单纯手术后会复发。
为评价不同肿瘤类型的新辅助免疫疗法提供了强有力依据。术前给药为深入的机制和生物标志物研究提供了丰富的治疗中组织。我们讨论了最近新辅助抗-PD-(L) 1临床试验的数据,这些数据显示病理性肿瘤消退可以超过放射影像学消退,并证明不同细胞亚群参与了这 一过程。
前景:目前,100多项作为单药治疗或联合治疗的新辅助抗-PD-(L) 1阻断临床试验正在进行 或计划进行。将抗-PD-1与抗CTLA-4(细胞毒性T淋巴细胞-相关蛋白4)或与多药化疗联合 治疗三阴性乳腺癌和肺癌,产生了令人鼓舞的显著病理学缓解率,但需要更长时间的随访。 下一代试验可能有助于根据病理学缓解的程度对患者进行术后观察或干预,类似于乳腺癌非免疫学新辅助治疗的先例。新辅助免疫疗法后切除的肿瘤为深入的科学探究提供了充足的材料,有望进一步阐明反应和耐药机制,揭示可以在新的治疗组合中共同靶向的通路和分子, 以增加抗-PD-(L)1治疗的疗效。
Topalian S L , Taube J M , Pardoll D M . Neoadjuvant checkpoint blockade for cancer immunotherapy[J]. Science, 2020, 367(6477):eaax0182.
声明:仅供医疗专业人士参考
CN-65058 Expiration Date: 2021-9-20
查看更多