查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2025年10月17日,我国自主研发的新型HER2 ADC——博度曲妥珠单抗正式获得国家药品监督管理局(NMPA)批准上市,用于既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。

与此同时,其关键Ⅲ期临床研究KL166-III-06数据在2025 ESMO年会这一国际顶级学术殿堂,由该研究PI胡夕春教授以重磅口头报告形式惊艳发布,获得全球肿瘤学界的高度关注。这一进展充分印证了中国创新药研发力量的强势崛起,深刻体现了“中国力量”在全球抗癌事业中的崛起与贡献,铿锵有力的“中国之声”正改变着世界肿瘤治疗的格局。值此里程碑时刻,我们特别邀请国内乳腺癌领域权威专家、复旦大学附属肿瘤医院张剑教授,通过视频形式录制寄语。本文将深入解读博度曲妥珠单抗的研究数据、临床价值及其为中国乃至全球患者带来的治疗新希望。

攻坚克难
HER2阳性晚期乳腺癌的未尽之需

尽管抗HER2靶向药物的问世已显著改善HER2阳性晚期乳腺癌患者的生存预后,但疾病的恶性演进本质决定了其治疗之路依然充满挑战,临床中仍有约半数患者在治疗18至24个月时出现疾病进展。此时,后续治疗选择的匮乏与疗效的衰减便构成了临床上面临的核心困境。此外,随着酪氨酸激酶抑制剂(TKI)在临床实践中的日益前移及其在联合治疗中的广泛应用,TKI经治人群规模持续扩大。然而,针对该人群的后续干预手段,其疗效仍存在显著的局限性与未被满足的提升空间。
因此,探索兼具卓越疗效、可控安全性及广泛适用性的新一代治疗策略,已成为当前HER2阳性晚期乳腺癌治疗领域亟待攻克的关键课题与紧迫的临床需求。

巅峰实证
KL166-III-06研究数据深度解读与临床启示

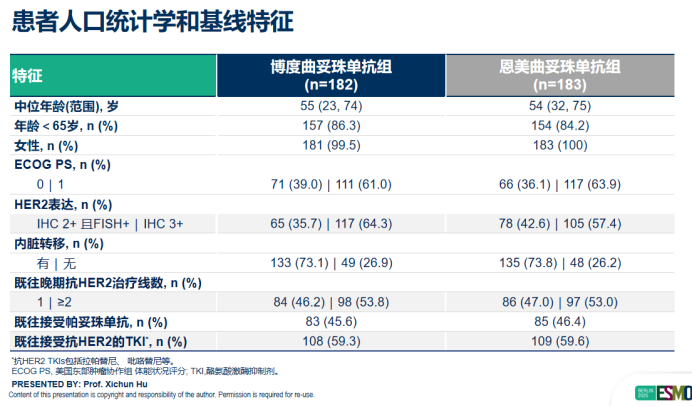
基于前述临床需求背景,博度曲妥珠单抗所开展的KL166-III-06 Ⅲ期临床研究,旨在通过高质量循证医学证据探索其在该人群中的治疗价值。该研究为一项多中心、随机、开放、对照的Ⅲ期临床试验,旨在直接对比博度曲妥珠单抗与T-DM1在既往接受过曲妥珠单抗和紫杉类治疗的HER2阳性不可切除或转移性乳腺癌患者中的疗效和安全性。研究纳入的365例患者基线特征极具代表性:53%的患者既往接受过2种以上抗HER2治疗,约60%为TKI经治人群。这一高度贴合中国真实世界诊疗现状的患者特征,使得研究结果对中国临床实践具有直接的、极高的指导价值。张剑教授所在中心作为该研究的核心参与单位之一,凭借其丰富的患者资源与精湛的研究管理能力,为这一高质量循证医学证据贡献了重要力量。
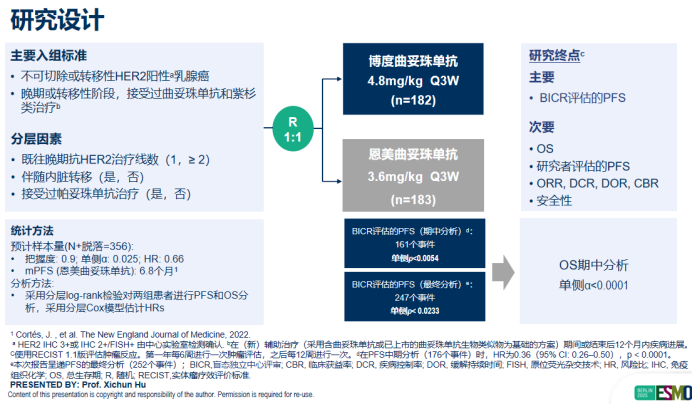
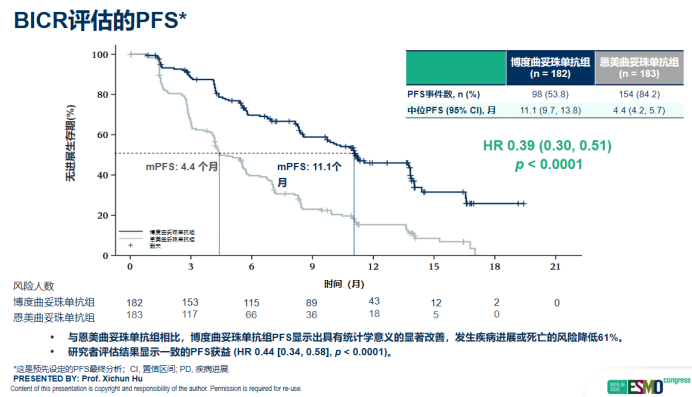
研究的核心结果展现出显著的临床价值。截至2025年4月26日,中位随访14.9个月时,经盲态独立中心审查委员会评估,博度曲妥珠单抗组的中位PFS达到11.1个月,显著优于T-DM1组的4.4个月(HR 0.39,95% CI: 0.30-0.51,p<0.0001),实现了跨越式的延长,明确体现了博度曲妥珠单抗在控制疾病进展方面的显著优势。
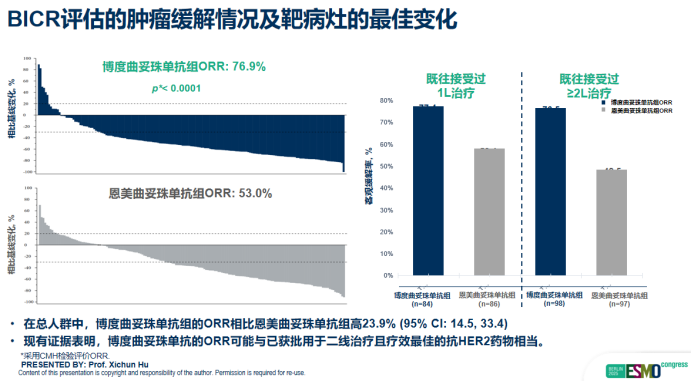
在肿瘤缓解方面,博度曲妥珠单抗同样表现卓越。经BICR评估,其ORR高达76.9%,显著优于T-DM1组的53.0%。
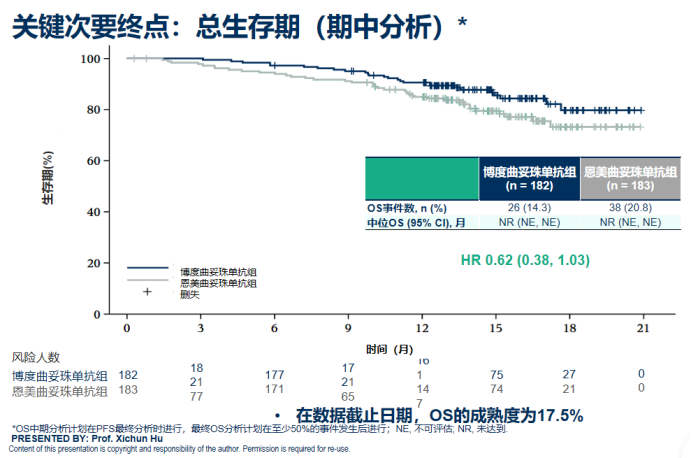
尽管目前OS数据尚未成熟,但博度曲妥珠单抗组已展现出明确的长期生存获益信号(HR=0.62,95% CI: 0.38-1.03)。这一积极的早期趋势,为患者和医生带来了改善远期生存的坚定信心。
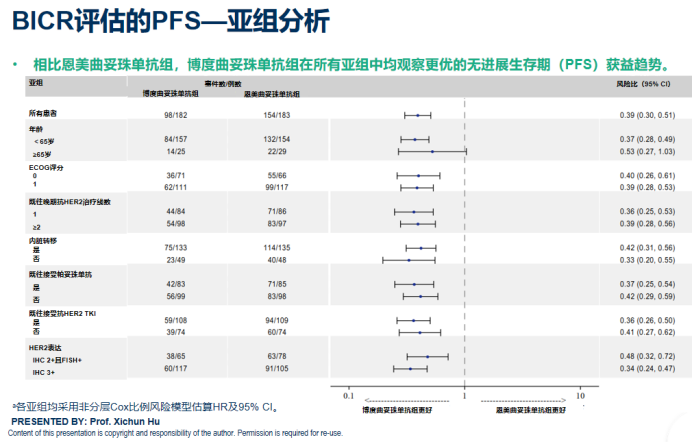
研究的亚组分析结果,进一步夯实了博度曲妥珠单抗的临床应用基石。亚组分析显示,无论患者既往接受的抗HER2治疗线数如何、是否伴随内脏转移、是否使用过帕妥珠单抗、是否使用过抗HER2 TKI,博度曲妥珠单抗组均展现出持续且一致的PFS获益。这强有力地证实了该药物在面对复杂、异质化的后线治疗人群时,其疗效的稳健性与广泛适用性,为真实世界中的广泛应用奠定了坚实基础。
在疗效卓越的同时,博度曲妥珠单抗展现出良好的安全性特征。其血液学毒性及肝脏毒性的发生率低于T-DM1对照组,且该组未出现导致死亡的治疗相关不良事件。此外,博度曲妥珠单抗组间质性肺病(ILD)发生率维持在较低水平,其对胃肠道的刺激性也相对可控,这种“高效且更为安全”的临床特征,为患者实现长期、持续的治疗提供了坚实基础,显著优化了药物的整体风险获益比。
综上所述,博度曲妥珠单抗作为首个在头对头Ⅲ期临床研究中较T-DM1显示优效性的国产HER2 ADC药物,不仅以高级别循证医学证据回应了当前后线治疗中的未满足需求,也为HER2阳性晚期乳腺癌患者提供了兼具卓越疗效与可控安全性的新选择。

惠泽华夏
正式上市引领中国诊疗新纪元

2025年10月17日,中国国家药品监督管理局的正式批准,使博度曲妥珠单抗的临床价值从研究数据转化为惠及中国患者的现实方案。
该药物的获批具有多方面的深远意义。首先,它在关键临床需求领域实现了重要突破,为经治HER2阳性晚期乳腺癌患者提供了强有力的国产创新治疗方案,有效改善了既往后线治疗选择有限的困境。其次,基于其在与T-DM1头对头比较的Ⅲ期研究中展现的优效性结果,该药物有望重塑我国HER2阳性晚期乳腺癌的治疗格局,成为二线及以上治疗的新希望。此外,作为本土研发的创新药物,其在供应链稳定性、医保准入潜力及患者可及性方面具备显著优势,有助于推动更多中国患者尽早获得与国际水平同步的高质量治疗。最后,博度曲妥珠单抗的成功研发与获批,充分体现了我国在高端生物制药领域的创新能力,证明了本土研究者完全有能力在前沿靶点与高技术壁垒的领域研发出引领全球的优质药物。
从ESMO国际舞台的学术发布,到快速落地中国临床实践,博度曲妥珠单抗完成了从“中国数据”到“中国证据”,再到“中国方案”的完整转化,为中国创新药物的全球发展路径提供了成功范式。

声震寰宇
中国力量引领全球抗癌新征程

博度曲妥珠单抗的成功并非偶然,而是中国生物医药创新能力系统提升的集中体现。当KL166-III-06研究数据在ESMO这一国际顶级学术平台发布时,其所传递的不仅是具有统计学说服力的研究结果,更是中国创新药物研发已具备参与全球高水平竞争能力的重要信号。
该药物从源头分子设计的创新,到严格执行国际标准的临床试验,再到高水平学术平台的成果展示,构建了完整的自主创新链条。这一历程表明,中国药物研发已从早期的跟随模仿,稳步迈向前沿领域的自主创新与突破。正如张剑教授在寄语中所强调,这是“中国研发创新力量逐渐强大的一个生动缩影”。在此过程中,由中国主要研究者领衔的临床研究团队,凭借其专业素养与研究经验,既确保了试验符合国际规范,又使其紧密契合中国患者的诊疗实际,为研究的顺利开展与数据质量提供了关键保障。
展望未来,随着博度曲妥珠单抗在国内的成功落地,其进一步走向国际市场、惠及更广泛患者群体已成为值得期待的发展方向。推动中国创新治疗方案成为国际标准,既是提升我国医药产业全球竞争力的关键举措,也是中国为全球肿瘤治疗进展作出实质性贡献的重要体现。

结语:博度曲妥珠单抗的成功获批与其在ESMO年会上的权威发布,共同奏响了中国创新药研发迈向世界的激昂乐章。它始于对临床未竟需求的深刻洞察,成于差异化设计的匠心智慧,证于国际顶级舞台的硬核数据,最终惠及于中国万千患者。这一历程不仅展现了我国在高端生物药研发领域的综合实力,也为全球抗癌事业贡献了具有重要价值的中国智慧与中国方案。
复旦大学附属肿瘤医院
肿瘤内科主任医师、博导、一期临床试验病房执行主任
复旦大学附属肿瘤医院福建医院临床研究中心主任
中国医药教育协会肿瘤药物临床研究专业委员会主委
中国老年保健协会肿瘤防治与临床研究专业委员会主委
长江学术带乳腺联盟YBCSG主委
上海市抗癌协会 肿瘤药物临床研究专业委员会候任主委
中国抗癌协会 乳腺癌专业委员会常委
中国抗癌协会 乳腺癌专业委员会青委会副召集人
中国研究型医院协会 乳腺专业委员会青委会副主委
中国妇幼健康研究会 乳腺癌防治研究专业委员会副主委
国家抗肿瘤药物临床应用监测青委会副主委
上海市抗癌协会 类器官专业委员会副主委
CSCO 肿瘤支持与康复治疗专家委员会常委
CSCO 乳腺癌专家委员会委员
中国抗癌协会 肿瘤临床研究管理学专业委员会委员
国家药品监督管理局CDE外聘专家、首批化药临床兼职审评员
上海“医苑新星”杰青人才获得者
获2023 十大医学先锋专家、2023“人民好医生”杰出贡献奖
《Diseases & Research》副主编、人卫《肿瘤综合治疗电子杂志》副主编
第一/共一/通讯SCI论文90余篇(Lancet Oncol、Ann Oncol/2、JAMA Oncol、Nat Commun、Clin Cancer Res/2、J Hematol Oncol、STTT/2、ACS Nano等)
审核丨复旦大学附属肿瘤医院张剑教授
查看更多