查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





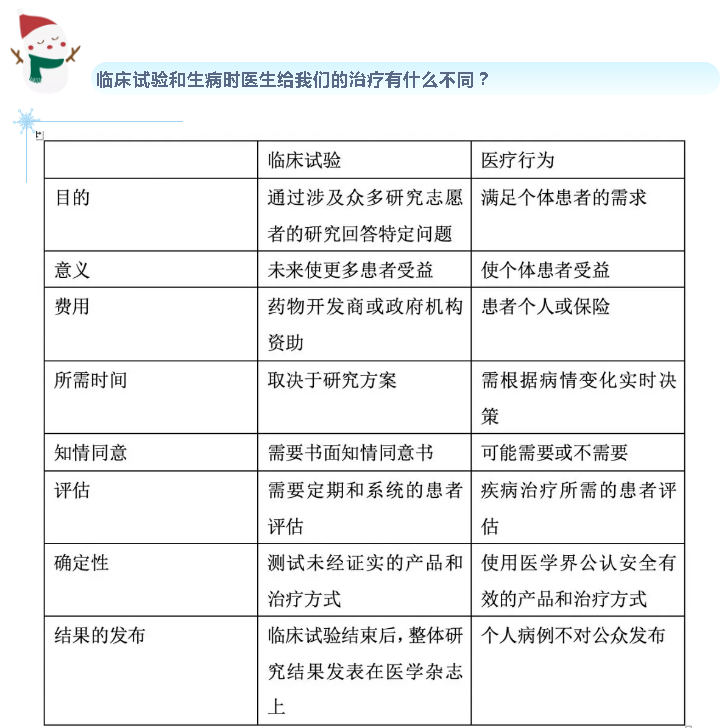
很多人一听临床试验,第一反应是“我不要当小白鼠”,“为什么要拿我做实验”,殊不知,临床试验和实验室的试验不是一回事,和平时生病时医生给我们的治疗也不是一回事。临床试验是指通过健康人群或患者参与,探讨药物或治疗方式的系统性研究,以揭示药物或治疗方式的疗效及安全性。
下面跟随小编一起揭开临床试验的神秘面纱,一探究竟吧~

恶性肿瘤已成为严重危害人类健康的疾病,2018年Globocan估计,全球每年癌症新发病例约1808万,死亡约956万,罹患肿瘤给患者和家属带来了沉重的身心负担,现有的治疗手段尽管取得了一定的疗效,但很多肿瘤仍不能完全治愈。随着医学的发展,越来越多新的药物和治疗方式的研发,意在改善患者生存,延长患者生命,最终使患者获益。
实验室研究开发新的药物和治疗方法,研究者在动物体内外进行疗效和安全性评估,从而进入最重要的阶段即临床试验。通常临床试验分为I~IV期,按照预先设定的方案进行相关研究,帮助研究者了解更多药物和治疗方法的疗效及风险等信息。

不同于一般的临床试验,肿瘤临床试验主要是与肿瘤相关的临床研究,受试者多为肿瘤患者,研究主要包括以下几方面:
(1)治疗性临床试验包括验证治疗手段的研究;
(2)预防性临床试验是寻找好的方法来预防疾病发生或再次发生,包括药物预防、疫苗、维生素应用或改变生活方式等;
(3)诊断性临床试验是寻找更好的诊断疾病的方法;
(4)筛查或早期发现临床试验是寻找更好的筛查疾病方法;
(5)生活质量临床试验(支持治疗临床试验)是为了寻找更好的方法以改善受试者生活状态、提高舒适度的研究。

部分患者对现有的标准治疗方法不耐受,或是疗效不佳;部分肿瘤则是缺乏有效的治疗药物和方法。每一项临床试验开始前,研究者会根据研究目的制定详细的研究方案,方案中有项非常重要的内容就是提出能参加这项临床试验的标准,允许参加试验的因素称为“入选标准”,不允许参加试验的因素称为“排除标准”。这些标准会基于一些因素,包括年龄、性别、疾病状态、既往病史及其他治疗用药等。入选标准对于一项研究非常重要,既能保证研究达到预先设定的目的,也能保证选择合适的受试者,从而保证受试者的安全。

从法律法规方面,近20年来,随着推荐到临床的新药日益增多,很多国家新药临床试验的开展已有规范。从1985年我国《药品法》颁布以来,我国政府对新药的发展十分重视,制定了相应的法规。1998年卫生部发布了《药品临床试验管理规范(试行)》,1999年国家食品药品监督管理局修订了上述规范并正式实施。由于抗肿瘤药物的特殊性,其风险受益的权衡不同于其他一般药物,抗肿瘤药物的临床研究完全遵循一般药物的临床研究规律可能并不适宜。因此,2008年公布了《抗肿瘤药物临床试验技术指导原则》,旨在为抗肿瘤药物临床研究设计、实施和评价提供方法学指导。
从审核方面,对于一项将要进行的临床研究,专家委员会对方案进行审核,从科学性、可实施性等多方面权衡,并由多方面成员组成的伦理委员对方案的伦理问题进行审核,完全从受试者的角度出发来评判临床试验的方案。
此外,非常重要的一点是,临床试验要获得受试者的知情同意。知情同意是受试者是否参加临床试验的重要过程,可帮助患者决定是否参加该临床研究。在知情同意过程中,医生应充分向受试者讲明试验的目的、意义、研究方法、可能的不良反应及到目前为止已有的相关研究结果,同时要告知受试者如何与研究者取得联系。受试者有权获得知情同意书,并可与家人商讨,完全自愿地决定是否签署知情同意书。受试者签署知情同意书后也有权利随时退出研究,研究者不应因受试者退出研究而影响其之后接受的其他治疗。
内容来源
《乳腺癌患者教育手册》主编:江泽飞,副主编:殷咏梅

编辑 | 刘婷(中国医学论坛报)
查看更多