查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





肿瘤微环境不利于健康细胞的代谢。因此,理解哪些代谢途径有所改变,以及它们如何抑制免疫细胞的功能,是癌症的一个重要研究领域,一直广受关注。

2021年5月28日,《免疫学》(Immunity)杂志发表了一项关于肿瘤的重要发现:研究者发现,肿瘤微环境里充满了氧化的脂肪分子。被T细胞“误食”后,这些脂肪分子会抑制T细胞的抗肿瘤能力,进而揭露了一个全新的免疫抑制机理。
研究人员们指出,肿瘤微环境中的一个常见代谢变化是脂质的积聚。在多方合作之下,该团队使用质谱分析等方法,确认肿瘤内含有多种不同的脂类,尤其是氧化的脂类。这些氧化脂类常以“低密度脂蛋白”(LDL)的形式存在,这也是我们俗称的“坏脂肪”。

▲本研究负责人之一Susan M. Kaech教授
先前,人们一直好奇为何在肿瘤内的杀伤性T细胞对周围的癌细胞总是睁一只眼闭一只眼,纵容癌细胞的生长。这些“坏脂肪”对T细胞会有什么负面影响吗?顺着这个问题,研究人员们发现这些肿瘤微环境中的T细胞会摄入大量氧化的脂肪,抑制T细胞的功能。
这些T细胞之所以“贪嘴”,是因为表面表达一种叫作CD36的蛋白。如果敲除CD36,或是使用抗体来抑制它的活性,就能使T细胞在肿瘤微环境里“出淤泥而不染”,维持其功能。后续研究也确认,CD36能促进T细胞摄取氧化脂肪,在细胞内部带来损害,从而让它们失去作用。
“我们发现当T细胞在氧化脂肪的作用下‘产生压力’后,就会关闭它们的抗肿瘤功能。”本研究的第一作者Shihao Xu博士说道。
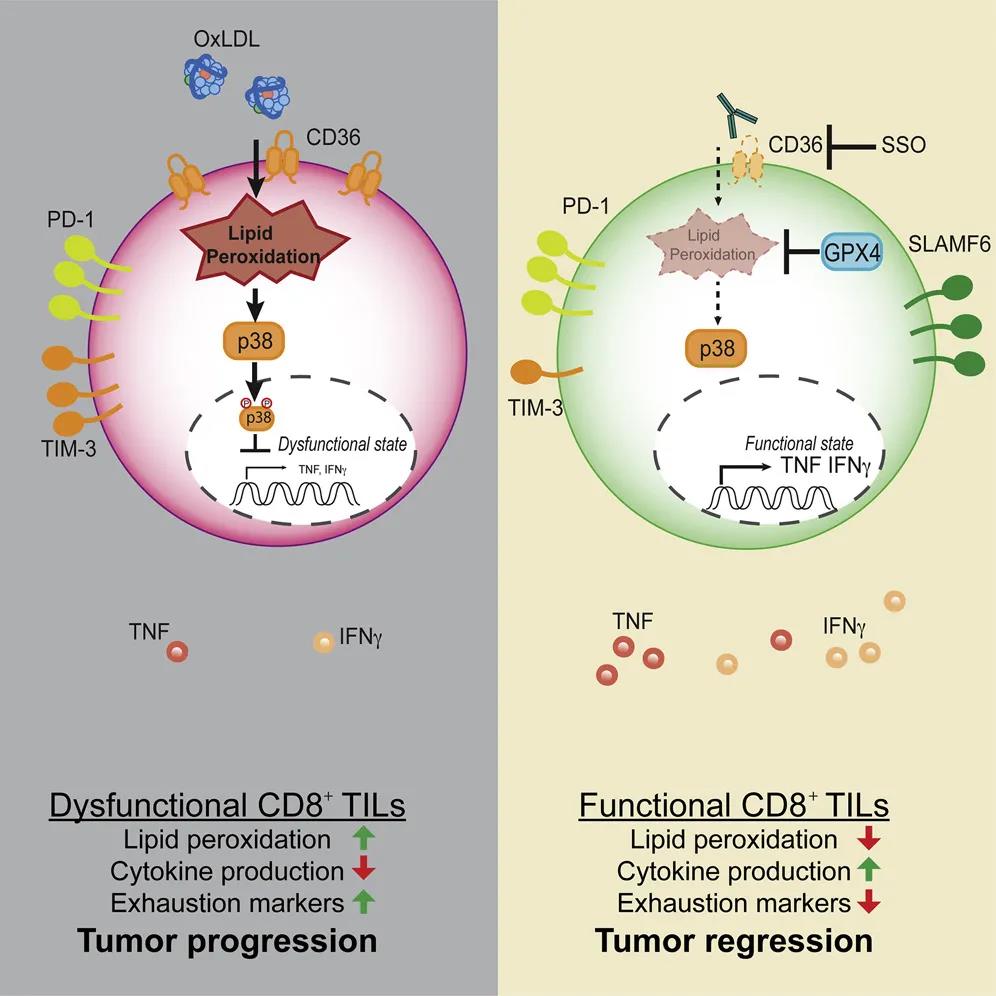
▲本研究的示意图
既然知道CD36是T细胞摄入“坏脂肪”的关键,研究人员们也由此找到了潜在的解决方案。
一方面,他们发现通过抗体抑制CD36,可以堵上T细胞的嘴,让它们“不吃”氧化的脂肪。另一方面,他们也发现通过过量表达一种叫作GPX4的酶,能够将氧化脂肪从细胞中清除出去,这同样能够重塑T细胞的功能。
研究人员们甚至想到,如果提高肿瘤细胞里的氧化脂肪,也能激活肿瘤的细胞死亡。但在这一点上,研究人员们呼吁我们谨慎。“现在我们发现T细胞在氧化脂肪的压力下会变得脆弱,我们需要找到更多方法,选择性在肿瘤细胞里诱导脂肪氧化,而不是在T细胞里,” Kaech教授补充道,“不然,我们可能在这个过程中摧毁抗肿瘤的T细胞。”
综合来看,研究人员们在这篇论文里发现肿瘤微环境里有着很多脂肪分子,尤其是氧化的脂肪。当T细胞摄入这些氧化的脂肪分子后,就会影响它们的活性。通过针对CD36来减少脂肪摄入,或是提高GPX4水平来清除细胞里的氧化脂肪,有望带来全新的癌症治疗思路,提高T细胞在肿瘤微环境内的活性。
学术经纬 平台发布
查看更多