查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





编辑 | 丁雨竹(中国医学论坛报)
编者按·研究导读
p53基因和相应治疗策略
p53基因是迄今发现与人类肿瘤相关性最高的基因。63%~72%晚期头颈部鳞癌(HNSCC)患者存在p53基因突变。
针对p53突变型肿瘤的治疗的思路包括:直接诱导突变型p53蛋白降解、帮助其恢复野生型功能、限制突变后p53基因的新活性。根据设计思路的不同,目前研发中药物主要分成直接和间接作用于突变型p53蛋白两大类。
▲ 针对癌症中突变型p53的研发策略。来源:药渡网
合成致死策略
合成致死策略是目前抗肿瘤药物研发中的一个重要思路,期望只杀伤肿瘤细胞,同时不损伤正常细胞。合成致死的原理是:当药物选择性失活基因B时,基因A功能正常的细胞可以继续生存,但基因A失活的肿瘤细胞会因为同时失去A和B基因的活性而死亡。
如果我们将p53视为这样的“基因A”,那么WEE1就是“基因B”之一。p53失活的基因丧失G1期阻滞功能,细胞完全依赖G2/M检查点完成修复;无法通过G2/M检查点者不能继续复制。因此,通过抑制G2/M检查点功能,有望诱导合成致死效应。此类重要靶点除WEE1外,还有CHK1/2、MK2、PLK1等。
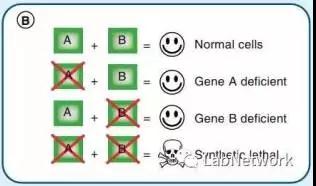
▲ 合成致死示意图。来源:LabNetwork
WEE1基因
WEE1是丝氨酸/苏氨酸蛋白激酶家族中的一员,可以使CDK1的Thr14和Tyr15磷酸化,从而抑制CDK1激酶活性,阻止细胞进入有丝分裂。
已有研究数据证明,抑制WEE1基因可特异性地杀死p53基因突变的细胞,同时不损伤正常细胞,即WEE1和p53之间确实存在合成致死效应。此外,在体实验证明这类药物可增敏标准铂类药物。
AZD1775
AZD1775(曾用名MK-1775)是“first-in-class”的WEE1小分子抑制剂。ClinicalTrials.gov网站截至6月26日可查到的注册试验共49个,26个处于Ⅱ期或Ⅰ期/Ⅱ期。已完成晚期实体瘤Ⅰ期试验3项,卵巢癌Ⅱ期试验1项。
本次发表在《临床癌症研究》(Clin Cancer Res)杂志的“根治性治疗前,每周应用多西他赛与顺铂联合AZD1775作为根治性治疗前头颈部鳞癌新辅助治疗的Ⅰ期临床研究”为HNSCCⅠ期试验,注册号:NCT02508246。
▲ 研究6月15日发表在《临床癌症研究》(Clin Cancer Res)杂志上,
DOI: 10.1158/1078-0432.CCR-17-3796
背景
WEE1酪氨酸激酶可调节G2/M期转换,并维持基因组稳定性,特别是在经过基因毒性治疗后需要进行DNA修复的p53缺失的肿瘤中。因此,有必要在肿瘤抑制因子缺失导致的HNSCC中探寻WEE1抑制剂的作用。
这项已经完成的Ⅰ期临床试验首次将WEE1抑制剂(AZD1775)联合顺铂和多西他赛应用于临床。
方法
本次开放标签、Ⅰ期研究采取3+3剂量递增设计,针对Ⅲ/Ⅳ期HNSCC伴边缘可切除疾病、或伴边缘不可切除但可接受根治性治疗疾病的患者。AZD1775剂量逐步上调,第一周每天口服2次、总共2.5天,随后3周联用固定剂量的顺铂(25 mg每平方米)和多西他赛(35 mg每平方米)。主要终点是不良事件,以建立最大耐受剂量(MTD)。次要终点包括缓解率(RR)、药代动力学(PK)、药效动力学和基因组数据等。
结果
每日口服AZD1775两次、每次150 mg、共计2.5天,建立MTD。10例患者中,5例达到实体瘤疗效评价标准1.1版(RECISTv1.1)定义的缓解;组织学调整显示另有3例患者缓解(图1~3)。
唯一的药物限制性毒性(drug-limiting toxicity)是3级腹泻。所有剂量组均在用药第4天达到PK C8hr目标240 nmol/L。药效动力学分析显示缓解者比未缓解者有更明确的pY15-Cdk分子表达下调和凋亡相关分子(γH2AX、CC3、RPA32/RPA2)升高。
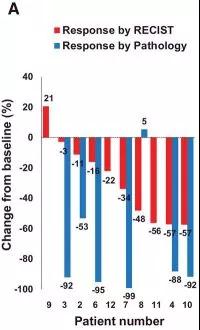
▲ 图1:新辅助联合AZD1775治疗后临床缓解情况。瀑布图显示新辅助治疗后根据RECIST1.1标准评估后的肿瘤体积变化,及转行手术治疗患者的组织学缓解情况。图片来自原文(figure1A)
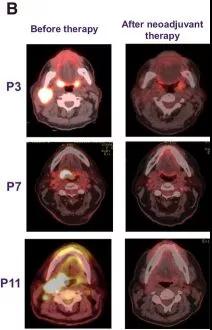
▲ 图2:新辅助联合AZD1775治疗后临床缓解情况。PET显示治疗前后变化。图片来自原文(figure1B)
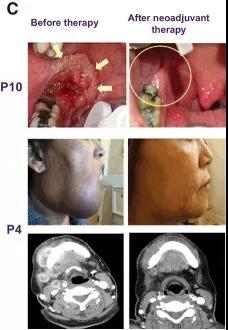
▲ 图3:新辅助联合AZD1775治疗后临床缓解情况。临床缓解图片对比。图片来自原文(figure1C)
结论
AZD1775+顺铂+多西他赛三联疗法是安全可耐受的。初期结果证实该疗法对晚期HNSCC有抗肿瘤效果,值得在Ⅱ期剂量研究中进一步探索。
参考资料
Eduardo Méndez, etc. A Phase I Clinical Trial of AZD1775 in Combination with Neoadjuvant Weekly Docetaxel and Cisplatin before Definitive Therapy in Head and Neck Squamous Cell Carcinoma. Clin Cancer Res; 24(12); 2740–8. ©2018 AACR
CDK1/2抑制剂临床药物研究及开发
合成致死:从概念验证到PARP抑制剂的上市
靶向p53信号通路的抗肿瘤药物研发策略盘点(下)

查看更多