查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





当人体受到细菌感染时,为了减轻痛苦和加速痊愈,我们往往会服用抗生素治疗,可以在免疫反应清除感染细胞和细菌的同时,防止细菌在身体中放肆侵袭。但随着抗生素的滥用,细菌也会通过突变和获得抗生素抗性遗传元件进化出各种抵抗机制,由此产生了多重耐药性的“超级细菌”。
抗生素耐药性是目前世界上最紧迫的公共卫生威胁之一,仅在我国,每年就有数万人死于金黄色葡萄球菌等常见细菌的耐药性菌株感染。然而,目前很少有新型的抗生素被开发出来用于应对耐药性菌株的感染。
近日,来自美国威斯塔研究所的研究人员在Nature上发表了题为IspH inhibitors kill Gram-negative bacteria and mobilize immune clearance的研究成果,其开发了一类IspH抑制剂,这种化合物能直接杀灭几种耐多药细菌的临床分离株,同时还可激发对耐药性菌的快速免疫反应,达到了广谱抑制多种细菌的效果。
2-甲基-D-赤藓糖醇-4-磷酸(MEP)途径是一种对大多数革兰氏阴性细菌和疟原虫至关重要但在人类中缺乏的代谢途径,其负责大多数致病菌细胞存活的必需分子即异戊二烯类化合物的生物合成。研究人员针对该途径中的异戊二烯合成必需酶IspH的抑制,设计了既可以杀死细菌又同时增强宿主自然免疫反应的双管齐下抗菌策略:免疫—抗菌双作用(DAIAs)。
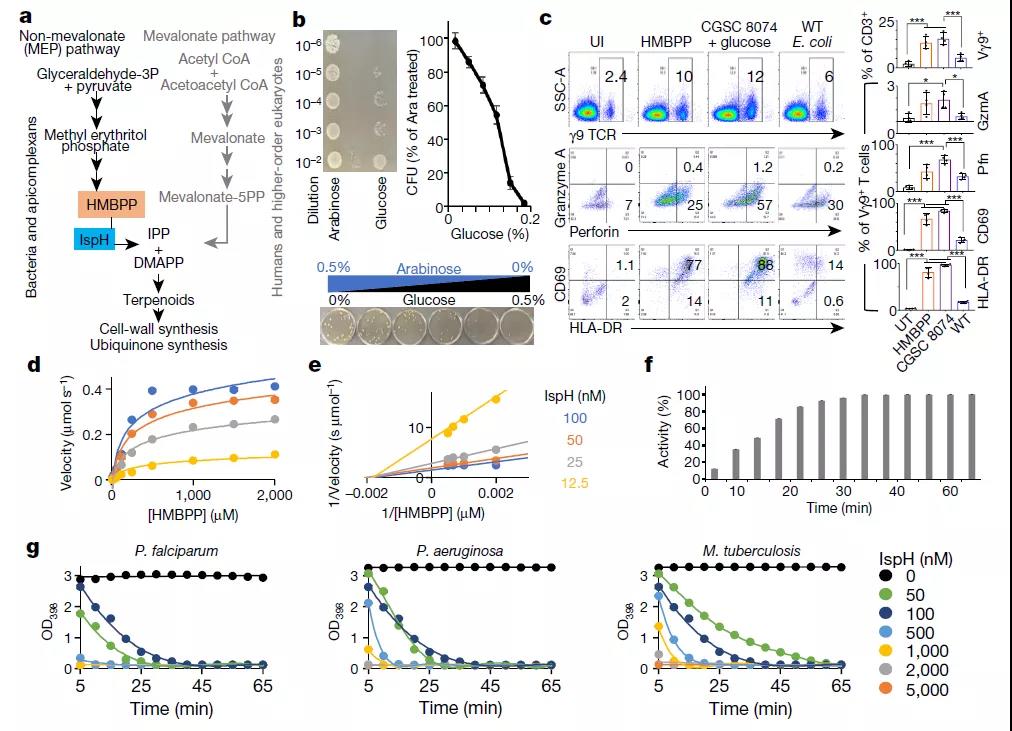
IspH作为DAIA策略的靶标测试
研究人员首先将该IspH蛋白的晶体结构与960万个可获得的化合物进行分子对接,结合表面等离子共振分析,从中筛选出C23.07,C23.20,C23.21,C23.28和C23.47是对表达的IspH蛋白最有效的一些抑制剂。
然后通过修饰这些最有效抑制IspH功能的小分子使其形成细菌可渗透的前药,对其在多种耐多药细菌的临床分离株的杀菌效果和MIC90值进行检测,发现包括产气肠杆菌、鲍曼不动杆菌、铜绿假单胞菌、霍乱弧菌、肺炎克雷伯菌、志贺氏菌、沙门氏菌、分枝杆菌和芽孢杆菌等在内的多种耐药菌株均可被有效杀死,且比同类抗生素包括美罗培南,阿米卡星、妥布霉素,环丙沙星以及几代头孢菌素等的效果更佳。
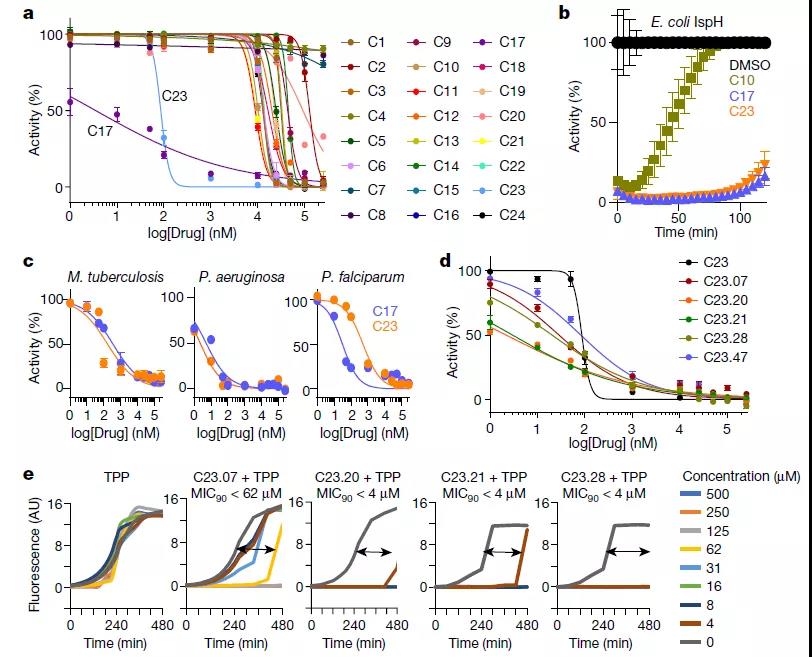
IspH抑制剂可抑制IspH并杀死细菌
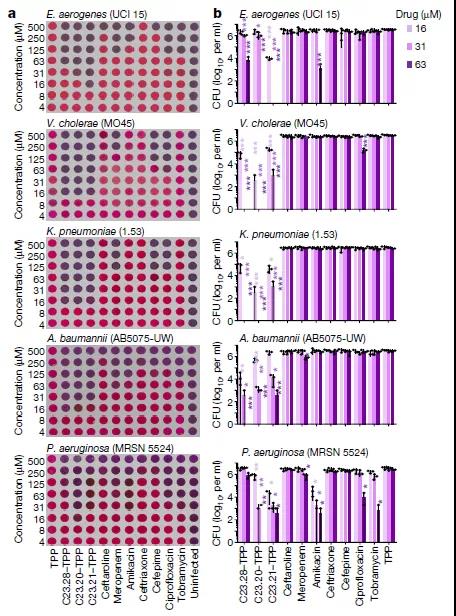
与同类最佳抗生素相比,前药C23对革兰氏阴性菌多药耐药临床分离株的MIC90值更低
对C23及其同类小分子的杀菌机理和毒性进一步分析,发现抑制IspH会导致大肠杆菌和霍乱弧菌的细胞壁和细胞膜形成缺陷, 且处理后的大肠杆菌体及霍乱弧菌内的Vγ9Vδ2T细胞在24-48小时内被激活,并产生了高水平的穿孔素和颗粒溶素和颗粒酶等细胞毒性标记物,这一诱导Vγ9Vδ2T细胞反应的结果在感染的人源化小鼠中也得到了验证,其能刺激免疫系统具有更强的细菌杀灭活性和特异性,且对人体细胞无任何毒性。
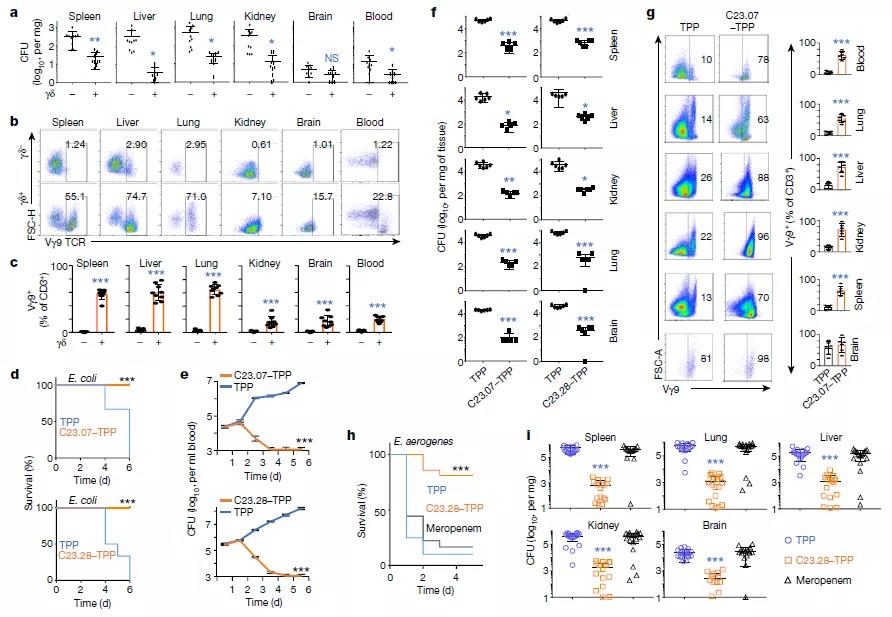
前药处理后,细菌和人源化小鼠中的γδT细胞被激活
该研究的通讯作者Farokh Dotiwala表示:“我们相信,这种创新的DAIA策略可以在抗生素的直接杀伤能力和免疫系统的自然力量之间产生协同作用,这可能代表着世界上对抗耐药性菌的一个潜在里程碑。”
本文首发于“生物探索”公众号
查看更多