查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





近年来,以免疫检查点抑制剂为代表的免疫治疗方兴未艾,相关临床试验在世界各地如火如荼地开展。然而并非所有患者都可以从该疗法获益,准确地鉴别免疫检查点抑制剂治疗有效人群具有重要的临床意义,不仅可加强疾病的管理,同时还减少了过度治疗。2019年6月和8月,中山大学肿瘤防治中心徐瑞华教授团队接连在《美国医学会杂志肿瘤学》(JAMA Oncol)和《肿瘤学年鉴》(Ann Oncol)发表两项重磅研究,在免疫治疗分子标志物的探索之路上迈出了重要且坚实的一步。
本报特邀徐瑞华教授团队,分享两篇研究背后的故事,梳理免疫治疗分子标志物的研究背景及未来的发展方向,以飨读者。
免疫治疗分子标志物研究现状
两年前,微卫星高度不稳定(MSI-H)成为首个泛瘤种免疫检查点抑制剂治疗的分子标志物,但其覆盖患者有限,随着免疫治疗的广泛应用,越来越多关于免疫治疗分子标志物的研究得以开展,成为了热点。
目前,肿瘤组织活检中程序性死亡受体-1(PD-1)的表达,是否可预测PD-1/PD-1配体(PD-L1)抗体药物的疗效仍存在争议,转移性黑色素瘤和非鳞状非小细胞肺癌(NSCLC)患者的荟萃分析结果显示,PD-L1表达与抗PD-1治疗的临床反应率显著相关;然而,鳞状NSCLC和肾细胞癌患者的类似分析,未发现两者间的显著相关性。与此同时,临床试验也发现,一部分PD-L1表达阴性的患者对PD-1抗体治疗有效。
近年来,肿瘤突变负荷(TMB)作为新兴的免疫检查点抑制剂疗效预测指标,受到越来越多的关注。研究表明,TMB能够预测黑色素瘤、肺癌和泌尿系统肿瘤的免疫治疗疗效,2019年TMB被正式纳入了NSCLC的美国国家综合癌症网络(NCCN)指南。
但因为部分患者无法提供足够的组织进行TMB检测,于是有研究提出,可采用循环肿瘤DNA(ctDNA)检测TMB,即bTMB。国内外研究亦证实了bTMB在预测NSCLC免疫治疗疗效的可靠性。但同PD-L1的表达一样,TMB并没有成为临床医生做出治疗决策的决定性因素,仅是众多考虑因素之一。TMB的检测还存在其他问题:如价格昂贵、检测平台不同、阈值设定差异、panel检测是否能够替代全外显子组等,TMB成为免疫治疗的指标仍需更多临床数据的支持及标准化流程。
综上所述,我们需要研发更加有效和广谱的免疫治疗分子标志物。
研究团队的优势
本团队拥有完善的临床、科研人才队伍及研究平台,一直致力于消化道肿瘤的诊治研究,同时也走在免疫治疗临床和转化研究的最前沿。早在2015年,徐瑞华教授于中山大学肿瘤防治中心成立了生物信息学平台,作为国内首个在医疗机构内部成立的生物信息学平台,它为临床问题的转化研究夯实了基础。几年来,团队依据临床医生提出的科学问题,与生物信息学平台和基础研究人员合作,积累了大量肿瘤组织和血液标本的组学数据,产出了一系列科研成果,同时为临床应用的转化提供了有力的支撑。

徐瑞华教授

研究简介一
作为国内多个免疫治疗药物临床试验的牵头者,我们敏锐地发现,尽管MSI-H和TMB能够预测免疫治疗的疗效,但是这些已知指标只是呈现在患者基因组上的特征,溯本求源,MSI-H是DNA修复通路基因异常导致,而患者的突变高负荷也直接反映了肿瘤细胞基因组的异常程度。在DNA复制过程中,参与DNA链延长的DNA聚合酶也具有校对功能,可及时修正复制错误的基因,那么,它们是否也能够影响免疫治疗的疗效呢?
基于以上研究假说,研究团队的王峰副教授和赵齐博士后,通过收集和分析国内外已公开的组学数据,最终锁定DNA聚合酶中两个古老且关键的基因:DNA聚合酶epsilon(POLE)和delta1(POLD1)。这两个基因负责DNA复制过程中遗传信息的准确传递,它们功能的异常会直接影响DNA复制的准确性,从而导致部分MSI-H以及高TMB的发生。
前期仅有个案报道,PD-1抑制剂对携带POLE或POLD1突变的肿瘤患者起效,但缺乏大规模研究和临床试验证据。本团队系统性地分析了已有的免疫治疗研究数据,发现并证明了这两个基因的突变对免疫治疗疗效的影响,最终,研究结果发表于JAMA Oncol杂志。

01 研究结果
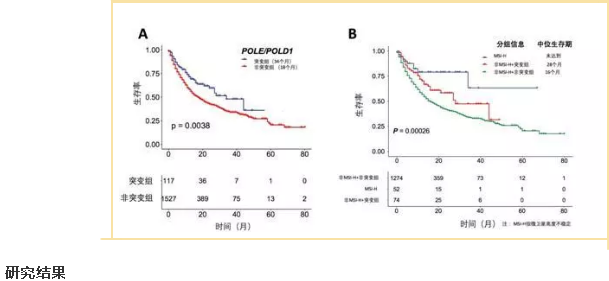
我们团队通过对既往公共数据库的检索,一共收集了47721例肿瘤患者的基因突变数据和生存数据,系统地分析了POLE/POLD1基因突变频率,以及其与TMB、免疫治疗的关系。分析结果表明,在所有患者中,POLE和POLD1基因突变的频率分别为2.79%和1.37%;携带POLE或POLD1突变频率最高的瘤种包括除黑色素瘤外的皮肤肿瘤(16.59%)、子宫内膜癌(14.85%)、黑色素瘤(14.73%)、结直肠癌(7.37%)和膀胱癌(7.21%)。在多种肿瘤中携带POLE或POLD1基因突变的患者,其TMB显著高于未携带者。
在接受了免疫检查点抑制剂治疗的实体瘤患者群体中,携带POLE或POLD1基因突变的患者,总生存(OS)期显著优于未携带者(中位生存期为34个月比18个月,P=0.0038)。26%的POLE或POLD1基因突变患者合并了MSI-H,即使除外这部分MSI-H的患者,评估发现基因突变患者生存获益仍然十分显著(28个月比16个月, P=0.025)。最后,多因素分析证实了,POLE或POLD1基因突变可作为预测免疫检查点抑制剂治疗生存获益的独立指标(P=0.047)。
02 研究意义
该研究首次发现除MSI-H外的泛瘤种免疫治疗指标,这一结果将为免疫治疗的临床应用提供更加精准的指导。
03 投稿经验分享
该文章从投稿到正式发表历时8月余,在这个过程中,除了与杂志编辑的多次讨论和文章的修改,团队更多面对的是西方同行评议对结论的质疑。针对这一问题,我们将研究细节,如数据的记录、分析过程等,悉数整理给审稿人和编辑进行核实,仅第一版回复就有20页纸。最终,我们严谨的逻辑和准确的数据分析得到了认可,团队的研究成果被接收并得以发表。
纸上学来终觉浅,绝知此事要躬行。研究团队并没有止步于此,在发现了POLE和POLD1这两个免疫治疗新的分子标志物后,我们随即开展了相关临床试验,招募POLE和POLD1基因突变且非MSI-H的恶性实体肿瘤患者,以明确POLE和POLD1突变患者在免疫治疗中的获益,从而真正实现免疫治疗的精准化。
研究简介二
几乎同时,研究团队另一项临床研究(NCT02915432):PD-1抗体特瑞普利单抗治疗晚期实体瘤患者的Ib/II期研究,也取得了重要进展。我们知道,PD-1抗体帕博利珠单抗和纳武利尤单抗已分别在美国和日本获批,用于晚期胃癌标准化疗失败后的治疗,但它们的有效率较低,目前尚未找到预测疗效和生存获益的分子标志物,且缺乏中国人群的数据。
我们这项Ib/II期研究共计8个队列,食管鳞状细胞癌(ESCC)和胃癌患者的队列结果已抵达观察终点。基于积累多年的临床经验和成熟的生物信息学研究队伍,团队深入研究了2个队列的肿瘤组织标本的外显子组和转录组数据,不仅从临床的角度证实了PD-1抗体在中国人群中的有效性,而且探索了食管癌和胃癌这两大消化道肿瘤对免疫检查点抑制剂治疗响应的分子标志物。团队成员将胃癌临床数据和组学数据分析整理,研究结果最终发表在Ann Oncol。

01 研究结果
这项探索人源化PD-1抗体特瑞普利单抗在既往治疗失败的实体瘤患者中安全性和有效性的多中心、Ib/II期临床研究,其中晚期胃癌队列共入组58例患者,特瑞普利单抗单药总体有效率为12.1%,与国际同类药物疗效相当。安全性方面同样与国外同类PD-1抗体一致,未见新发不良反应。
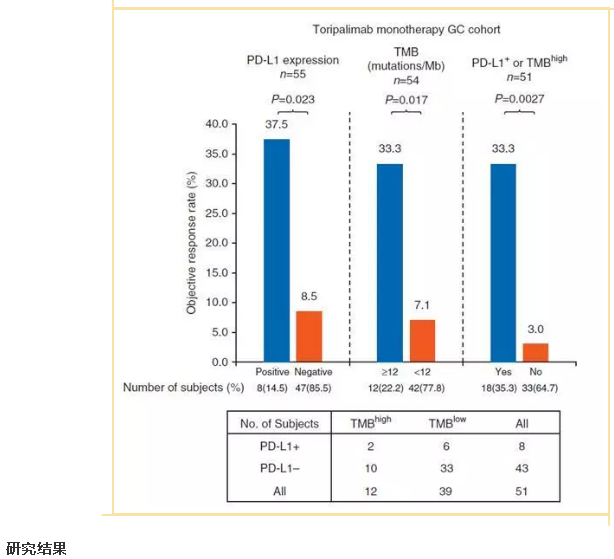
更重要的是,我们团队开展了相关转化研究,探索预测PD-1抗体疗效的标志物。通过对所有患者治疗前的组织标本进行全外显子检测,研究首次发现,在晚期胃癌患者中,TMB是接受PD-1单抗治疗的潜在疗效预测标志物,高TMB患者的有效率(33.3%比7.1%)及总生存时间(14.6个月比4.0个月),均明显优于低TMB患者。与PD-L1表达相比,TMB更能有效地区分出生存获益人群。
此外,本研究也报道了特瑞普利单抗联合XELOX方案,用于初治晚期胃癌一线治疗的疗效和安全性,总共入组18例患者,有效率达66.7%,且安全性良好。本研究提示了PD-1单抗联合化疗在晚期胃癌一线治疗中具有良好的应用前景。
02 研究意义
既往研究仅提示PD-L1表达可能是PD-1单抗在胃癌免疫治疗有效的预测指标,本研究首次在国际上提出,TMB在晚期胃癌患者接受PD-1抗体单药治疗的生存获益预测价值。目前PD-1抗体单药治疗有效率普遍不高,疗效预测指标的探索尤为重要,既能富集有效人群,又避免了不必要的经济损失和药物相关风险。本研究为未来晚期胃癌免疫治疗,临床研究的设计及临床上选择可能从PD-1抗体单药获益的胃癌患者,提供了重要依据。
可喜的是,在ESCC患者队列中,我们不仅证实了特瑞普利单抗治疗晚期ESCC的有效性和可控的安全性,并发现染色体11q13区段的扩增可作为晚期ESCC患者PD-1抗体疗效的负性预测指标,该结果也在2019年美国临床肿瘤学会(ASCO)大会进行了报道。
展望未来
近几年,研究团队在免疫治疗分子标志物的探索之路上取得了一定的成绩,总结经验我们认为,通过组学方法分析并筛选基因标志物,进一步开展机制研究和转化研究,是实现免疫治疗精准化的最佳途径。凭借坚实的临床研究基础和完善的多学科人才队伍,我们将继续在免疫治疗临床和转化研究的道路上前行,希望在不久的未来,实现免疫治疗的新突破。
作者 | 王英男 赵齐 王峰(中山大学肿瘤防治中心)
编辑 | 刘婷(中国医学论坛报)
查看更多