查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者 北京大学肿瘤医院 鄢谢桥 盛锡楠
2020年美国临床肿瘤学会(ASCO)年会泌尿系统肿瘤(肾癌与膀胱癌)部分入选摘要91篇,尿路上皮癌38篇,其中有3项来自中国的临床研究入选。内容上涉及了围手术期治疗,一线治疗,维持治疗、二线及其以上治疗等各方面内容,此外,还有临床生物标志物的探索。现就各部分内容做简单的介绍。
新辅助化疗(neoadjuvant chemotherapy,NAC)在治疗局部晚期尿路上皮癌(locally advanced urothelial cancer,laUC)的效果早就得到了肯定,目前无论是欧洲泌尿学会(EAU)指南还是美国国家癌症综合网络(NCCN)指南,都推荐对于laUC患者进行新辅助化疗。
但是新辅助化疗并非对所有患者都有效,传统ddMVAC方案的病理非肌层浸润率(pathologic non-muscle invasive rate,PaIR,即治疗后≤pT1N0的比例)为49%,P0率(即获得病理缓解者,ypT0N0)为26%。1年DFS率在PaIR者为89%,非PaIR者为67%。
免疫检验点抑制剂(ICI)随即被引入了laUC新辅助治疗,但是,客观缓解率(ORR)仍然欠佳,ABACUS和PURE-01研究中阿替利珠单抗(atezolizumab)和帕博利珠单抗(pembrolizumab)单药P0率分别为31%和37%。此外,还有接近50%的患者不能接受含顺铂方案的新辅助治疗。因此近年来新辅助治疗研究的重点在化疗联合ICI新辅助治疗、不能耐受顺铂者的新辅助治疗、新的NAC方案和疗效预测标志物的探索方面。2020年ASCO大会涵盖了上诉方面的内容。
GU14-188研究旨在评估帕博利珠单抗+吉西他滨在laUC新辅助治疗中的耐受性和疗效。2020年ASCO年会报道了该研究2个队列的更新数据。
队列1(摘要5047)为顺铂可耐受队列,接受吉西他滨+顺铂+帕博利珠单抗方案新辅助治疗。该队列共入组了43例患者,总人群PaIR为61.1%,P0率为44.4%,与基线PD-L1得分无关。PaIR在cT2为53%,cT3/4为74%。中位随访34.2个月,预计的3年无复发生存(RFS)率、总生存(OS)率和疾病特异性生存(DSS)率分别为63%,82%和87%。
与历史对照相比,化疗联合ICI新辅助治疗具有更高的病理缓解率,与纳武利尤单抗(nivolumab)+吉西他滨+顺铂相当,后者的PaIR和P0率分别为66%和49%。
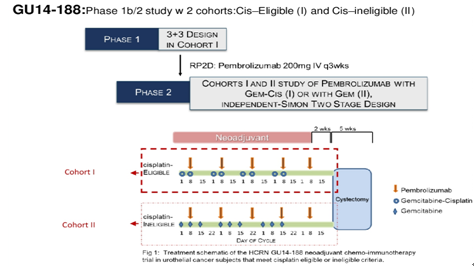

GU14-188研究队列2(摘要5019)为顺铂不能耐受队列,接受吉西他滨+帕博利珠单抗方案新辅助治疗。该队列共入组37例患者,顺铂不能耐受的原因是肾功能不全(49%)、听力降低(30%)、神经异常(12%)。总人群PaIR为51.6%,P0率为45.2%,两者也均与基线PD-L1得分无关。PaIR在cT2者为57%,cT3/4者为47%。中位随访10.8个月,预计的12个月RFS率、OS率和DSS率分别为74.9%,93.8%和100%,3~4级不良反应为84%。
这些数据表明,在顺铂不能耐受的laUC患者中,吉西他滨联合帕博利珠单抗新辅助治疗是可行的,毒性可控,病理降期率与含顺铂新辅助方案相当。但另一方面,与可耐受顺铂新辅助化疗且获得病理学缓解的局部晚期膀胱癌(laUC)患者相比,不能耐受顺铂新辅助化疗的患者预后更差。
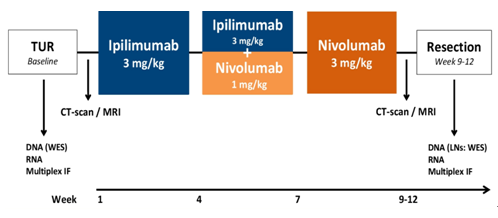
NABUCCO研究(摘要5020)评估了24例不耐受或拒绝含顺铂方案的laUC患者接受伊匹木单抗+纳武利尤单抗新辅助肿瘤的有效性。PaIR率为58%,P0率(ypT0N0)为46%,2例复发的患者均为非病理完全缓解(pCR)者,其中1人死于转移性疾病。3~4级免疫相关不良反应为54%。疗效预测性标志物方面,研究发现,完全缓解(CR)者的肿瘤突变负荷明显更高,非CR者与基线B细胞免疫特征,尤其是免疫球蛋白和B细胞受体信号传导中涉及的基因相关。基线CD8 T细胞、干扰素γ和T效应细胞等基线免疫基因特征方面在CR者和非CR者间无差异。
摘要5030评估了卡巴他赛+顺铂NAC在肌肉浸润性膀胱癌(MIBC)中的安全性和有效性。试验报道了26例可评估患者,中位随访41.5个月,ORR为57.7%,pCR为34.6%。CR及部分缓解(PR)的患者中位PFS期和OS期尚未达到,而在未达到客观缓解的患者中,中位PFS期为7.2个月,中位OS期为16.9个月(P=0.001)。3级或更高不良反应为6.7%。
含铂方案的NAC可获得30~40%的pCR,并转化为生存获益。ICI新辅助治疗可以获得12~46%的pCR,PD-L1过表达似乎pCR更高,但其预测效果尚不明确。
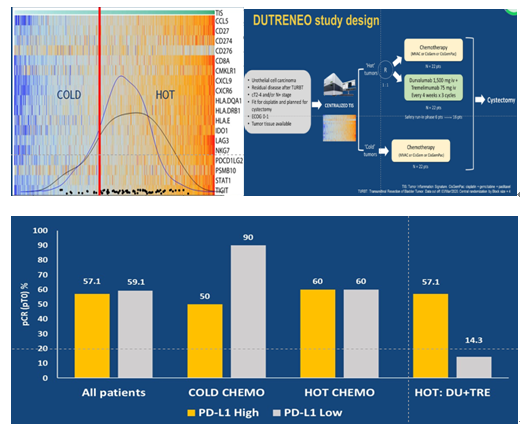
DUTRENEO试验(摘要5012)通过18基因INF-γ特征肿瘤免疫评分将膀胱癌分为冷肿瘤组和热肿瘤组。“热”肿瘤组被随机分配接受durvalumab+tremelimumab(23例)或标准含顺铂化疗(GEMCIS或MVACdd,共22例), “冷”肿瘤组接受了标准化疗(16例)。三者的ORR分别为34.8%、36.4%和68.8%。“冷” TIS组中有更多的PDL1低肿瘤(83.3%对50%)。化疗组中3~4级毒性反应更多,三组发生率分别为21.7%、36.4%和62.5%。通过IFN-γ免疫特征并不能筛选出更能从免疫治疗中获益的人群。这是针对MIBC患者接受NAC+RC治疗后复发转移风险、并对复发风险因素进行量化的最大的临床研究。使用的基于顺铂的NAC方案不是复发的独立预测因子。
2019年ASCO年会公布的SWOG S1314研究结果显示,COXEN化疗特异性评分基因表达模式对各治疗组反应率没有的预测作用,2020年ASCO年会公布了不同的分子分型的预测作用。
在预测pT0和病例降级(<pT2)方面,TCGA 3分类、TCGA分型和GC Coxen评分均未达到显著性差异。基于TCGA和MDA分型的Consensus分型(BS/NE-like,Lumina和Strmoa-rich)可以预测预测病理降级(47.2%对57.8%对44.0%,P=0.044)。COXEN评分、亚型与总生存之间的关系需要进一步的评估。
摘要号5050研究采用MSK-IMPACT肿瘤测序(多达468个基因),主要终点是治疗时间(TOT)。反应差被定义为TOT≤9周,OS期≤3个月,非凡响应者的TOT为>20个月。反应差的和反应佳分别为24例患者(14%)。在单因素分析中,肝转移与DNA损伤修复(DDR)基因突变与TOT缩短有关,更高的体重指数(BMI)、eos、hgb和肿瘤突变负荷(TMB)与更长的TOT相关。没有特定的基因组改变达到P<0.05。在多变量模型中,既往化疗[风险比(HR)为1.6,P=0.01]、肝转移(HR为2.4,P<0.01)、尿道原发时(HR为0.1,P<0.01)、较高的TMB(HR为0.9,P<0.01)和较高的eos(HR为0.1,P<0.01)与TOT独立相关。
MIBC NAC后的pCR与长期总体生存率密切相关。摘要号5043研究报道了病理反应深度(pT0,pTa,pTis,pT1)、临床病理因素与复发风险的数据。研究入组了9个国际中心506例获得<ypT2N0的患者,中位随访2.6年, 43例患者(8%)复发,中位TTR为56周(范围7-251);五年无复发生存率为87%。与ypT0相比,ypTa[HR为3.36(1.24~9.11)]和ypT1[HR为2.88 (1.33~6.22)],P=0.013)有更高的复发风险,ypTis复发风险无增高[HR为1.25(0.55~2.84)]。女性复发风险较低[HR为0.52(0.27~0.98)],P=0.043)。NAC的类型不能预测TTR[GC对其他,HR为1.49(0.75~2.97),P=0.26]。
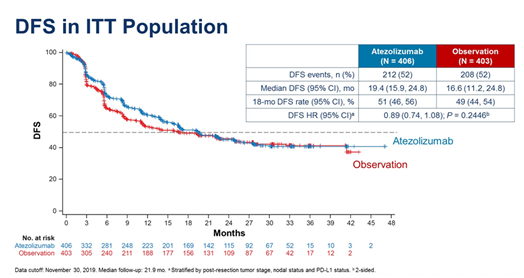
辅助治疗方面,2020年ASCO年会公布了III期辅助研究IMvigor010的数据。该研究入组的是新辅助化疗后ypT2-4a±ypN(+)或未新辅助化疗pT3-4a或pN(+),且不能耐受或拒绝含顺铂方案辅助化疗的患者,按1:1随机至阿替利珠单抗1200 mg IV q3w组或观察(obs)组。两组患者中NAC分别占48%和47%,UTUC分别为 7%和6%,伴淋巴结转移者均为48%。
中位随访时21.9个月,中位DFS期分别为19.4个月和16.6各月(HR为0.89,95%CI为0.74~1.08,P=0.245),中位OS均未达到,事件数分别未118例和124例(HR为0.85,95%CI为0.66~1.09,P=0.195)。基线预后/临床因素(包括PD-L1)不影响DFS tx获益。 16%的经阿替利珠单抗治疗的患者发生G3~4治疗相关的不良反应(AE)。皮肤和胃肠道毒性最常导致TX停用的原因。

一直以来,由于高危肌层浸润性膀胱癌术后虽推荐应用辅助化疗,但缺乏Ⅰ类循证依据,另外还有接近50%的患者由于肾功能减退,无法应用顺铂为基础的化疗。IMvigor010研究、CheckMate274研究、AMBASSADOR研究等ICI辅助治疗的结果备受关注。
遗憾的是,首先公布的IMvigor010的研究结果并未达到主要研究终点DFS。阿替利珠单抗治疗组有16%的患者停药,33%的患者治疗中断,这个因素是否有影响尚不可知。治疗组和观察组相比HR值为0.89(95%CI为0.74~1.08),其他ICI辅助治疗仍值得期待。
另外需要注意的是IMvigor010研究中膀胱癌患者占93.3%,上尿路癌仅占6.7%(54例),POUT研究已证实高危进展型上尿路癌术后辅助化疗能延长患者的DFS。因此,未来对于上尿路癌患者队列的辅助免疫治疗的RCT研究仍然值得期待。
mUC的一线治疗目前仍以含顺铂的化疗方案为主,对于顺铂不能耐受的患者预后较差。2020年ASCO年会公布了enfortumabvedotin(EV)一线治疗顺铂不能耐受患者的数据(摘要号5044,EV301研究)。
EV由mUC表面常见分子Nectin-4的单克隆抗体和微管破坏剂MMAE组成的抗体偶联药物。该药物的I期研究EV 101和II期研究EV201研究的最终结果近期均在《临床肿瘤学杂志》(JCO)上公布,对于既往多线治疗失败的患者,EV单药治疗的ORR高达43~44%,中位PFS期和中位OS期分别长达5.4~5.8个月和11.7~12.3个月。
EV301研究将EV联合帕博利珠单抗方案推进至顺铂不能耐受患者的一线治疗。中位随访11.5个月,经研究者评估的确诊ORR为73.3%(CR15.6%),疾病控制率(DCR)为93.3%。肝转移患者占33%,ORR为53.3%,PD-L1高表达和低表达者ORR分别为78.6%和63.2%。中位DOR未达到,12月DOR率为53.7%。PFS中位数为12.3个月。中位OS未达到,12月OS率为81.6%。
不良反应方面,≥3级TRAE为58%(单药为54%),所有等级及≥3级外周神经损伤为49%和4%(既往单药方案为40%和2%),皮疹分别为31%和9%(既往单药方案为22%和4%)。总体而言,EV+帕博利珠单抗在1线顺铂不耐受患者中显示出令人鼓舞的抗肿瘤效果,安全性可控。
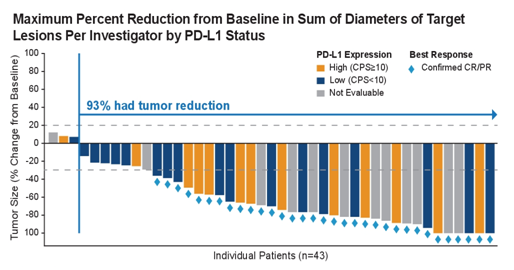
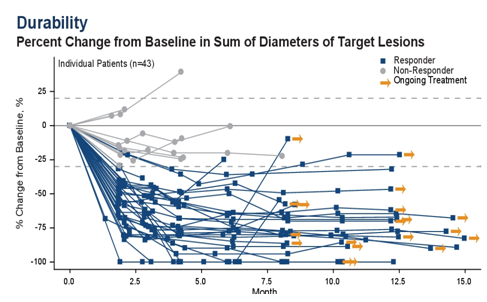

从2019年ASCO年会的HCRN GU14-182研究开始,维持治疗逐渐进入mUC的治疗格局。
2020年ASCO年会公布的JAVELIN Bladder 100研究,旨在探索mUC一线含铂化疗结束后avelumab维持治疗的生存获益。该研究共入组700例患者,经过4~10周洗脱期后按1:1随机分配至avelumab组(10 mg/kg q2w)或最佳支持治疗组(BSC)。直至出现疾病进展、不能耐受的药物毒性或撤回知情。主要终点为OS,次要终点包括PFS、ORR、药物安全性及患者报告结局(PROs)。
中位随访19+个月,avelumab组相对于BSC组中位OS显著延长(21.4个月对14.3个月,HR为0.69,95%CI 0.56~0.86,P<0.001),12个月、18个月的OS率分别是71%对58%,61%对44%,avelumab+BSC组明显优于BSC组。
从亚组分析的森林图可以发现,年龄<65岁、PS=1、入组时存在内脏转移和PD-L1阴性,这些亚组患者应用avelumab+BSC较单纯BSC的获益没有显著性差异;肌酐清除率水平和既往一线化疗方案(顺铂或卡铂)对avelumab获益不影响,均显著获益。
两组患者mPFS分别为3.7个月和2.0个月(HR为0.62,95%CI为0.52~0.75,P<0.001)。12月PFS率分别是30%对13%,avelumab+BSC组明显优于BSC组。ORR分别为9.7%对1.4%,PD-L1+人群为13.8%对1.2%,DCR分别为41.1%对27.4%,PD-L1+人群为43.9%对27.8%安全性方面,治疗组AE发生率为98%,3级以上AE发生率为47.4%,与先前avelumab单药治疗研究数据一致。
本研究与HCRN GU14-182研究中帕博利珠单抗维持治疗的结果相似,均证实了ICI药物维持治疗的临床获益,或将影响mUC一线治疗后的治疗格局。
Rogaratinib是一种口服的泛FGFR抑制剂,2019年《柳叶刀·肿瘤学》(Lancet Oncol)报道了rogaratinib的I期研究最终数据,对于mUC患者,ORR为24%(均为PR),DCR为73%。
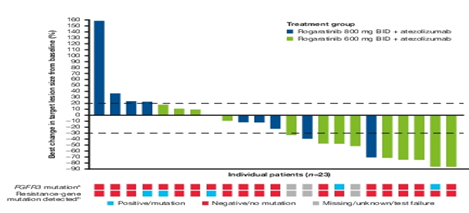
2020年ASCO年会报道了rogaratinib联合阿替利珠单抗的Ib期研究结果(摘要号5014)。研究共入组了27例顺铂不能耐受的初治疗mUC患者,要求通过RNA原位杂交技术检测到高FGFR1或3 mRNA,接受rogaratinib 800 mg BID,阿替利珠单抗1200 mg d1,q21d的初始治疗。
最常见的治疗急诊不良事件(TEAE)是腹泻(63%),高磷酸盐血症(44%)和尿路感染(37%),既往报道的单药组分别为51%,61%和17%。视网膜色素上皮脱离为4%。停药比例分别为45.5%(800 mg)和12.5%(600 mg)。最常见的3/4 TEAEs为无症状炎的脂肪酶升高(11%),皮疹和丙氨酸氨基转移酶(各7%),既往单药分别为7%,0%和3%。最大耐受剂量(MTD)为rogaratinib 600 mg BID。在可评估的23个病人中(rogaratinib 600 mg,n=13; 800 mg,n=10),ORR为39%,CR率为13%,DCR为65%。

摘要号5015研究还报道了erdafitinib的长期疗效和安全性数据。中位随访24个月,确认的ORR是40%。 DOR中位数为5.98个月; 31%的反应者DOR≥1年。中位PFS为5.52个月,中位OS期为11.3个月。 12个月和24个月OS率分别为49%和31%。安全性与初步分析一致。随访时间延长,没有新的TRAEs的。中枢性浆液性视网膜病变(CSR)事件发生率27%,其中85%为1级或2级。剂量降低13人,中断8人,停药3人。在数据截止时, 63%的不良反应(17/27)得到缓解; 60%(6/10)的CSR是1级。没有与治疗相关的死亡。总之,在中位随访2年的数据中,ERUC在FGFR 突变mUC患者中显示出可控的安全性和持续的疗效。目前,ERDA单药方案对比联合CIC或化疗的随机对照研究正在进行中(THOR; NCT03390504)。
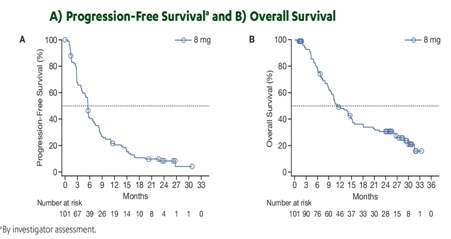

摘要5038报道了infigratinib在不同治疗线数的相关临床数据。其中接受infigratinib一线治疗者为19.4%(13/67),一线infigratinib、非一线infigratinib和总人群的ORR分别为25%、31%和24%,DCR分别为64%、69%和46%。两者患者的中位PFS分别为3.65个月和3.75个月,中位OS期分别为7.93个月和7.75个月。膀胱癌患者接受infigratinib一线和非一线治疗的ORR分别为31%和20%,8例上尿路癌患者均接受infigratinib非一线治疗,ORR为50%,DCR为100%。
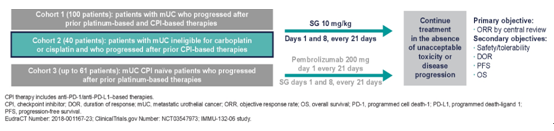
2019年欧洲肿瘤内科学会(ESMO)年会公布了TROPHY-U-01队列1的初步数据,35例铂类和CPI治疗失败的mUC患者接受sacituzumab govitecan(SG,滋养细胞表面抗原2与拓扑异构酶SN-38的抗体偶联药物)治疗。其中内脏转移为63%;肝脏转移为23%,中位既往治疗线数为3,ORR为29%,与治疗相关的≥3级主要不良事件:中性粒细胞减少症(23%),贫血(17%),发热性中性粒细胞减少症(11%),腹泻(11%)。
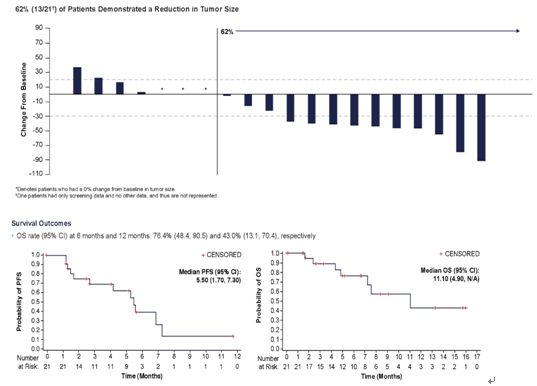
2020年ASCO年会公布了研究队列2的初步数据(摘要号5027)。该队列入组了18不能耐受铂类治疗,且一线免疫治疗失败的患者。内脏转移为67%;肝脏转移为28%,中位既往治疗线数为2,中位随访6个月,ORR为28%(5/18),大多数患者(61%[11/18])有靶病灶缩小。≥ 3TRAE为中性粒细胞减少症(39%),疲劳(33%),腹泻(28%),白细胞减少(22%),贫血(17%)和发热性中性粒细胞减少症(11%)。这些数据表明,SG在顺铂不能耐受患者的非一线治疗中安全性、有效性和队列1一致。
此外,摘要5048公布了EV失败后的后续治疗的相关数据。研究纳入了6个机构共63例患者,EV失败后仅52%的患者接受后续治疗,分别为:试验治疗14例,PD1 /L1抑制剂7例,培美曲塞4例,紫杉烷3例,卡铂2例和未知2例,ORR为9.4%。接受后续治疗和未接受者的中位OS期分别为37.5周和分别为12周。
卡博替尼是MET,AXL和VEGFR的抑制剂,可以改善免疫微环境,与ICI联合在多种实体肿瘤中显示出极具前景的的临床活性。
摘要5013报道了30例mUC患者接受卡博替尼联合阿替利珠单抗治疗的初步数据。原发肿瘤部位是膀胱(80%),肾盂(10%)和输尿管(10%);最常见的转移部位包括肺(40%)和肝脏(27%)。ECOG PS 1分占60%,既往接受过≥2线治疗者占47%。
中位随访16.5个月,ORR为27%(CR6.6%),DCR为64%。DOR尚未达到,最长者大于14.3个月。中位PFS期为5.4个月。常见的与治疗相关的AE(TRAE)为虚弱(37%),腹泻(27%),食欲下降(23%),转氨酶升高(23%)和黏膜炎症(20%)。 3/4级TRAE发生率57%,没有5级TRAE。
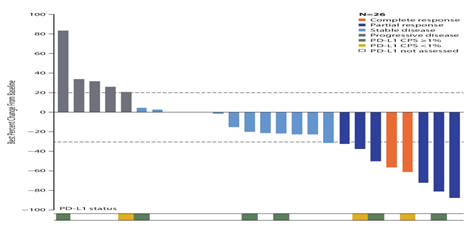

摘要5037报道了29例mUC患者接受卡博替尼+纳武利尤单抗联合治疗的初步数据。原发性部位膀胱占72.4%,上尿路为27.6%。内脏转移75.9%,肝转移44.8%。中位既往治疗线数为2(范围0-8),58.6%的患者既往接受2线治疗。大多数患者(86.2%)既往接受过化疗,所有患者既往均接受过ICI治疗。
中位随访14.1个月,ORR为13.8%(均为PR),疾病稳定(SD)15例(51.7%),疾病进展(PD)7例(24.2%)和NE3例(10.3%)。在4例PR患者中,先前ICI治疗2例无效,2例SD。中位DOR未达到, PR患者1例刚开始,另2例已维持12.3个月和26.4个月。在15例SD患者中,有4例的SD超过6个月,其中2例超过8.1个月和25.1个月。中位PFS为3.6个月,中位OS为10个月。
TRAE为97%,≥3级为48%。最常见者为疲劳(14%),低磷血症(14%),淋巴细胞计数减少(14%),高血压(7%)和低钠血症(7%)。这些数据表明,卡博替尼联合纳武利尤单抗在既往含ICI治疗失败的mUC也是安全有效的。
对于卡博替尼+纳武利尤单抗或卡博替尼+纳武利尤单抗+伊匹木单抗治疗进展的患者,摘要号5039研究报道了再次伊匹木单抗治疗的有效性数据。卡博替尼+纳武利尤单抗组共18例患者[8例UC,4例透明细胞肾细胞癌(RCC),3例尿道腺癌,2例膀胱腺癌和1例肉瘤样透明细胞RCC]。中位随访21.2个月,一名患者在LN中获得了PR,但出现脑转移,另外13例SD,4例PD。中位PR或SD持续时为3.6个月,mOS为13.9个月,mPFS为4.6个月。
卡博替尼+纳武利尤单抗+伊匹木单抗组共有 6例患者(3例膀胱UC,1例阴茎鳞状细胞癌,1例尿道SCC和1个具肉瘤样特征的透明细胞RCC),中位随20.9个月,3例SD, 3例PD。中位OS期4.0个月, 中位PFS期是1.9个月。
总体而言,卡博替尼+纳武利尤单抗或卡博替尼+纳武利尤单抗+伊匹木单抗治疗失败后接受伊匹木单抗治疗的ORR低,卡博替尼+纳武利尤单抗组中位OS期相对更长,或可进行尝试。
摘要号5086的研究评估了tipifarnib在HRAS突变的mUC患者中的治疗效果。共筛查224例无其他治疗方案可供选择的患者,HRAS错义突变16例(7%),分别为G13R,7例;Q61R,4例;G12S,3例;G12C,2例,STK11:rs2075606携带者104例(46%)。中位随访28个月,ORR为24%(错义突变4例和移码HRAS突变1例),中位PFS和OS分别为4.7个月和6.1个月。HRAS野生型肿瘤患者中未观察到反应。安全性方面,≥10%的3级及以上不良反应包括粒细胞减少(19%),贫血(38%),血小板减少(30%),皮肤(14%),恶心(10%),tipifarnib对HRAS突变难治性mUC显示出令人鼓舞的,不良反应可控。
摘要号5017的PEANUT研究报道了帕博利珠单抗联合纳米紫杉醇治疗mUC的初步数据,共入组了65例患者。其中二线治疗者75%,三线者为25%;ECOG 1者35%;有肝转移33%。中位TMB为6.9 mut / Mb。中位随访5.5个月,中位PFS期为5个月。3个月PFS率为60.7%(95%CI为49.8%~74.1%)。ORR为47.7%,CR率为13.8%。中位DOR未达到,≥12月者共有4例。最常见的的TRAE包括脱发(76%),中性粒细胞减少(33.3%)和乏力(33%)。3级TRAE为30.7%。单因素分析中TMB和CPS均未显示出与PFS有相关性。在肿瘤/血液匹配样本中,ORR在PI3KCA突变中为80%(8/10); RB1突变中为60%(6/10),DNA损伤修复基因突变中为41.7%(5/12)。帕博利珠单抗+纳米紫杉醇是第一个在mUC非一线治疗中表现出较高ORR和PFS的免疫联合化疗方案,研究筛选的生物标志物值得进一步试验数据证实。
SAUL研究报道了101例ECOG PS 2分的患者接受阿替利珠单抗治疗的相关情况(摘要号5035),较ECOG PS0/1患者,该类患者中位OS期更短,分别为2.3个月和10个月,ORR及DCR更低,分别为5%对15%及14%对43%。尽管ECOG PS 2的年龄与0/1分相似,但具有较高预后因素的比例较高(内脏转移52%对36%,贫血 32%对13%,低蛋白血症47%对21%和Alp升高45%对23%),这表明较差的PS可能与疾病而不是合并症有关,在治疗高肿瘤负荷/内脏疾病ECOG PS 2患者时应特别谨慎风险/利益评估。
SAUL研究还评估了肾功能不全的患者(摘要号5036),按Ccr分为三组,不耐受化疗组(Ccr 15~30 mL/min);不耐受顺铂但能耐受卡铂(Ccr 30~60 mL /min);或耐受顺铂(CrCl≥60 mL/min),三组分别为46例、420例和529例,Ccr较低组中老年患者更多(中位年龄分别为75岁、72岁和63岁),女性更多(分别为33%、27%和18%),ECOG评分更低(0分者分别为22%,40%和47%),既往治疗线数更少(初治者分别为28%,35%和42%)。但在校正其他因素影响后这些差别并不具有统计学意义。
三组患者中位治疗时间相当,分别为3.0个月、2.8个月及2.8个月,不良反应发生率也大致相当,分别为83%、76%和79%。Ccr<30 mL/min组OS稍差(三组分别为5.7个月、8.5个月及9.4个月),但PFS,ORR和DOR三组间没有明显的差异,分别为3.3对2.2对2.3月,13%对15%对13%及46%对43%对37%。这些事后分析表明顺铂或CT不能耐受的患者都可以接受阿替利珠单抗治疗。肾功能不全的患者与CrCl≥ 60 mL/min者相似的ORR和DCR,而毒性没有增加。不同亚组病人基线特征的差异可以解释OS中的数值差异。
摘要号5032研究中,美国犹他大学亨斯迈癌症研究所Umang Swami 教授报告了真实世界CIC的二线使用情况。共收集Flatiron Health数据库2016年8月至2019年10月的患者703例。其中阿替利珠单抗为322例,纳武利尤单抗为127例,帕博利珠单抗为254例,德瓦鲁单抗(durvalumab)和avelumab患者因数量太少未纳入。中位随访4.8个月,三组患者中位OS相似(6.4月对8月对8.5个月,P=0.34)。阿替利珠单抗的比例逐渐降低,帕博利珠单抗逐渐升高,纳武利尤单抗先升高后降低(P<0.001)。
2020年ASCO大会泌尿肿瘤部分入选了3项来自中国的研究。
摘要5040更新了Polaris-03研究中接受特瑞普利单抗治疗mUC的数据。截至2020年1月6日,共纳入15家中心的151例患者,中位年龄为62岁,其中66%为男性,87%的患者发生内脏转移。在IRC评估的148位患者中,ORR为25.7%, DCR为45.9%。中位DOR为15.7个月。中位PFS 为1.9个月,中位OS估计为20.8个月。 46例PD-L1 +患者的ORR显着优于95例PD-L1-患者(41.3%对16.8%,P<0.01)。TRAE为92.1%(≥3级为35.8%),最常见的TRAE包括贫血,甘油三酸酯增加,蛋白尿,疲劳和高血糖症。总体而言,特瑞普利单抗治疗非初治mUC安全有效,值得期待进一步OS数据。
2019年ASCO大会报道了RC48-ADC在HER2阳性患者中的相关临床数据,该研究中部分HER2免疫组化阳性(IHC 2+),但FISH检测阴性的患者仍有获益。2020年ASCO年会报道了RC48-ADC在HER2阴性(IHC 0-1+)患者的安全性和有效性。截至2020年2月,该研究招募了8例患者。中位年龄为65岁。大多数患者(6/8)有内脏转移。 6例患者(75%)接受了≥2线既往治疗,4例患者(50%)既往接受过ICI治疗。总体ORR为25%(2/8),其中内脏转移患者ORR为33.3%(2/6),肝转移患者ORR为50.0%(2/4),≥2线治疗后患者ORR为33.3%(2/6),ICI失败后者ORR为25%(1/4)。DCR为75%(6/8)。常见的TRAE为AST增加(62.5%),ALT增加(50.0%),恶心(50.0%),白细胞减少症(37.5%),疲劳(37.5%),呕吐(37.5%),感觉不足(25.0%),脱发(25.0%)和中性粒细胞减少(25.0%)。这些AE大多为1级或2级。3级AE是中性粒细胞减少症(12.5%)。 这些数据表明,HER阴性mUC患者接受RC48-ADC治疗是安全的,并可在非一线治疗中获得25%的ORR。
摘要5085报道了卡瑞利珠单抗联合法米替尼(famitinib,针对VEGFR-2,PDGFR的酪氨酸激酶抑制剂)治疗非初治泌尿系统肿瘤的初步数据。共入组mRCC为25例,mUC10例,中位随访时间大于6月,mRCC组和mUC组的ORR分别为52.0%和30.0%,DCR分别为84.0%和70.0%。中位DOR未达到。最常见的3-4级TRAE是高血压(17.1%),蛋白尿(11.4%),血小板计数减少(8.6%),手足综合征(8.6%)和贫血(5.7%)。免疫相关不良事件(irAE)为20%,3级肠炎1例(2.9%)。总体而言,卡瑞利珠单抗+法米替尼的初步数据显示该方案在非初治mRCC和mUC中显示出与同类药物相当的效果,不良反应可控,值得期待更大样本量的临床疗效和安全性数据。
小结
以上为大家解读了2020ASCO年会当中尿路上皮癌相关的临床研究结果。
在尿路上皮癌的治疗蓝图中,免疫治疗逐渐推进到了新辅助治疗、辅助治疗、一线治疗和维持治疗等各个阶段。FGFR抑制剂、ADC等新型药物联合治疗的临床试验初步结果也开始公布,结果值得期待。
令人欣喜的是,来自中国的临床试验也开始登上了世界舞台,并涉及到免疫治疗、ADC药物,免疫靶向联合等新领域,做出了为业界认同的临床试验结果。
查看更多