查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





张晶 教授
主任医师,教授,博导
肝病中心三科主任,脂肪性肝病诊疗暨减重中心主任
中华医学会肝病学分会脂肪肝/酒精性肝病及药物性肝损伤学组学组委员
中国研究型医院学会肝病专业委员会脂肪肝与酒精肝学组委员
北京医学会肝病学分会常委兼秘书
北京医学会健康管理学分会常委
北京预防医学会肝病预防与控制专业委员会副主任委员
GCGR/GLP-1R双重激动剂在MASH中的作用机制及其独特优势
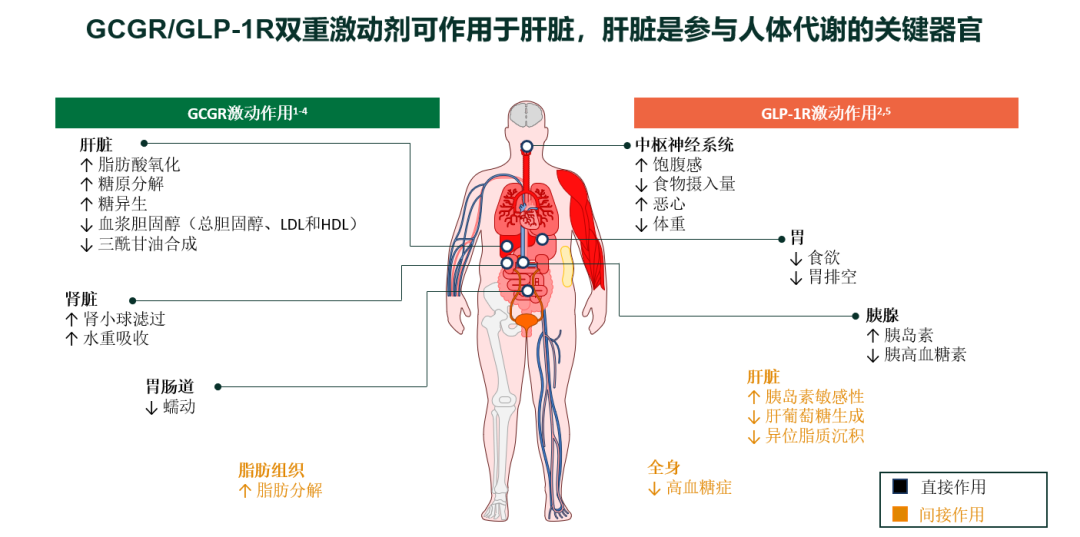
图1. GCGR/GLP-1R双重激动剂在MASH中的作用机制
Survodutide在MASH伴肝纤维化(F1-F3期)患者中的II期临床试验
MRI-PDFF:磁共振质子密度脂肪分数;Survodutide尚未获批用于治疗肥胖或MASH
表1. 研究受试者的基线特征
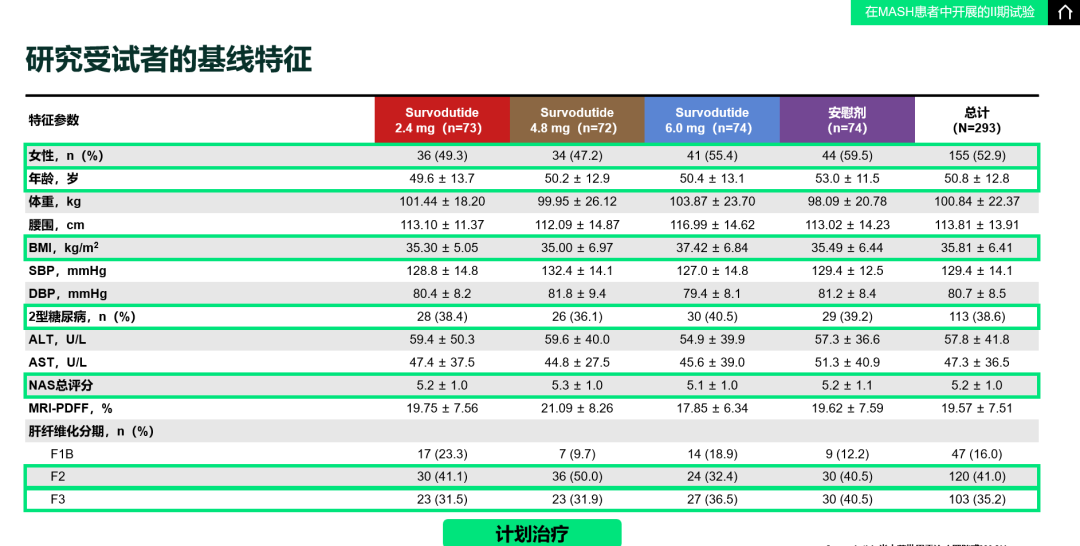
图3. 主要终点结果
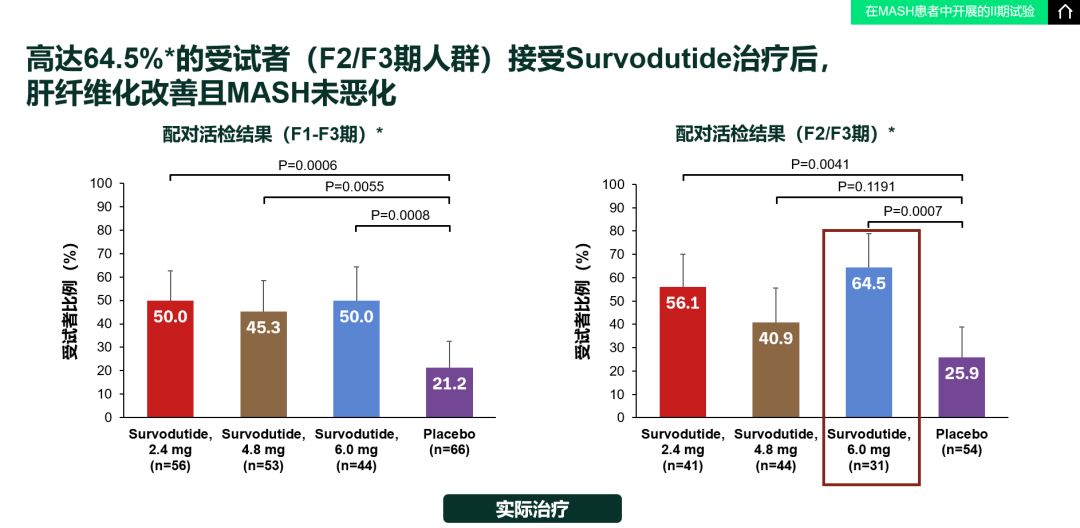
图4. 肝纤维化改善且MASH未恶化结果
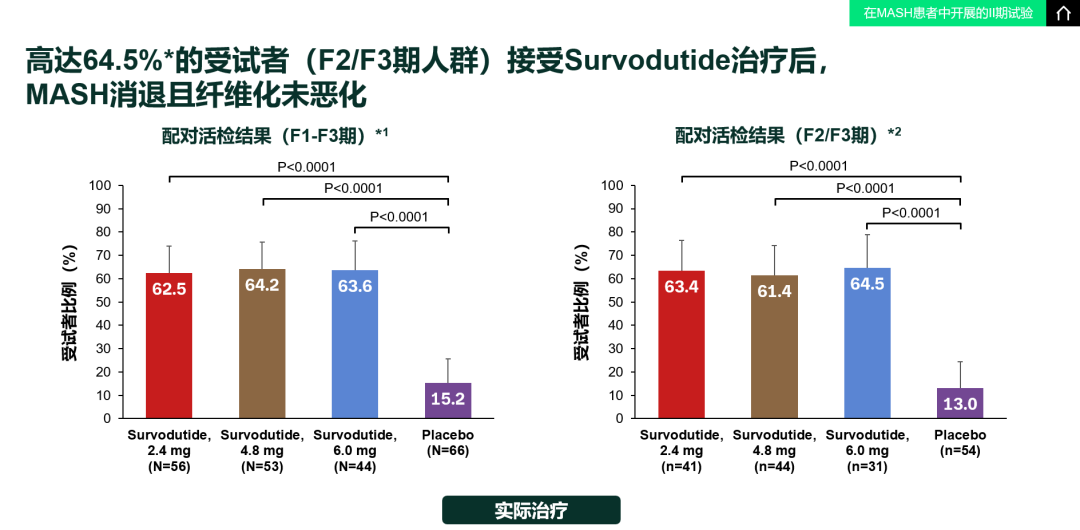
图5. LFC改善结果
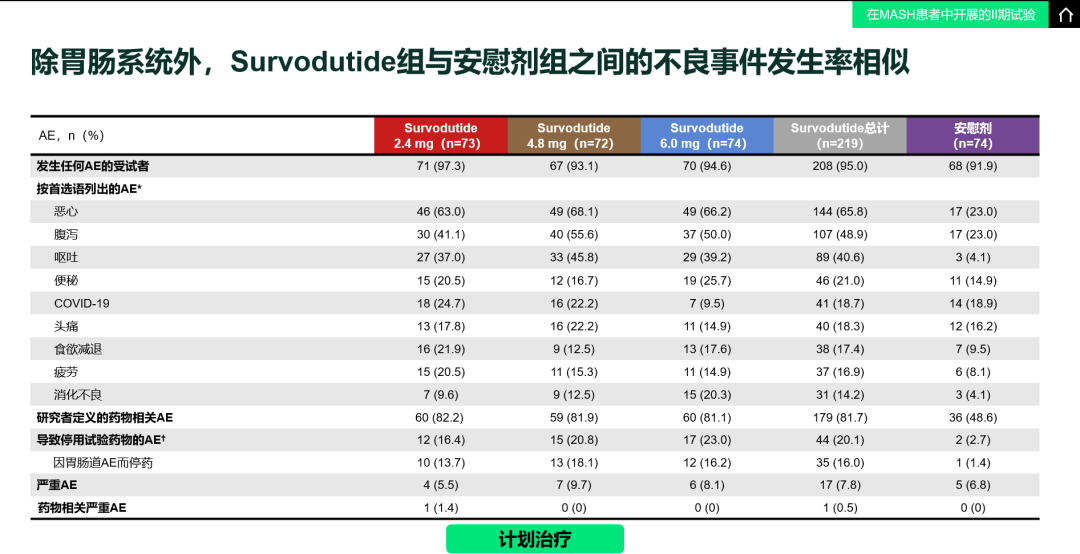
表2. AE发生率
Survodutide在MASH患者中的全球III期临床试验——LIVERAGE项目
图6. LIVERAGE项目概述
图7. LIVERAGE研究设计流程图

图8. LIVERAGE-肝硬化研究流程图
会场花絮
审批号:SC-CN-16662
有效期至:2026年4月16日
仅供相关医药专业人士进行医学科学交流
PART
↓↓↓
查看更多