查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





Nakagawa K, Ishihara R, et al.Classification for invasion depth of esophageal squamous cell carcinoma using a deep neural network compared with experienced endoscopists, Gastrointestinal Endoscopy (2019).

▌背景和目的
食管癌是第八常见的癌症和第六常见的癌症相关死亡原因,虽然食管腺癌在欧洲和北美的发病率正在迅速增加,但鳞状细胞癌(SCC)仍然是最常见的肿瘤类型,占全球食管癌的80%。食管切除术一直是食管鳞癌的主要治疗手段,但该手术死亡率、发病率高,而内镜下切除(ER)为浅表食管鳞癌提供了一种微创的治疗方法。在选择合适的治疗方法时,必须考虑患者的病情、病变的大小和肿瘤浸润深度等因素。在这些因素中,肿瘤侵入深度最为重要,浸润200µm(SM1)的上皮层(EP) /粘膜固有层(LPM)和粘膜肌层(MM)/粘膜下肿瘤由于其相对较低(< 10%)的转移风险是ER的适应证,而食管切除术通常用于SM2/3的肿瘤,因其转移风险超过25%。因此,术前对肿瘤浸润深度的诊断应区别EP-SM1和SM2/3至关重要。非放大内镜(non-ME)、放大内镜(ME)和EUS目前用于诊断食管浅表鳞状细胞癌的浸润深度。然而,使用非ME的诊断是基于肿瘤的突出、凹陷和硬度,这是主观的,容易受到观察者之间的变化。深度学习是一种广泛的机器学习模型和方法的综合表达,通常基于人工神经网络,其目的是学习数据的多级表示形式,有助于做出预测或分类。这项技术已经被证明在视觉任务(如玩围棋和物体识别)方面的表现优于人类。近年来,它已被应用于皮肤癌的分类、糖尿病视网膜病变的诊断、胃肠道病变的检测等医学领域。本研究旨在开发一种利用深度学习诊断食管浅表鳞状细胞癌浸润深度的计算机图像分析系统。
▌研究方法
针对食管浅表鳞状细胞癌的诊断,我们提出了一种基于单镜头多盒探测器结构的有深度学习基础的人工智能(AI)系统。我们获取了2005年12月至2016年12月在我处行检查的患者内镜图像。纳入标准为食管浅表鳞状细胞癌行ER或食管切除术且病理证实癌浸润深度的患者。训练图像包括标准白光图像、NBI图像和碘溶液染色内镜图像。排除标准如下:重度食管炎患者,有食管化疗或放疗史的患者,溃疡或溃疡瘢痕附近的病变,以及由于空气注入较少、出血、晕光、模糊、散焦或粘液而导致的低质量图像。经过筛选后,选取804例经病理证实的食管浅表鳞状细胞癌患者的8660张非ME图像和5678张ME图像作为训练数据集。根据切除标本的病理诊断分为病理(p) EP/LPM、pMM、pSM1和pSM2/3。然后由通过日本胃肠内窥镜学会认证的培训师用矩形框架手工对它们进行标记。在本研究中,我们分别为非ME和ME构建了两个独立的卷积神经网络(CCNs)。使用Caffe深度学习框架对CNN进行培训、验证和测试。利用食管浅表鳞状细胞癌患者的独立验证数据集对基于深度学习的人工智能系统进行评估。最后将人工智能系统的性能与来自日本胃肠内窥镜学会的16名认证专家(经验丰富的内窥镜医师)进行比较。主要观察指标为诊断准确性、敏感性、特异性、阳性预测值(PPV)、阴性预测值(NPV)、诊断时间。观察者间诊断癌症浸润深度的变化的评估使用κ统计。
▌结果及结论
804例经病理证实浸润深度的食管浅表鳞状细胞癌的8660例non-ME和5678例ME图像作为训练数据集,155例患者的405例非ME图像和509例ME图像作为验证集,我们的系统显示的敏感性为90.1%,特异性为95.8%,阳性预测值为99.2%,阴性预测值为63.9%,对病理粘膜及粘膜下微浸润癌(SM1)与粘膜下深部浸润癌(SM2/3)的鉴别准确率为91.0%。16名经验丰富的内镜医师使用相同的验证集对肿瘤浸润深度进行诊断,总体敏感性为89.8%,特异性为88.3%,阳性预测值为97.9%,阴性预测值为65.5%,准确率为89.6%。
因此本研究认为该新开发的人工智能系统在诊断食管浅表鳞状细胞癌侵犯深度方面表现良好,与经验丰富的内窥镜医师性能相当。
▌讨论
在本研究中,我们开发了AI系统来区分EP-SM1和SM2/3癌症,因为这两类癌症的治疗策略不同。此外,还设计了诊断食管鳞癌浸润深度的非ME和ME诊断标准,以区分EP-SM1和SM2/3癌,我们也成功地通过改变训练算法开发了区分M型和SM型癌症的AI系统。这两种系统在诊断肿瘤浸润深度方面均表现出良好的性能,我们有可能通过提供许多内镜训练图像和相应的组织学结果来开发各种人工智能系统。然而,以往关于肿瘤浸润深度诊断的研究存在较高的偏倚风险,尤其是在患者选择方面。因此,我们使用相同的验证数据,将人工智能系统与经验丰富的内窥镜医生的诊断准确性进行了比较,并证明了人工智能系统与经验丰富的内窥镜医生具有相当的准确性。
经验丰富(≥16年)的内窥镜医师的诊断能力优于经验不足(<16年)的内窥镜医师,这一事实证实了对专业知识的需求。人工智能系统诊断正确率为91.0%,有较长经历的内窥镜医师诊断正确率为91.0%,有较短经历的内窥镜医师诊断正确率为87.7%。值得注意的是,人工智能系统的诊断性能与经验较长的内窥镜医师相当。此外,人工智能领域也有很多创新,包括语义分割,它为图像分类提供像素级标记。这代表了一种潜在的重要的图像识别技术,因为每个像素都被标记为属于一个给定的语义类。因此,我们希望通过实施该方法或积累更多的训练数据,进一步提高诊断的准确性。
人工智能系统在非ME诊断方面表现良好。然而,非ME图像对肿瘤浸润深度的诊断是基于肿瘤的突出、凹陷和硬度,具有主观性,易受观察者间变异性的影响,降低了其可靠性,阻碍了其在肿瘤浸润深度诊断中的应用。相比之下,人工智能系统可以提供一个客观的诊断,从而通过产生一个明确的诊断来克服这种可变性。然而在本研究中,NBI/BLI系统对ME的诊断性能不如非ME图像,这可能是由于NBI/BLI训练图像量较低,且肿瘤浸润深度分布不平衡所致。在为ME和MM或更深层次的癌症积累了更多的训练数据之后,预计会有进一步的改善。
这是一项回顾式的研究,使用静态图像,并使用高质量图像进行验证,有一些局限性。然而,我们的人工智能系统每秒分析30幅图像,达到了视频图像分析所需的速度,这表明在不久的将来,技术的进一步发展将允许实时诊断癌症的侵袭深度。另一个问题是我们的人工智能系统对低质量图像的稳健性。在训练过程中使用低质量的图像可以获得人工智能系统的稳健性;然而,使用低质量的图像可能会损害系统的准确性。因此,我们认为在对大量高质量图像建立稳健性后,应该考虑对低质量图像的稳健性。
综上所述,该新型人工智能系统通过使用静态图像对食管浅表鳞状细胞癌侵犯深度具有良好的诊断性能。
图1 A、食管下段鳞状细胞癌(病理诊断:MM)。B、人工智能系统诊断:EP-SM1(正确)。绿色矩形框表示作者标记的肿瘤扩散;黄色矩形框表示人工智能系统诊断(0.93:概率;white:白光成像;sm1:EP-SM1肿瘤;nonmag:非放大成像)。
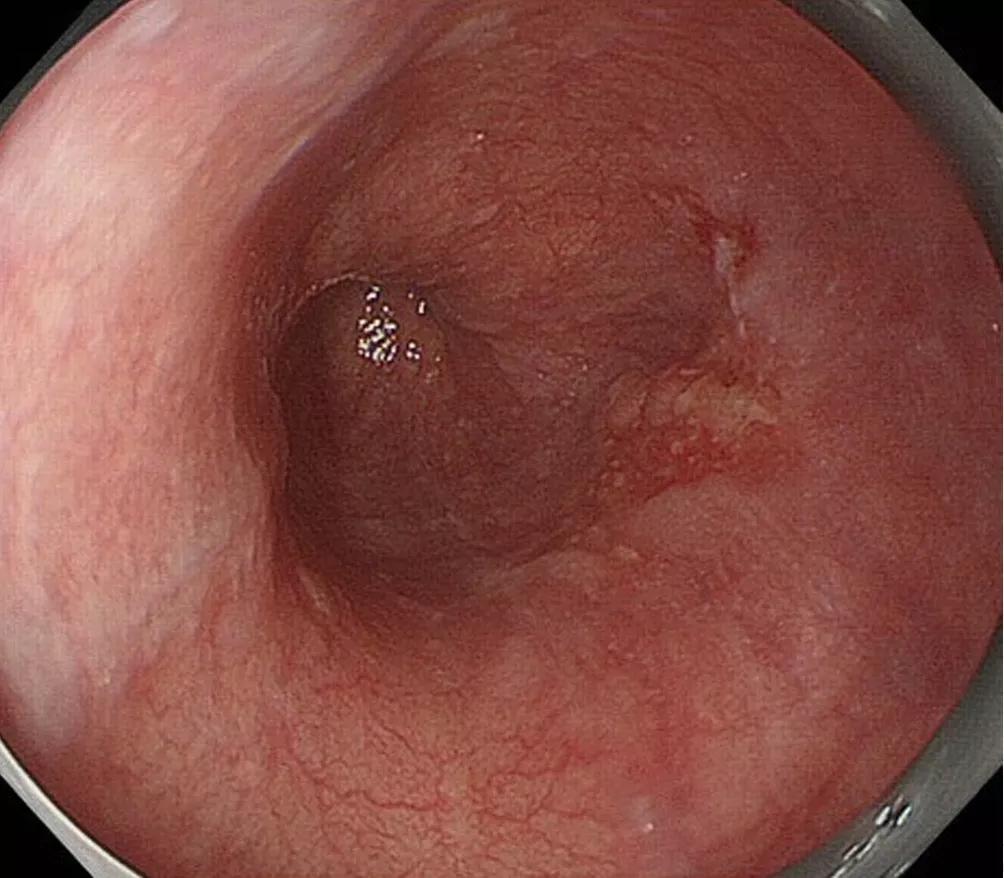
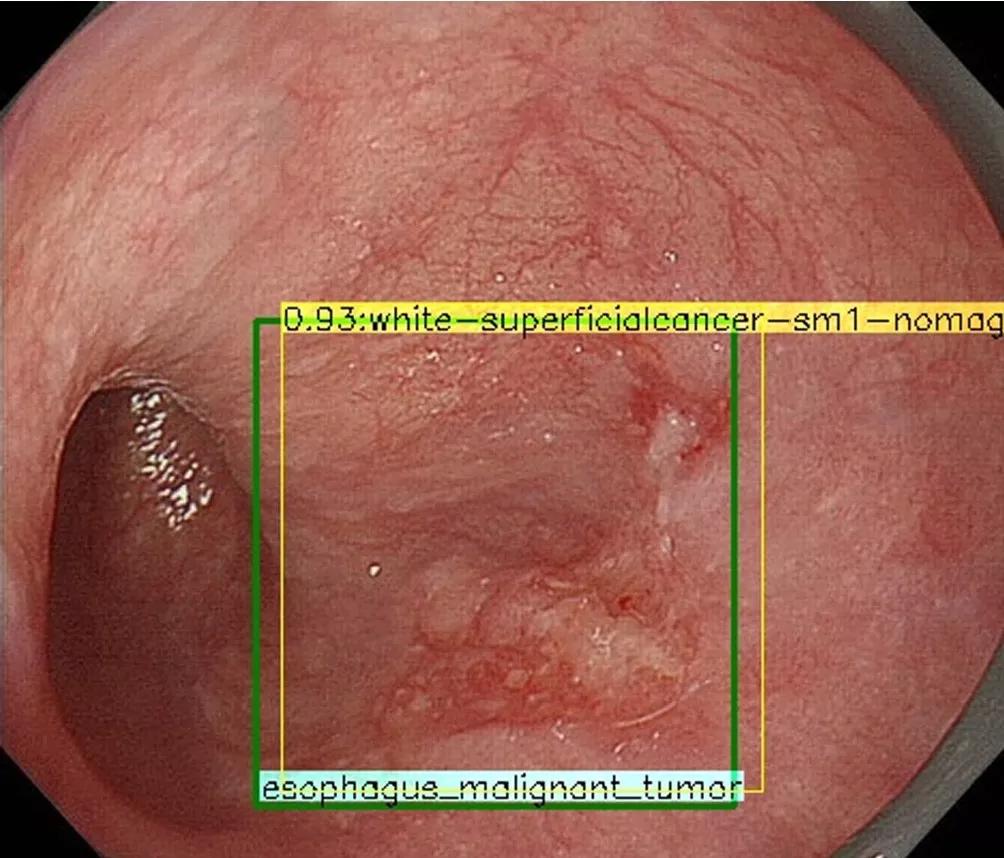
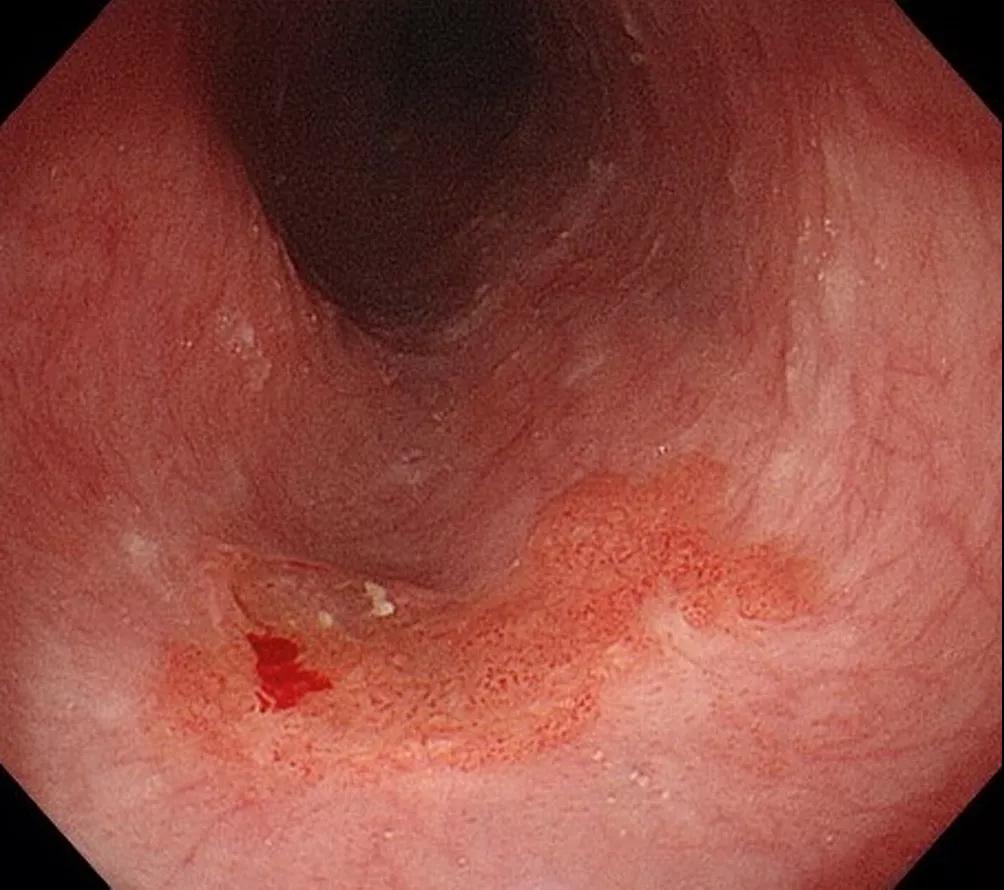
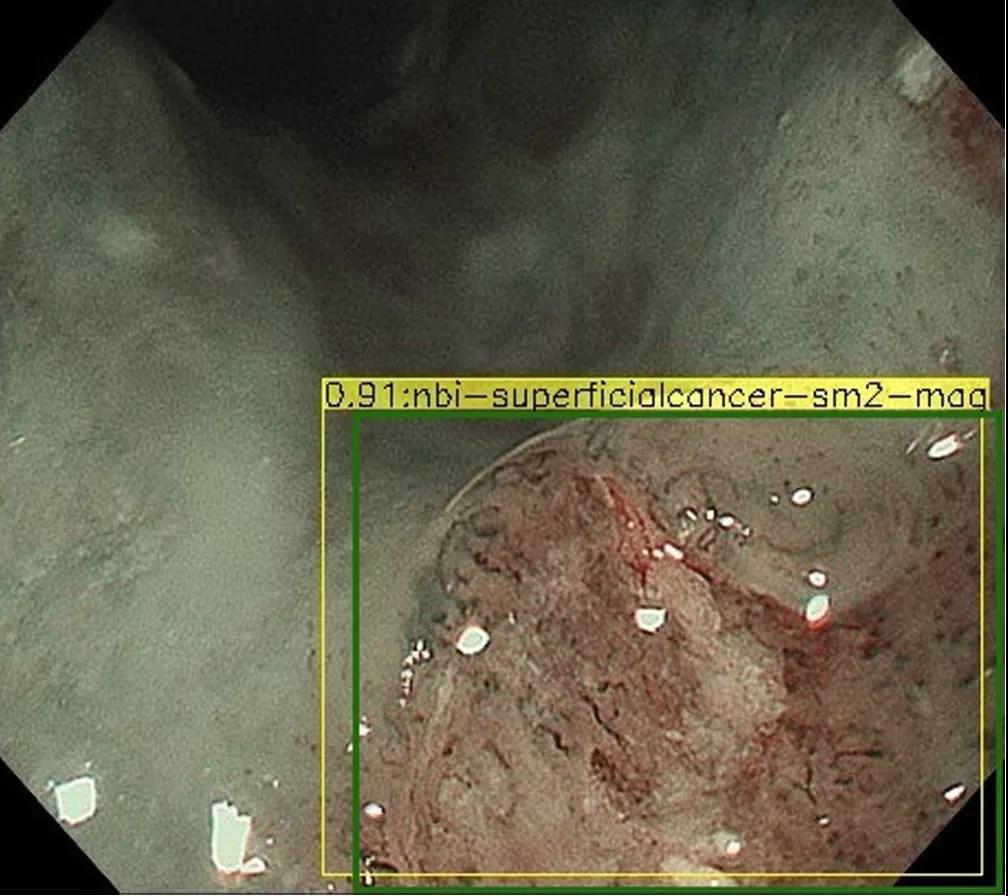
图2 A、食管中段鳞状细胞癌(病理诊断:SM2/3)。B、人工智能系统诊断:SM2/3(符合)。绿色矩形框表示作者标记的肿瘤扩散;黄色矩形框表示人工智能系统诊断(0.91:概率;NBI:窄带成像;sm2: SM2/3癌症;mag:放大成像)。
来源: 消化客 江苏省人民医院消化科
查看更多