查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





在临床上我们常常碰到很多这样的临床病例,脑脊液检验(尤其是细胞学形态学)的报告在临床诊疗过程中起到关键的转折点。我们将通过病例报道,帮助大家了解脑脊液细胞学形态学检验在临床诊断的作用。
患者,女,56岁。主诉:因“头晕头痛伴斜视3周”入院。
患者三周前无明显诱因下出现头晕头痛,以枕部为主,程度较剧,伴右耳鸣,伴眼眶疼痛,右眼斜视,视物有重影,伴四肢乏力,自测血压最高达180/120 mmHg。
2020年5月7日至华山医院急诊就诊,查血常规示白细胞6.0X109/L,中性粒细胞86.5%;头颅CT平扫未见明显异常,测血压183/117 mmHg,予尼卡地平10 mg qd静滴3天后血压波动在160/100 mmHg左右。
5月9日头晕头痛加剧,伴后颈部疼痛,双下肢乏力,手麻,恶心呕吐,呕吐物为宿食,查血常规白细胞16.04X109/L,中性粒细胞89.0%;电解质示血清钠128 mmol/L,血清氯87 mmol/L;胸部CT示右肺中叶炎症,双肺未见明显病毒样肺炎征象,附见胆囊结石,双肾周围渗出性改变;上腹部CT示胆囊结石,胆囊炎可能,左肾囊肿可能,双侧肾周炎;眼科超声示双眼玻璃体浑浊,头颅CT未见明显异常,予头孢曲松2g qd静滴7天后头晕头痛好转。
5月17日患者于家中行走过程中出现晕厥,意识障碍,呼之不应,1~2分钟后自行恢复意识,无发热抽搐,无大小便失禁,于华山医院急诊就诊,查血常规示白细胞17.41X109/L,中性粒细胞88.6%,淋巴细胞6.2%;电解质示血清钠126 mmol/L,血清氯86 mmol/L,血清钾3.4 mmol/L。为进一步诊治,收住华山医院北院感染科。
2018年10月行乳腺癌化疗,2019年2月行右乳腺癌切除术,2019年4月行化疗,2019年9月至2020年3月行放疗。高血压10余年,自行不规律口服替米沙坦40 mg,血压控制不佳。
双肺听诊呼吸音清,未闻及干湿啰音。右眼斜视。左眼直接对光反射迟钝,间接对光反射消失;右眼对光反射正常。双眼球运动检查无明显异常。其余未见明显异常。
根据以上病史,患者查血常规示白细胞高,胸部CT示两肺纹理增多,右肺中叶炎症,右上肺及两下肺少许纤维灶,双肺未见明显病毒样肺炎征象。抗感染方案治疗后稍好转,肺部感染较为明确。除此以外有多年高血压史,过去急诊数次高血压控制、抗感染治疗基础上,发生意识障碍,为此主治医生重点考虑:
1)中枢神经系统感染:患者起病急,有头晕头痛,多次查血常规示白细胞高,考虑中枢神经系统感染可能;
2)中枢神经系统肿瘤:视物模糊,左眼直接对光反射迟钝,间接对光反射消失;右眼对光反射正常。
既往有乳腺癌切除术和放化疗史,需排除肿瘤可能。
血常规:白细胞计数:12.70↑x109/L,血红蛋白:148 g/L,血小板计数:207x109/L,成熟中性粒细胞:83.9↑%;CRP及PCT未见明显异常,铁蛋白255.8 μg/L,血沉16 mm/h;
血培养:5天培养未见细菌生长;
血二代测序(mNGS):阴性;
血免疫及生物标记物:T-spot、G试验、血隐球菌荚膜抗原阴性;
CMV-DNA阴性;EBV-DNA(血浆)未检出,EBV-DNA(白细胞)5.15E2;自身抗体阴性;TBNK(CD4+20.1%,CD8+ 11.99%,CD4+/CD8+ 1.68),肿瘤标志物未见明显异常。
头颅/颈椎MRI增强:软脑膜强化,考虑脑膜炎可能,结合临床相关检查;双侧额顶叶及侧脑室旁散在少许小缺血灶;脑积水,结合临床。(2020-5-21)
上述进一步的检查未明确中枢感染还是肿瘤等方向,于是医生们又进一步将重点检查指向了脑脊液检查,以确定CNS感染还是肿瘤。脑脊液检查尤其是细胞学检查,在我院越来越受到临床医生的关注和欢迎。
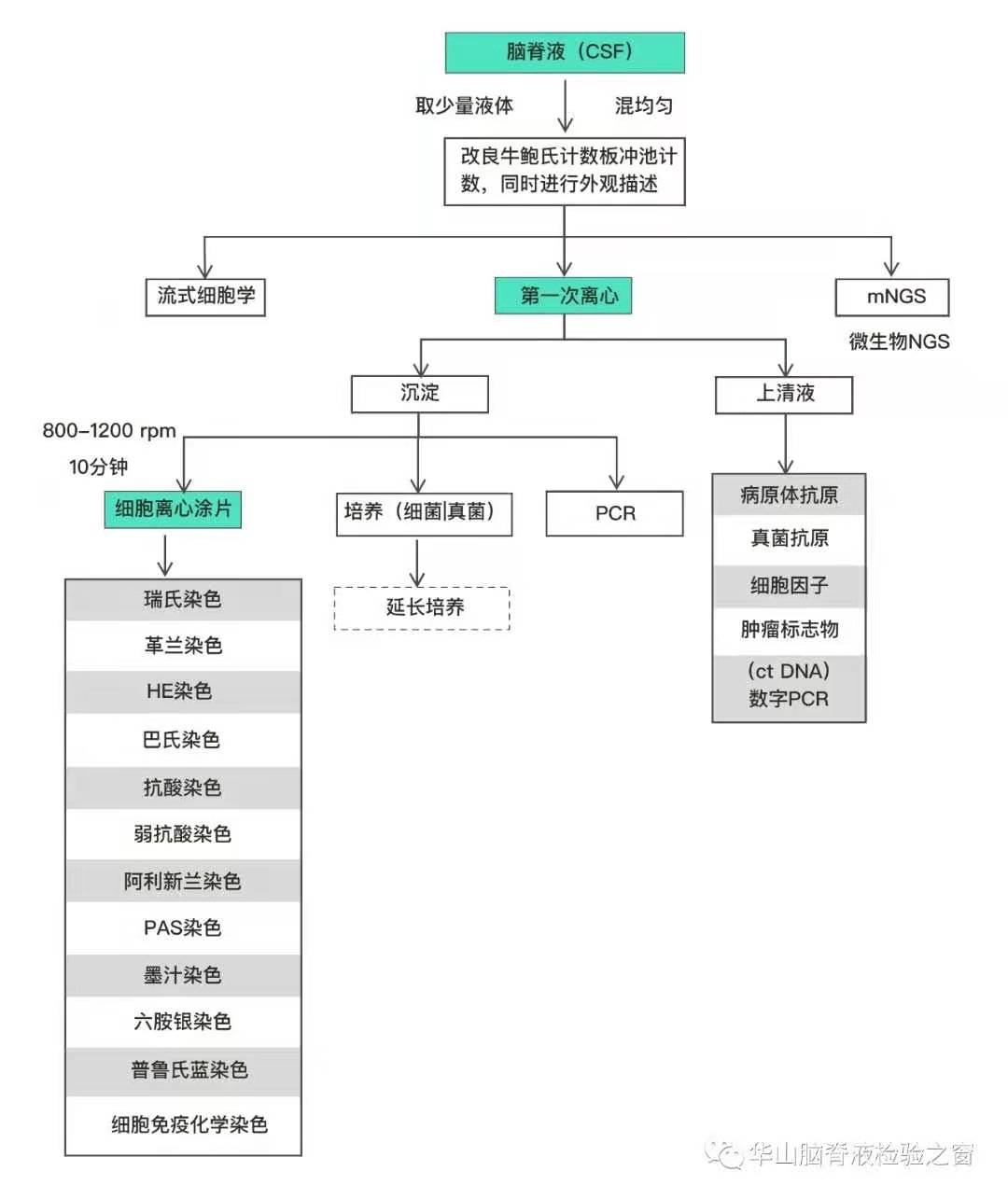
华山脑脊液检查流程
脑脊液先经过常规计数后,经过二次离心,分为沉淀物细胞学检查和上清液生物标记物检查,逐步确定中枢神经系统感染、免疫、肿瘤等方面疾病。
透明清亮脑脊液10 ml,脑脊液压力>300 mmH2O;无色,澄清,有核细胞 3*106/L;脑脊液生化:脑脊液总蛋白 0.53 ↑ g/L,脑脊液乳酸 4.3 ↑ mmol/L,脑脊液葡萄糖 3.85 mmol/L,脑脊液氯化物 120 mmol/L。
脑脊液见大量恶性肿瘤细胞增殖浸润;脑脊液细菌涂片培养、抗酸染色、隐球菌荚膜抗原均为阴性;脑脊液二代测序:人疱疹病毒7型(系列数1条)。
免疫组织化学染色:
CAM5.2(+);CK7(+);TTF-1(-);CK20(-);Calretinin(-);C-erB-2(-);villin(-);GCDFP-15(+);ER(-);PR(-);GFAP(-);Ki67:7~8%+恶性肿瘤脑膜转移:乳腺癌可能性大。

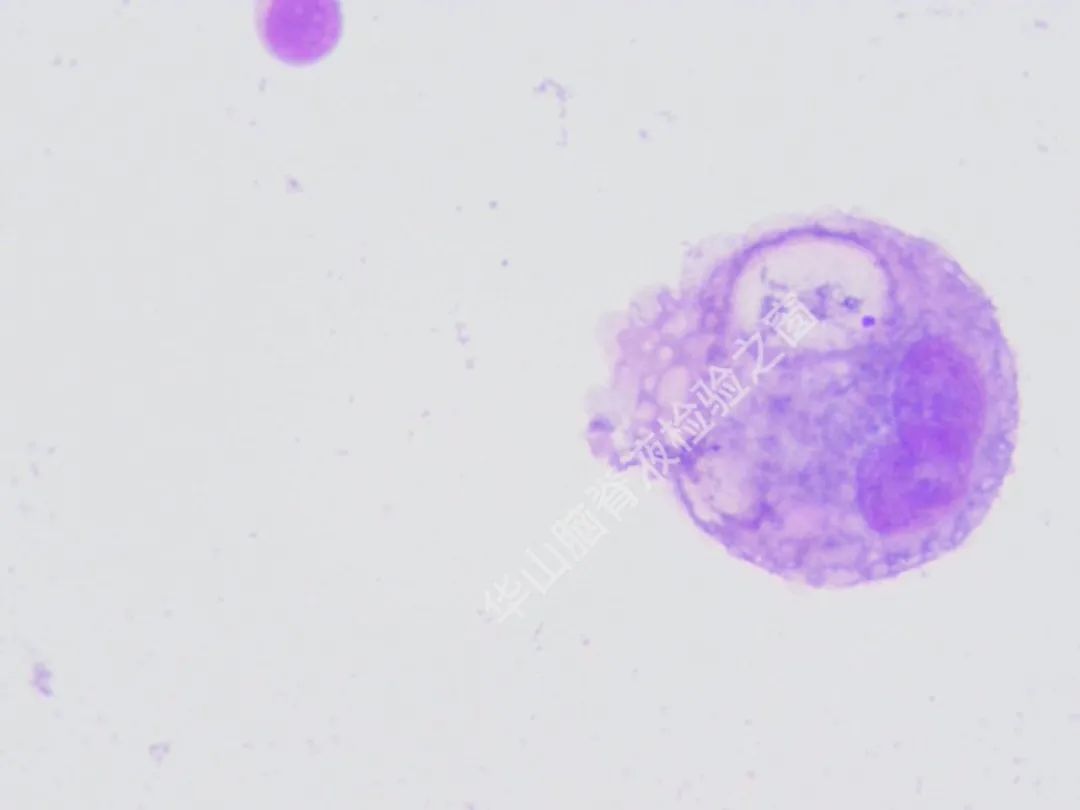
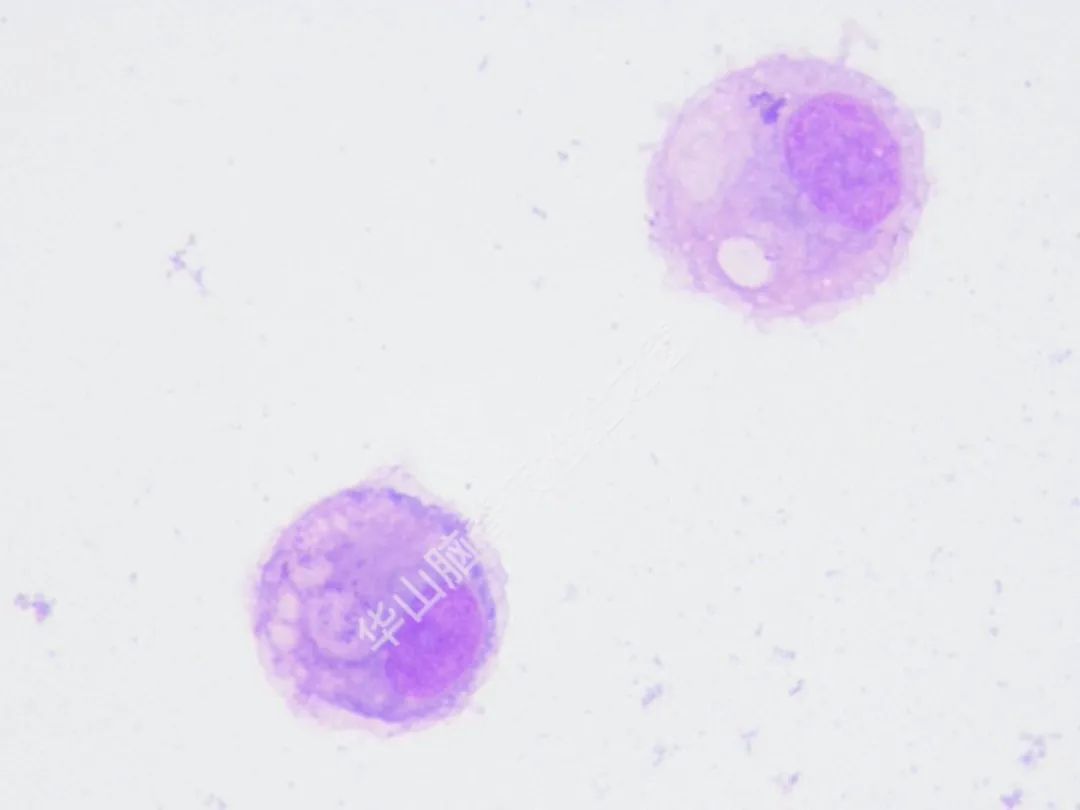
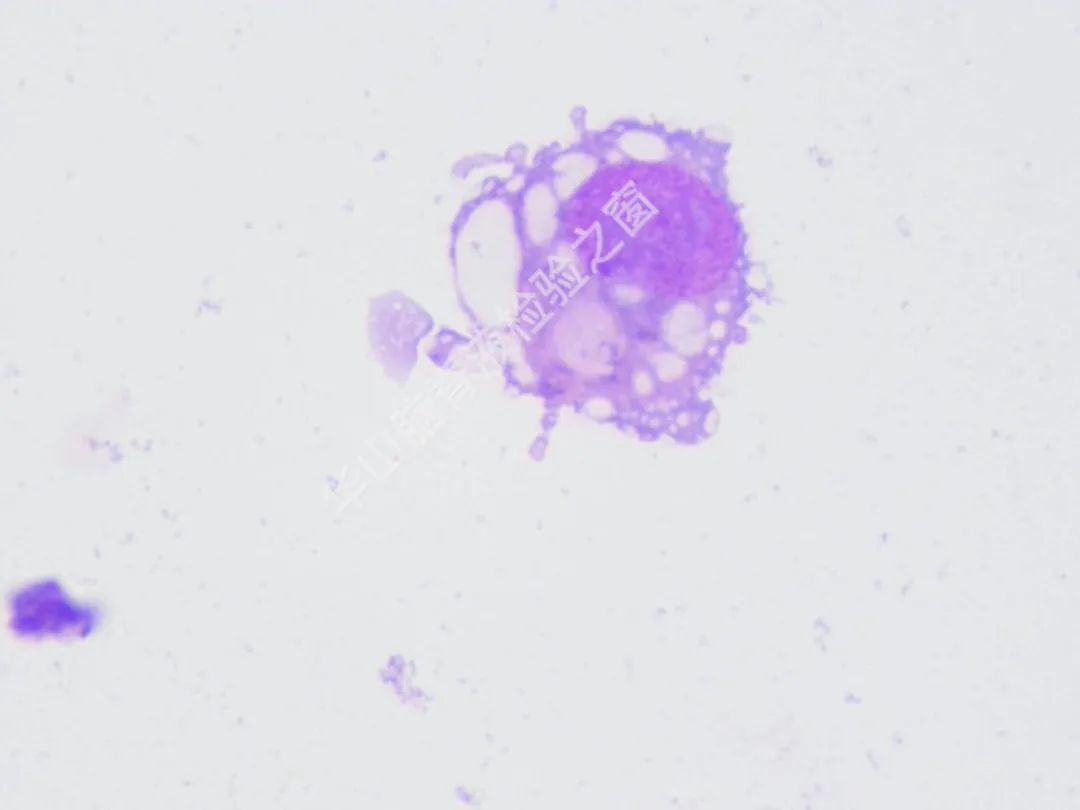
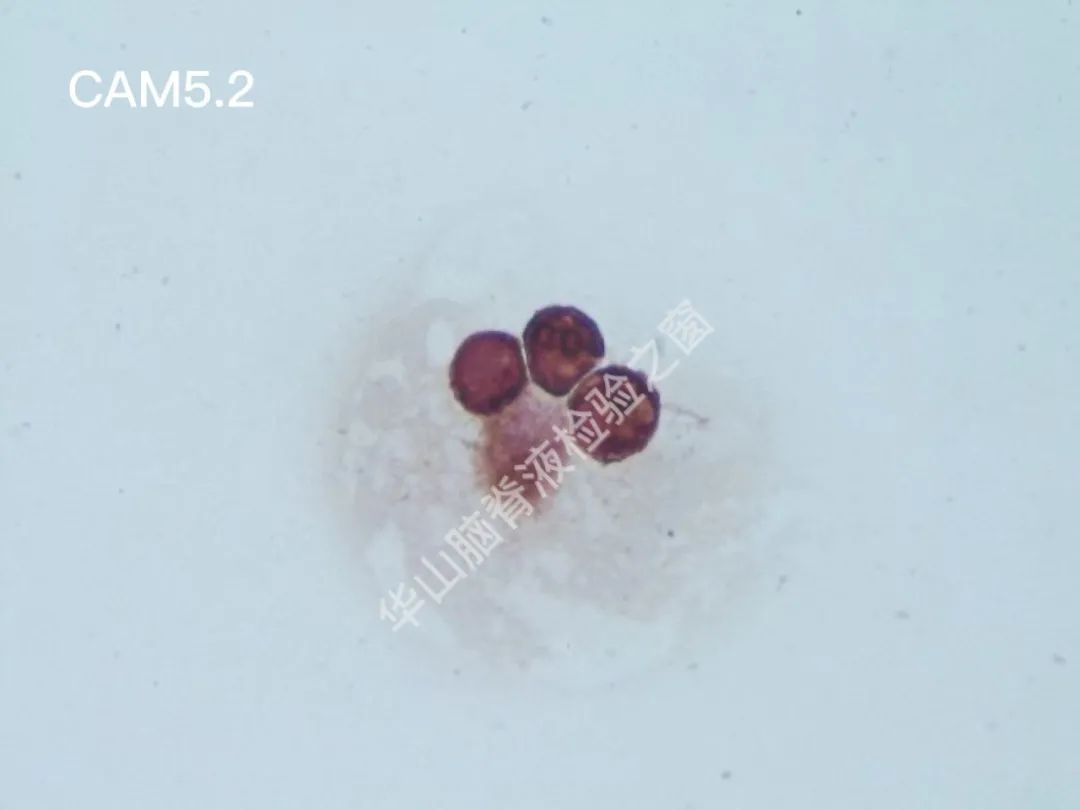
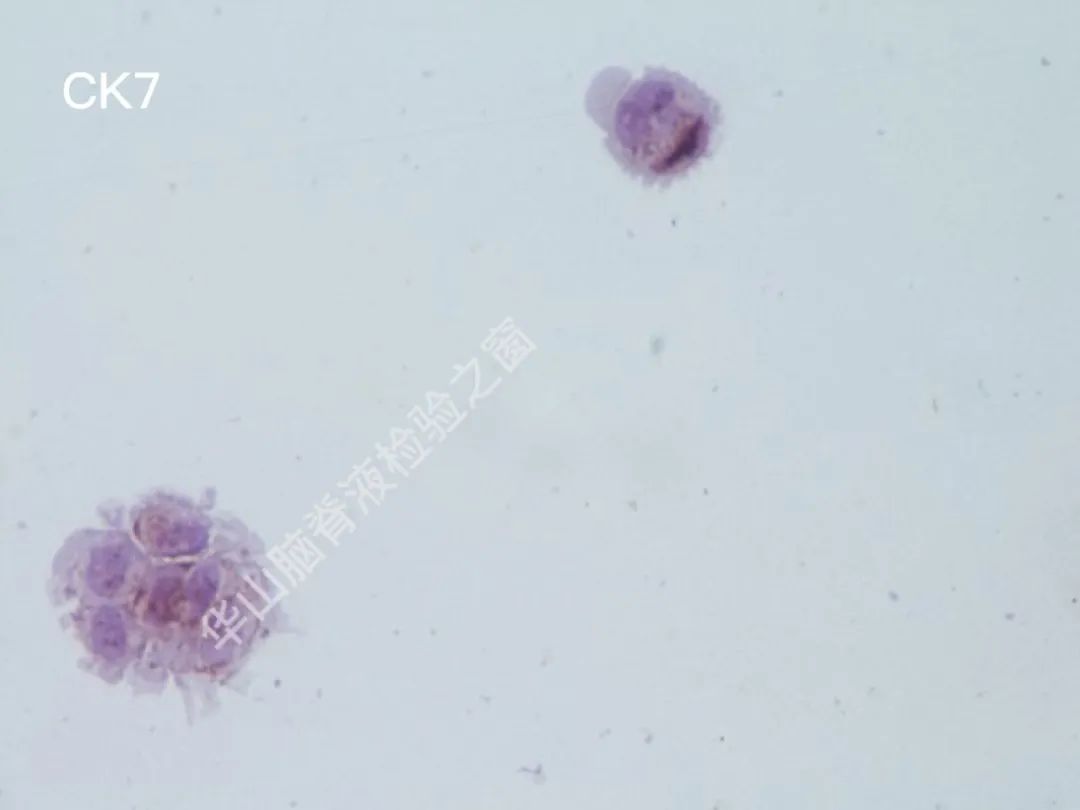
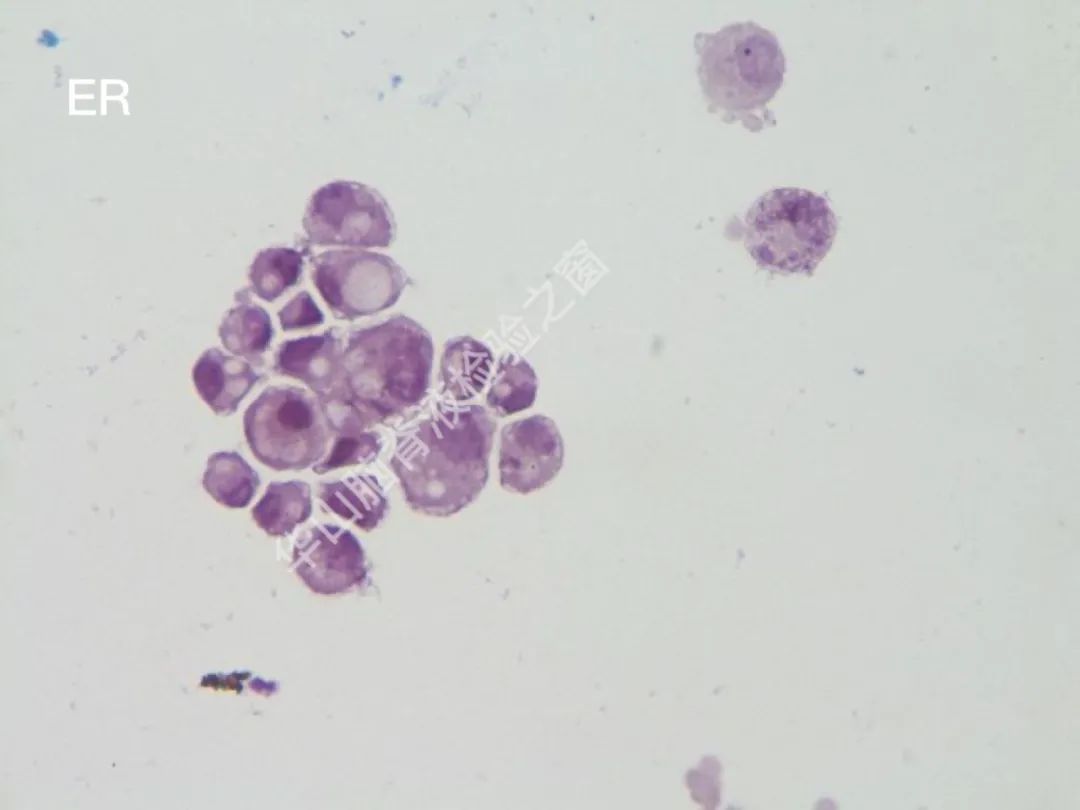
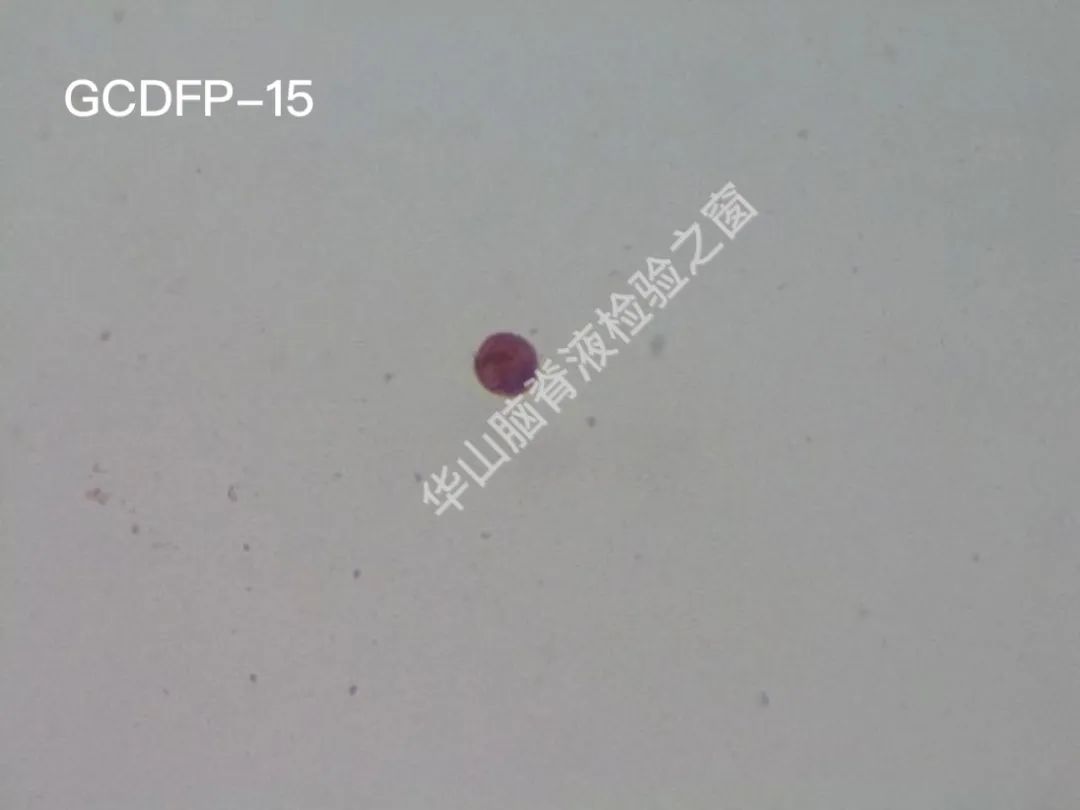
脑脊液细胞学图谱
大量恶性肿瘤细胞增殖浸润,该类细胞大小不一,以大居多,类圆或圆形,胞浆丰富或中等,边缘有大小不一的蕾丝样瘤状突起,色淡蓝。核大、类圆、偏位,染色质粗糙不均,可见明显的核仁。(细胞学为油镜,免疫组织化学为高倍镜)
那么我们怎么根据以上免疫组织化学染色确定乳腺癌软脑膜播散的定性的呢?
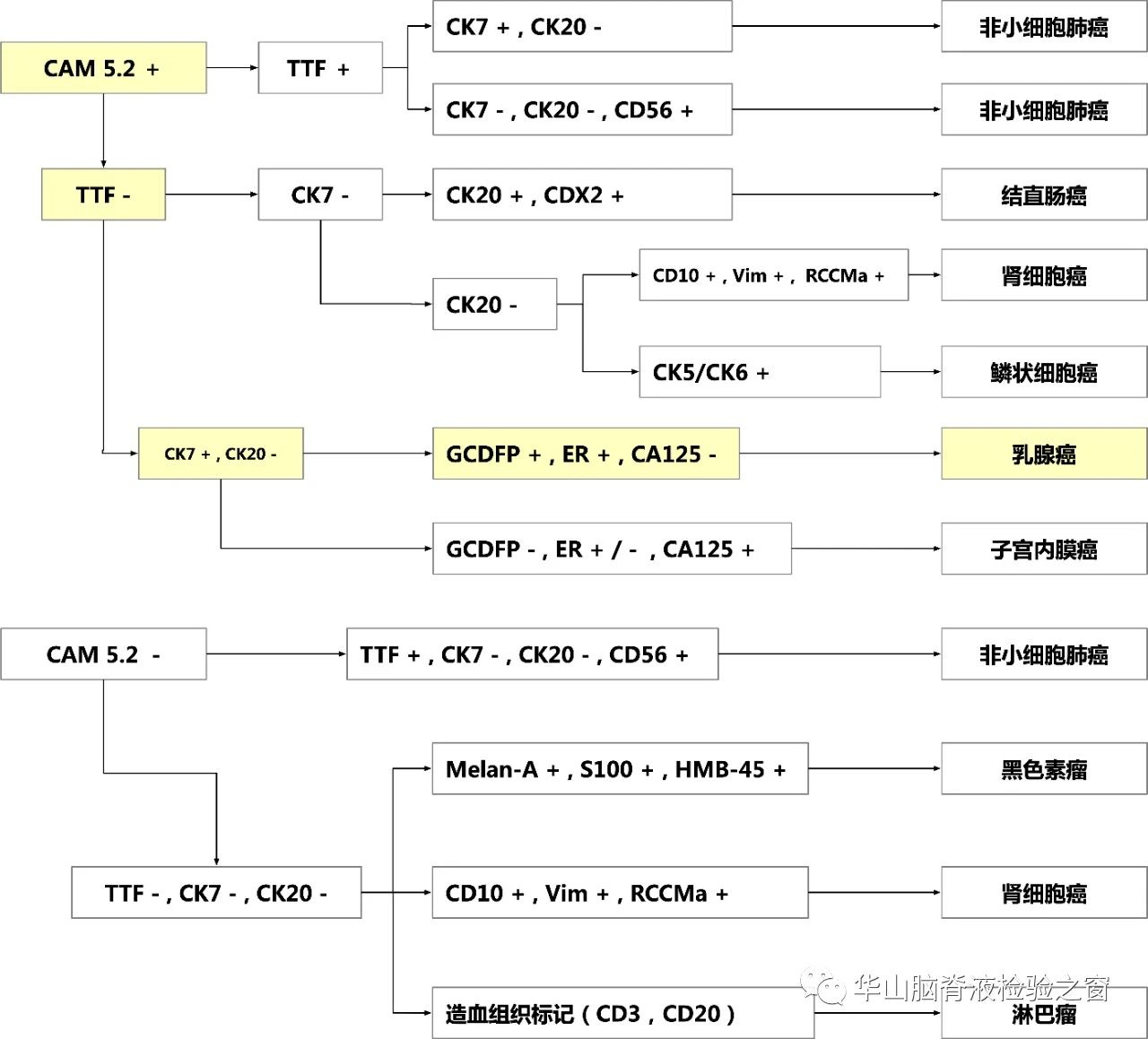
免疫组织化学流程
CNS常见转移瘤来源的免疫组织化学分析图解。摘自《神经系统肿瘤病理学和遗传学/WHO世界卫生组织肿瘤分类及诊断标准系列》,CDX2:尾型同源异性盒转录因子2;GCDFP:巨囊性疾病液体蛋白;RCCMa:肾细胞癌标记物;TTF:甲状腺转录因子;+ 阳性;- 阴性。
经过肿瘤科医生会诊,转入肿瘤科,诊断右乳浸润性小叶癌根治术后脑膜转移 cT2N+M0 ypT1N3M0 IIIC期 HR阳性HER2阴性(异质性) rT2N3M1(脑膜) 三阴性,结合上述临床病史、细胞形态及免疫化学染色符合乳腺癌脑脊液播散,故乳腺癌脑膜转移诊断明确。以甘露醇+地塞米松等降颅压,经神经外科会诊后进行全脑放疗治疗。
该病例以头痛、斜视起病,先后经历了急诊(高血压,抗感染治疗)、感染科住院(控制感染)、肿瘤科(确诊软脑膜肿瘤及放疗方案)三个阶段,可以明确看到脑脊液细胞学检查在病程中是关键的转折点。
软脑膜肿瘤LM,是各种肿瘤晚期常见的并发症,包括实体瘤、中枢神经系统肿瘤和血液系统肿瘤播散到脑脊液和软脑膜,极具破坏性,患者出现的临床体征和症状包括颅神经麻痹、神经根症状、颅内压升高等,从而导致肿瘤患者的生存期迅速下降。已知大多数实体瘤会引起LM,最常见实体瘤是乳腺癌、肺癌和黑色素瘤。研究表明在实体瘤中LM中发生率约为5-30%[1]。
早期诊断和治疗对延长患者生存期至关重要,然而由于不同诊断方法的敏感性较低,目前诊断手段主要依靠头颅和脊柱的增强磁共振成像以及脑脊液细胞学检查。软脑膜肿瘤LM患者MRI往往有20%~30%不等的假阴性,而且往往影像学表现无特异性,因此影像学对诊断帮助有限[2]。
脑脊液细胞学检查是中枢神经系统肿瘤,尤其是诊断LM的“金标准”,也是决定后续治疗方案的重要依据,脑脊液细胞学检查的敏感性为50%~70%,二次以上腰椎穿刺敏感性进一步提高[3]。我院经过对细胞学制片流程进一步改进后(国家知识产权局专利号:ZL201921160749.7),大大提高了脑脊液细胞学收集效率,从而进一步提高了脑脊液细胞学检查的敏感性,结合免疫组织化学染色可进一步确定肿瘤的分型。
【参考文献】
1. Batool A, Kasi A. Leptomeningeal Carcinomatosis[M]//StatPearls [Internet]. StatPearls Publishing, 2019.
2. Lasocki A, Phillips K A, Drummond K, et al. Unexpected diagnosis of spinal leptomeningeal metastatic disease on MRI myelography[J]. Journal of Clinical Neuroscience, 2019, 66: 259-261.
3. Cytomorphologic and clinicoradiologic analysis of primary nonhematologi98c central nervous system tumors with positive cerebrospinal fluid[J]. Cancer Cytopathology,2015,123(2):123-135.
来源:华山脑脊液检验之窗

查看更多