查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者 复旦大学附属中山医院 缪长虹 张军
大约75%的乳腺癌表达雌激素和/或黄体酮受体。内分泌治疗通常对这些激素受体阳性肿瘤有效,但原发性和获得性耐药限制了其长期疗效,且内分泌治疗常伴有子宫内膜增生的副作用。因此,延缓或逆转这种耐药性对乳腺癌患者的预后具有重大意义,2020年7月,Irene Caffa等学者在《自然》(Nature)杂志上发表了题为“Fasting-mimicking diet and hormone therapy induce breast cancerregression”的试验研究,探讨了Fasting-mimickingdiet(FMD)在乳腺癌患者中联合内分泌治疗增强抗癌活性的作用,并减少子宫内膜增生的副作用。现将内容介绍如下:

生长因子可以通过磷酸肌醇3-激酶(PI3K)-AKT-哺乳动物雷帕霉素靶点(mTOR)和丝裂原活化蛋白激酶(MAP激酶)轴增强雌激素受体活性,并经常导致乳腺肿瘤的内分泌抵抗。只喝水或植物性饮食即低热量、低糖、低蛋白质和高脂肪比例的饮食(如模拟限制饮食,FMD)可减少循环中生长因子(如胰岛素和IGF1)。这些饮食干预可以增强雌激素治疗(ET)的活性,有潜在的延缓内分泌抵抗的作用。
1.禁食或FMD通过降低循环中生长促进因子水平增强ET在HR+ / HER2−乳腺癌细胞系中的抗肿瘤活动.
细胞层面,禁食或FMD(被称为短期饥饿,STS)能增强他莫昔芬和氟维司群在HR+ / HER2−乳腺癌细胞中的抗肿瘤作用。小鼠异种移植相同的细胞系而后进行周期性禁食或FMD可得到类似的结果(Fig. 1a, Extended Data Figs. 1,2a, b) 。STS也增加了HR + 乳腺癌患者肿瘤类器官中他莫昔芬的抗肿瘤活性,周期性FMD可以防止小鼠模型中他莫昔芬的获得性耐药(Extended Data Fig. 2c,d)。细胞层面,STS引起的雌激素治疗(ET)活动增强依赖于血清减少,不依赖于葡萄糖减少,因为向细胞培养基中增加葡萄糖中仍能观察到这种增强作用(Extended Data Fig. 3a)。
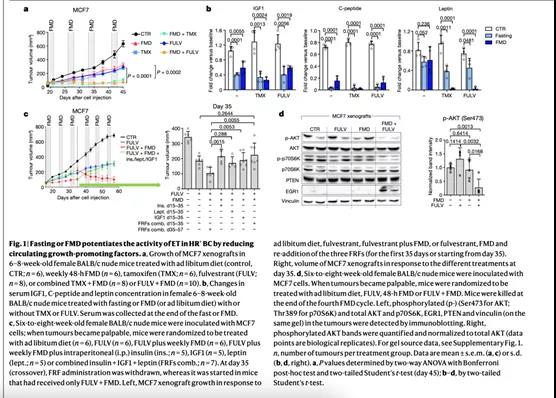
在小鼠中,禁食或FMD除了提高β-羟基丁酸水平(ExtendedData Fig.3b)和降低血糖外,还改变了循环中生长因子和脂肪因子的水平(Fig. 1b, ExtendedData Fig. 3c)。两种饮食干预措施都降低血清C肽水平,减少循环中胰岛素样生长因子1(IGF-1)和胰岛素样生长因子结合蛋白3(IGFBP-3)水平,同时增加IGFBP-1(通过阻止与IGF受体结合,来阻止IGF1的作用)。因此,禁食或FMD降低IGF水平和其生物利用度。禁食或FMD联合ET也降低瘦素水平(一种脂肪因子,作为HR+ 乳腺癌细胞的生长因子并降低ET的功效)。值得注意的是,他莫昔芬与禁食联用时,可以增加脂联素,发挥抗肿瘤作用。(Extended Data Fig.3c)
在用氟维司群+ FMD治疗的MCF7异种移植小鼠中,重新加入我们统称为禁食减少因子(FRFs)的胰岛素、瘦素或IGF1,可以成功逆转FMD诱导的氟维司群活性增强(Fig.1c, Extended Data Fig. 3d) 。在MCF7 细胞中我们获得了类似的结果 (Extended Data Fig. 3e) 。在小鼠模型中,通过3个周期的FMD可以撤除FRFs的作用使肿瘤细胞重新获得对ET联合FMD治疗的敏感性,而在氟维司群联合FMD治疗的小鼠中加入FRF则可以刺激肿瘤的生长,并剥夺氟维司群增强的治疗作用(Fig. 1c)。在启动级联信号通道(如PI3K–AKT–mTOR通路)从而影响HR+ 乳腺癌细胞对ET治疗的敏感性上,这些FRFs具有交叉作用,因此同时减少这三种因子可以最大化增强ET抗肿瘤活性。在FRFs减少的小鼠模型中分离出的肿瘤表现为AKT和p70S6K(一种mTOR靶点)的磷酸化减少,而在FMD联合氟维司群治疗过程中添加FRFs的小鼠模型中肿瘤AKT和p70S6K的磷酸化水平与随意喂养的小鼠中表达相当(Extended Data Fig.3f) 。
2. 禁食或FMD通过上调PTEN和抑制AKT、雌激素受体,增强抗肿瘤活性
STS和FMD与ET治疗协同增加了HR+ 乳腺癌细胞(体外和体内)和HR+/HER2−乳腺癌类器官中PTEN的表达,而PTEN是AKT-mTOR信号转导的负调控因子(Fig. 1d, Extended Data Fig.4a–d)。
与前面提到的AKT磷酸化和mTOR活性降低一致,这些处理组合降低了p70S6K和eIF4E磷酸化,增加主要为非磷酸化形式的翻译抑制因子4E-BP1的丰富度,并抑制蛋白质合成(Extended Data Fig. 4a, b, e)。在已知的PTEN表达增强因子中,我们关注了肿瘤抑制因子早期生长反应蛋白1 (EGR1),该蛋白的表达与乳腺癌患者的良好预后相关,禁食后在健康组织中上调,并被雌激素受体活性抑制。
ET 联合STS/FMD治疗后,HR+ 乳腺癌细胞系和HR+ 乳腺癌类器官中EGR1水平升高,EGR1沉默则使ET和STS/FMD联合的抗肿瘤活性降低(Fig. 1d, Extended Data Fig.4a–d) ,并阻止ET-STS诱导的PTEN积累和AKT抑制作用(ExtendedData Fig. 5a–e) 。
通过EGR1沉默使乳腺癌细胞逃脱ET和STS的联合治疗作用反映了AKT的持续活性,因为AKT抑制剂GDC0068和AZD5363以及PI3K抑制剂LY294002都能取消这种保护(Extended Data Fig. 5f) 。PTEN沉默和组成活性AKT(肉豆豆酰化(myr)-AKT)的表达也降低了MCF7对联合ET和STS/FMD治疗的敏感性(Extended Data Fig. 5e, g, h) 。
补充FRFs或17β-雌二醇,可防止MCF7细胞在他莫昔芬和STS联合治疗中EGR1、PTEN和4E-BP1的增加(Extended Data Fig. 5i) 。Myr-AKT也可抑制EGR1和PTEN的上调(Extended Data Fig. 5j, k) ,因此,禁食或FMD和ET似乎共同解除了AKT介导的EGR1表达抑制。反过来,增加EGR1提高了PTEN水平,加强了对AKT的抑制。AMPK降低mTOR活性,在ET和STS联合治疗中暴露的乳腺癌细胞中AMPK也被磷酸化了(Extended Data Fig. 6a) 。通过沉默PTEN或加入myr- AKT能阻止这一效应,表明通过联合ET和STS刺激AMPK继发于PTEN上调和AKT活性降低。
雌激素受体活性对HR+ 乳腺癌细胞的生存和增殖至关重要,并可通过胰岛素、IGF1和瘦素信号在多个水平上增强。STS降低了雌激素受体依赖的转录,增强了在HR+乳腺癌细胞系中氟维司群和他莫昔芬介导的雌激素受体抑制,降低雌激素受体靶基因TFF1、PGR和GREB1的表达(Extended Data Fig. 6b, c) ,因此,STS和ET也协同抑制雌激素受体活性。
通过基因表达微阵列和基因集富集分析(GSEA),我们观察到他莫昔芬(TMX)和STS联合处理MCF7细胞后(Extended Data Fig. 7a–c) ,细胞周期相关基因下调。其中4个基因——E2F1,E2F2, CCNE1和CCND1(cyclin D1 )在联合治疗后所有基因的mRNA水平(Extended Data Fig. 7d) 和CCND1蛋白水平下调(Extended Data Fig. 7e, f)。与它们对细胞周期调节因子的作用一致,STS和ET联合降低了HR+乳腺癌细胞中磷酸化的视网膜母细胞瘤蛋白(RB)水平,并诱导细胞周期阻滞在G0-G1期(Extended Data Figs. 7e, g, 8a,b)。沉默EGR1和增加myr-AKT表达均可降低CCND1对ET和STS联合治疗反应的下调,而myr-AKT可保护MCF7免受ET、STS或其联合引起的细胞周期阻滞(Extended Data Fig. 8c, d) 。因此,EGR1上调和AKT抑制介导了ET和STS联合作用下CCND1的下调,从而导致细胞周期阻滞。
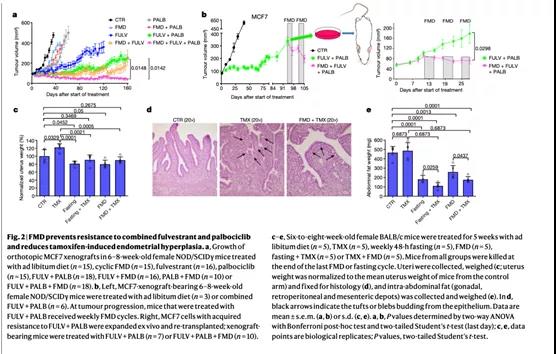
我们推测,ET和FMD联合下调CCND1可通过添加周期蛋白依赖性激酶4/6 (CDK4/6)抑制剂如帕博西尼来发挥额外的治疗作用。在携带原位异种移植的MCF7肿瘤细胞的小鼠中,FMD周期处理或帕博西尼在相同程度上推迟了氟维司群耐药性的发生(Fig. 2a, Extended Data Fig. 8e)。然而,即使氟维司群联合FMD或氟维司群联合帕博西尼也不能阻止耐药性的产生。联合使用氟维司群、FMD和帕博西尼不仅能阻止肿瘤生长超过160天,而且还能导致缓慢但稳定的肿瘤缩小。此外,对氟维司群+帕博西尼耐药的肿瘤小鼠进行周期性FMD处理,即使处于晚期也能诱导肿瘤缩小(Fig. 2b, left) 。对氟维司群和帕博西尼耐药的MCF7肿瘤细胞扩增后并建立新的异种移植(Extended Data Fig.8f, g),再将FMD添加到原有的氟维司群和帕博西尼的治疗方案中,可以显著增加抗肿瘤活性(Fig. 2b, right)
3.FMD减少他莫昔芬引起的子宫内膜增生
他莫昔芬和禁食或FMD联合治疗的小鼠尸检显示,其子宫比单独用他莫昔芬治疗的小鼠子宫更小。禁食或FMD阻止了他莫昔芬引起的子宫大小和重量的增加,并减轻子宫内膜增生的组织学特征,如宽而厚的子宫内膜绒毛等(Fig. 2c, d, ExtendedData Fig. 9a, b) 。禁食或FMD伴或不伴他莫昔芬均降低小鼠子宫内Tff1的表达和AKT磷酸化水平,并且增加EGR1和PTENmRNA的表达(Extended Data Fig.9c, d)。PTEN和EGR1蛋白在子宫中的表达也因禁食而上调,而FMD只导致这些蛋白的增加趋势(Extended Data Fig. 9d) 。因此,禁食或FMD降低了他莫昔芬诱导的小鼠子宫内膜增生、雌激素受体活性和小鼠子宫内AKT的激活。
最后,禁食或FMD联合他莫昔芬减少小鼠腹腔内脂肪(Fig. 2e, Extended Data Fig. 9e) 。因为腹部脂肪是脂肪因子的主要来源,这种减少可以解释联合ET和禁食或FMD降低瘦素的效果。
4.禁食或FMD在HR+ 乳腺癌患者和小鼠中的肿瘤控制作用
NCT03595540(患者编号1-24)和NCT03340935(患者编号25-36)两项临床研究共36例HR+乳腺癌患者进行了周期性FMD联合ET的治疗方案,验证了FMD在接受积极癌症治疗的患者中的安全性和可行性。
在NCT03595540试验中,患者每四周接受5天的FMD(Xentigen)。他们平均完成6.8个FMD周期,仅导致1-2级不良事件,最常见的是头痛(41%)和疲劳(21%)。来自NCT03340935研究的患者接受了类似的、更严格热量限制的、每3到4周5天的FMD方案,平均完成5.5个周期,没有发生严重的不良事件。参加NCT03595540试验的患者,在FMD周期之间还接受了饮食建议和每日肌肉训练的指导,保持着稳定的体重和握力(Extended Data Fig. 10a) 。
转移性HR+/HER2−乳腺癌患者中的联合使用ET、帕博西尼和FMD治疗的患者(n = 4),其临床结果是有希望的。1号、26号和27号患者分别在二线治疗组治疗了32个月、20个月和11个月,总共接受了10个(1号患者)和8个(26号和27号患者)FMD周期。1号和26号患者仍然存在临床可控的肿瘤,27号患者则在11个月后发生肿瘤进展(该研究得到的中位无进展生存(PFS)期为9个月)。29号患者接受了氟维司群+帕博西尼的四线治疗方案并联合了四周期的FMD治疗,最终在11个月后发生肿瘤进展。入组试验的所有HR+/HER2−乳腺癌患者,FMD均降低了血糖、血清IGF1、瘦素和C肽水平,同时增加了循环中酮体水平(Fig. 3b, Extended Data Fig. 10c, d)。结束FMD3周后,瘦素和IGF1仍低于基线水平(Fig. 3c, Extended Data Fig. 10e)。
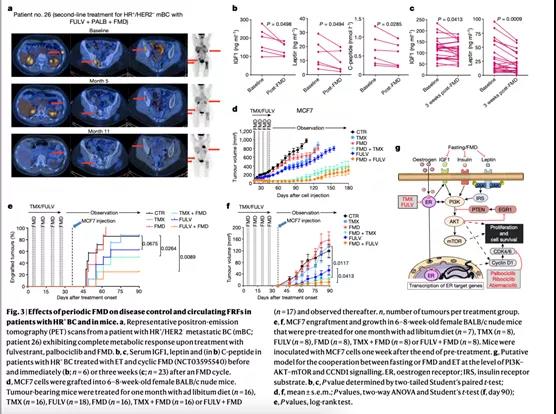
在小鼠中也得到了类似的结果(Extended Data Fig. 10f) :ET和FMD联合治疗的小鼠中(但不是单独ET或单独FMD),瘦素和IGF1水平低于自由喂养的小鼠,即使在FMD结束后一周再次喂养仍然如此。考虑到瘦素和IGF1都能刺激乳腺癌细胞增殖,我们评估了这些循环FRSs在FMD之后持续的长期变化是否与抗癌作用有关。携带异种移植MCF7肿瘤细胞的小鼠在ET联合FMD(或禁食)治疗一个月后,在治疗措施撤退后仍可减缓肿瘤生长长达90天,并改善了老鼠生存(Fig.3d, Extended Data Fig. 10g, h) 。联合ET和FMD预处理小鼠一个月,随后进行MCF7细胞接种,存活的肿瘤移植物减少,并减缓了那些成功移植的肿瘤的生长(Fig.3e, f)。氟维司群预处理也减缓了MCF7异种移植物的生长,这可能是由于使用了长效配方。然而,FMD联合氟维司群预处理比氟维司群单独治疗效果更佳。
内分泌治疗药物他莫昔芬和氟维司群是激素受体阳性肿瘤有效的治疗手段,但原发性和获得性耐药限制了其长期疗效,且存在子宫内膜增生的不良反应。在激素受体阳性乳腺癌小鼠模型中,周期性禁食或FMD的饮食通过降低循环IGF1、胰岛素和瘦素,并通过上调EGR1和PTEN抑制AKT-mTOR信号,增强了内分泌治疗药物他莫昔芬和氟维司群的活性。当氟维司群与帕博西尼联合使用时,周期性FMD的饮食可促进肿瘤长期消退并逆转获得性耐药性。此外,禁食和模拟限制饮食都可以防止他莫昔芬引起的子宫内膜增生。
在接受雌激素治疗的激素受体阳性乳腺癌患者中,模拟禁食的饮食引起周期性的代谢变化与在小鼠中观察到的类似,包括胰岛素、瘦素和IGF1水平的降低,而最后两种水平持续处于较低水平。在老鼠身上,这些改变与长期的抗癌活动有关。这些结果支持,在激素受体阳性乳腺癌中,模拟限制饮食作为雌激素治疗的辅助措施有待进一步临床研究的必要。
周期性禁食或FMD增加了他莫昔芬和氟维司群的抗癌活性,延缓了机体对这些药物的耐药发生。值得注意的是,禁食或FMD能够抑制AKT-mTOR轴,而不会引起与使用PI3K或mTORC1抑制剂相关的反弹性高血糖和高胰岛素血症。ET + FMD降低瘦素和IGF1的作用持续到FMD结束之后,并与残留的抗癌活性有关。因此,观察到的小鼠HR+ 乳腺癌的减退现象可以同时反映这些FRFs的急、大幅的减少和慢性、轻微的减少。这些结果也说明周期性FMD的癌症预防作用。考虑到他莫昔芬引起子宫内膜增生的副作用普遍存在和替换他莫昔芬的选择有限,禁食或FMD能够预防他莫昔芬引起的副作用是另一个有趣的发现。
综上,FMD可以改善接受ET的HR+乳腺癌患者的临床结果,也可以用于对胰岛素、IGF1或瘦素缺失较敏感的其他癌症的治疗。FMD+ET的实验研究结果为FMD的大规模临床研究提供了重要的理论基础。
禁食潜力是营养时代最有趣的话题之一。禁食包括脂肪、蛋白质和碳水化合物的分解代谢,以保持血糖水平在正常范围内。禁食的作用机制最早是在小生物体中被理解的,后来在人类中也被验证。卡路里限制的营养干预可以减轻与年龄相关的表观遗传学改变,并可能对细胞改变具有保护作用,促进寿命和健康跨度。虽然大多数禁食研究指出体重和脂肪量减少,但重要的是为禁食和非禁食天数定义具体的指导方针,以提高依从性,最大限度地提高干预措施的执行率,并最大限度地改善身体成分。虽然禁食和热量限制的证据很多,但缺乏安全的禁食方案来指导医生开出处方。我们仍需要更多的临床研究来确定禁食的指南,如何将禁食插入到一个巨大的饮食个性化战略中,创造最佳和健康的营养状态是值得进一步研究的问题。
古麻今醉网 平台发布
查看更多