查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





先天性高胰岛素性低血糖血症(congenitalhyperinsulinemichypoglycemia,CHI)是一种罕见的内分泌疾病。是新生儿期和婴儿早期严重和持续性低血糖的最常见原因,其特征是胰岛素分泌过量或不受血糖调控及反复发作的严重的低血糖,需迅速积极治疗,以避免神经系统后遗症。
CHI呈常染色体显性或隐性遗传。其病因及发病机制目前尚未完全清楚。目前共报道12种致病基因可引起CHI:ABCC8、KCNJ11、GLUD1、GCK、HADH、SLC16A1、UCP2、HNF4A、HNF1A、HK1、PGM1和PMM2。其中,编码胰腺β细胞中ATP敏感K通道(KATP)的基因(ABCC8和KCNJ11)突变是最常见病因,占所有病因的40%~45%。KATP由SUR1和Kir6.2两种亚单位组成,SUR1由ABCC8基因编码,Kir6.2由KCNJ11基因编码,该两种基因失活突变,可导致KATP通道持续关闭,β细胞膜持续去极化,最终导致胰岛素分泌失调。绝大多数KATP通道-CHI患者对二氮嗪治疗无反应。其他基因突变占CHI的5%~10%,其中谷氨酸脱氢酶(GLUD1)基因突变是最常见类型,该基因突变导致谷氨酸脱氢酶活性增强,从而使由谷氨酸生成的α酮戊二酸增多,ATP/ADP增高,胰岛素过度释放。其典型临床表现是进食蛋白质后诱发的餐后低血糖。生化特征为血氨浓度持续升高(可达正常值上限2~3倍),尿α-酮戊二酸水平升高,二氮嗪治疗有效,部分患者可通过限制蛋白摄入避免低血糖发生。其余50%致病原因仍不明确。
CHI发生率为l/50000~1/30000。近亲婚配的群体中,发生率高达1/2500。
CHI从出生到成年早期均可发病。其中新生儿起病最为常见,常表现为巨大儿、摄食不良、不耐受饥饿和持续性低血糖等。低血糖发作时可表现为嗜睡、肌张力低下等,也可表现为神经系统后遗症甚至死亡,如呼吸暂停、癫痫发作和昏迷等。在迟发性CHI中,患者常表现为低血糖反应,包括面色苍白、出汗和心悸等症状。
1.实验室检查:低血糖发作时同步检测胰岛素、C肽水平,当低血糖发作时,胰岛素及C肽值可测,提示高胰岛素性低血糖症;血清脂肪酸和酮体水平下降提示该病;必要时可行1mg静脉胰高血糖素试验及饥饿试验等鉴别。
2.遗传学检测:CHI已知致病基因的Panel检测,全外显子检测。
3.影像学:胰腺增强CT,CHI无胰腺占位征象;18F-DOTA-PET/CT,用以鉴别局灶型和弥漫型CHI,为后续手术治疗提供参考。
4.病理:CHI从组织病理学上可分为弥漫型和局灶型。在外科手术前鉴别弥漫型和局灶型具有重要意义。弥漫型表现为胰腺弥漫分布的细胞核明显增大的β细胞,局灶型表现为胰腺内局灶性的结节或腺瘤样增生肥大的β细胞。其中弥漫型占CHI患者的40%~50%,可见于上述12种基因的纯合突变或复合杂合突变。局灶型约占50%,目前认为其病因为遗传自父源性的ABCC8或KCNJ11基因突变、同时发生该区域的母源性等位基因丢失。
CHI是一种罕见的遗传性疾病,具有明显的异质性,目前尚无统一的诊断标准。
常用的诊断标准为:当血糖<3mmol/L时:
1.胰岛素水平可测。
2.C肽水平可测。
3.低脂肪酸血症(血浆游离脂肪酸<1.5mmol/L)。
4.低酮血症(血浆β-羟丁酸<2mmol/L)。
必要时可行1mg静脉胰高血糖素试验(1mg静脉输入胰高血糖素,血糖变化>30mg/dl)、饥饿试验(可诱发低血糖)等。
由于不同遗传学类型CHI的临床治疗措施存在较大差异,对于可疑该类疾病患者应进行遗传学分析,指导临床治疗。
CHI需与患糖尿病母亲的新生儿或围生期应激导致的短暂性高胰岛素血症、外源性胰岛素或磺酰脲类药物、胰岛素瘤、糖原累积症和Beckwith-Wiedemann综合征等相鉴别。胰岛功能检查、影像学及基因检测对于病因的鉴别诊断具有重要意义。
主要的考虑因素如下:
1.年龄:CHI常以新生儿起病并表现为出生时巨大儿。
2.既往史:是否服用降糖药物或使用外源性胰岛素。
3.家族史:母亲是否存在妊娠期糖尿病,可与糖尿病母亲生产新生儿出现的短暂性高胰岛素血症进行鉴别;是否近亲婚配,近亲婚配人群中CHI出现概率明显增加。
4.体格检查:糖原累积症常表现为肝大,CHI无此表现。
5.实验室检查:肝肾功能、胰岛功能、血酮体、脂肪酸以及基因检测(包括CHI及糖原累积症相关基因)等。
6.影像学:胰腺影像学,与胰岛素瘤所致低血糖症相鉴别。
包括药物治疗和外科手术治疗。治疗目标是将血糖维持在3.5mmol/L以上。对于餐后高胰岛素血症性低血糖,首先需调整饮食结构。
1.低血糖的紧急处置如通过口服糖类无法纠正低血糖,可即刻给予1~2ml/kg的10%葡萄糖,并以不低于6~8mg/(kg·min)的葡萄糖维持静脉输注,将血糖维持在3.5mmol/L以上。肌内注射胰高糖素数分钟即可起效。
2.长期治疗
(1)内科治疗:谷氨酸脱氢酶突变致CHI患者可通过限制食物蛋白质的摄入(尤其是每餐亮氨酸含量<200毫克)避免低血糖发生。目前用于治疗CHI的药物主要有以下几种。
1)二氮嗪:为首选用药,起始剂量5~20mg/(kg·d),分3次使用,渐减至血糖达标的最低剂量,常与氢氯噻嗪[0.25~2.50mg/(kg·d)]配合使用。二氮嗪治疗的有效标准为正常饮食患者过夜后或停止静脉补液至少5天后,仍能维持空腹和餐后血糖>3.0mmol/L。二氮嗪的不良反应包括多毛、水钠潴留、低血压等;氢氯噻嗪则具有减少二氮嗪引起的水钠潴留作用。
2)生长抑素类似物:奥曲肽可与生长抑素受体结合,从而抑制胰腺内、外分泌功能,故可用于治疗CHI。但由于易快速耐药,长期应用受限制;一般剂量为5~25μg/(kg·d),多用于二氮嗪治疗无效的患者。有效标准与二氮嗪相同。严重不良反应包括肝炎、坏死性小肠结肠炎和长QT综合征;常见的不良反应包括呕吐、腹泻、胆石症等。此外,长效的生长抑素类似物如兰瑞肽等也已应用于CHI的治疗,并取得了一定效果。
3)胰高血糖素:胰高血糖素具有促进肝糖原分解作用,可有效拮抗胰岛素作用而升高血糖。但胰高血糖素作用时间短、需每日多次皮下注射,且药物极易形成结晶,存在皮肤坏死性红斑风险,无法长期应用;目前多用作低血糖时的短期用药,常用剂量为1~20μg/(kg·h)。4)KATP通道的低分子校正剂:磺脲类药物及卡马西平等可诱导KATP通道在β细胞膜上的表达,可用来治疗因ATP敏感K离子通道数量减少而引起的CHI。此外,GLP-1受体拮抗剂、mTOR拮抗剂等也被尝试应用于CHI的治疗。
(2)外科治疗:手术易造成胰腺内、外分泌功能障碍,应严格掌握手术适应证,可用于药物治疗无效、药物治疗依从性差者。
1)对于大多数局灶型CHI患者,局部病灶切除可以实现病情缓解。
2)对于药物治疗无效的弥漫型CHI患者,需行胰腺次全(95%~98%)切除术。有研究报道,约50%患者在术后仍有低血糖事件,或出现术后糖尿病、胰腺外分泌功能障碍。
诊疗流程(图 20-1)
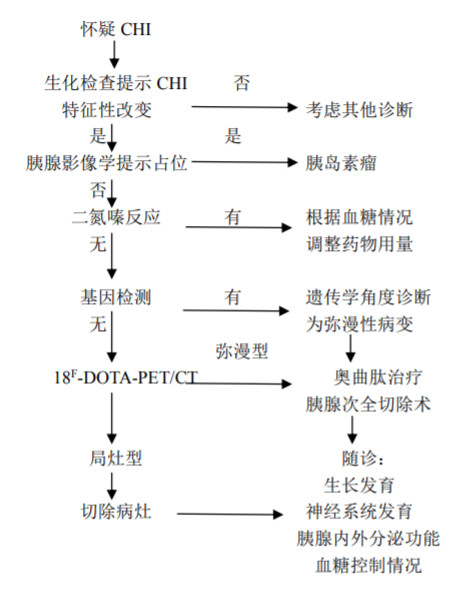
图 20-1 先天性高胰岛素性低血糖血症诊疗流程
参考文献(略)
来源:国家卫生健康委员会《罕见病诊疗指南(2019年版)》
查看更多