查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过







研究标题:Tremelimumab(T)联合德瓦鲁单抗(D)治疗晚期肝细胞癌(aHCC)的疗效、耐受性和生物学效应
摘要号:4508



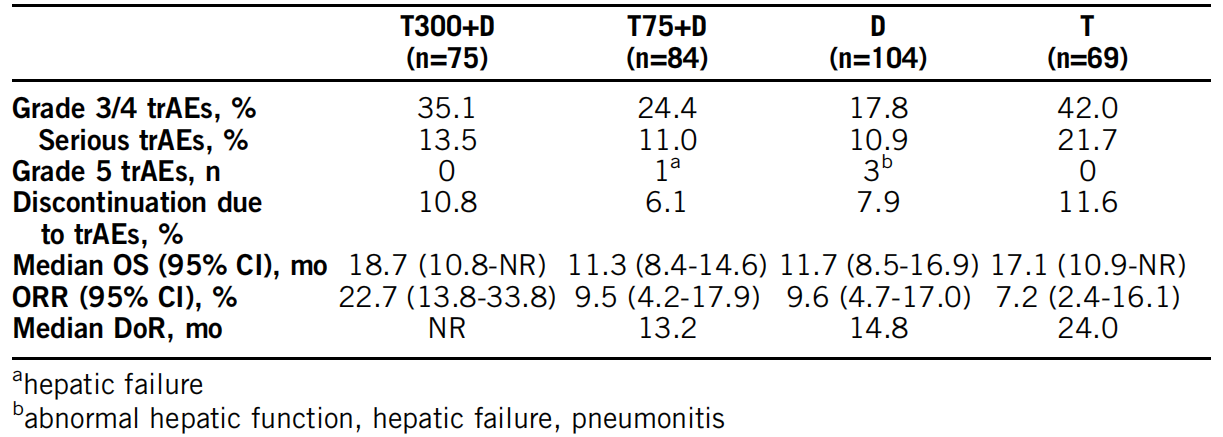
本摘要报道了由阿斯利康公司发起的,在晚期肝细胞癌患者中观察双免疫联合方案安全性、有效性及生物活性的研究(NCT02519348)结果,研究药物包括两种针对不同作用靶点的免疫检查点抑制剂(ICI):CTLA-4单抗tremelimumab(T药)及PD-L1单抗德瓦鲁单抗(durvalumab,D药)。由于在该研究的前期队列中已观察到T+D联合方案较好的安全性及疗效,且随着T药剂量的提高抗肿瘤活性及患者免疫反应均有增强的趋势,因此进一步开展了对比两种药物不同剂量、不同频次组合与T或D单药的随机对照试验。研究对象既包含索拉非尼治疗失败或不耐受的二线患者,也包括拒绝接受索拉非尼治疗的一线患者,截至2019年2月,共332例未接受过ICI治疗的晚期肝癌患者入组了该研究。研究结果表明T300+D 组(T 300 mg + D 1500 mg 单次用药后D单药每4周维持)患者较T和D单药组患者获得更高的客观缓解率(22.7%,RECIST 1.1标准)和较长的生存时间(mOS 18.7个月),然而同时也表现出较高的不良反应发生率(35.1%的患者发生3/4级不良反应,因治疗相关不良反应终止治疗者达10.8%)。
双免疫联合治疗在肝癌领域已展现出较好的应用前景,此前施贵宝公司纳武利尤单抗(PD-1单抗,O药)与伊匹木单抗(CTLA-4单抗,Y药)的联合方案NIVO1+IPI3在既往接受过索拉非尼治疗的50例肝细胞癌患者中取得了32%的客观缓解率及22.8个月的中位总生存期(Checkmate 040 I/II期研究A亚组),于2020年3月11日获得美国FDA加速批准用于晚期肝癌二线治疗,然而使用该方案的患者53%出现了3/4级治疗相关不良反应,也高于摘要4508报道的T300+D方案,似乎提示双免疫联合治疗在获取更好疗效的同时也将会带来更多的不良事件。
摘要4508除了报道研究的临床疗效指标外,还对患者应用ICI后的免疫活性进行了观察,发现在T300+D 组患者中可观察到独特的T细胞增殖反应,其中CD8+细胞毒T细胞增加更为明显。目前阿斯利康公司已尝试将该组合推向肝癌的一线治疗,一项在未接受过系统治疗的晚期肝癌患者中与标准治疗索拉非尼头对头的国际多中心III期临床试验(HIMALAYA研究,NCT03298451)正在进行中,该研究在全球共计划入组1200例患者,国内由于遗传办批件申报流程原因研究入组稍延迟,然而其结果值得期待。

背景:本试验(NCT02519348)初期的队列研究显示2种免疫检查点抑制剂(ICI)T(1种CTLA-4抗体)和D(1种PD-L1抗体)联合应用在客观缓解率(ORR)和耐受性上很有前景。随后的研究显示接受大剂量T治疗的实体瘤患者可以诱导出强烈的免疫应答并提高抗肿瘤活性。因此,本项随机性研究扩展到4个组,包括单纯T治疗组、单纯D治疗组和2个T+D治疗组,其中1个T+D治疗组采用原始剂量T。
方法:未经ICI治疗的,曾接受但不耐受或拒绝索拉非尼治疗的aHCC患者随机分配接受T和D单药或联合用药方案:1)T 300+D组:T 300 mg+D 1500 mg(1次),随后D治疗,每4周1次;2)T75+D组:T 75 mg+D 1500 mg,每4周1次,共4次,随后D治疗,每4周1次;3)D单药组:1500 mg,每4周1次;4)T单药组:750 mg,每4周1次。主要研究终点是治疗安全性。其他评估指标包括由肓性独立中心评价的ORR(采用RECIST1.1版标准),缓解持续时间(DoR),循环淋巴细胞和总生存期(OS)。
结果:截止到2019年9月2日,研究共纳入332例患者。T300+D组、T75+D组、D单药组和T单药组的中位随访时间分别是11.7个月、14.6个月、8.9个月和15.8个月。治疗相关的不良事件(trAE)发生率详见表格。T 300+D组和T单药组都没有trAE导致的死亡病例。经确认,T300+D组的ORR最高(未得到DoR)且OS最长(详见表格)。T300+D组患者中发现了一种特殊的T细胞增殖情况,显示出联合用药额外的生物学活性;同时完全缓解(OR)的患者展现出较高的细胞毒性(CD8)计数。
结论:令人鼓舞的临床获益和可耐受的安全性说明与T 75+D或单药治疗方案相比,T 300+D方案能够提供最好的效益风险比。T 300+D组显示的独特的药效动力学活性进一步肯定了该方案在aHCC中的应用。目前正在进行的Ⅲ期临床试验HIMALAYA(NCT03298451)旨在评估HCC患者应用T300+D和D单药方案与索拉非尼作为一线治疗的疗效对比。

查看更多