查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





美国系统生物学研究所的玛丽·布伦科(Mary E. Brunkow)、索诺玛生物治疗公司的弗瑞德·拉姆斯德尔(Fred Ramsdell),以及日本大阪大学的坂口志文(Shimon Sakaguchi),因在“外周免疫耐受”机制方面的突破性发现,共同荣获2025年诺贝尔生理学或医学奖。他们的研究揭示了免疫系统如何避免攻击自身组织,守护人体健康的深层奥秘。
人体强大的免疫系统需要精准调控,否则便可能攻击我们自身的器官。浙大二院风湿免疫科副主任医师杜燕,对此次诺贝尔生理学或医学奖进行了解读。
免疫功能的调控主要发生在胸腺和骨髓,称之为中枢耐受,而外周耐受同样起到了重要的辅助作用,直接关系到人类的健康。如果外周耐受调控能力变弱,人类就会得自身免疫病(autoimmune disease),如果外周调控能力变强,则容易患上传染病甚至癌症。因此,理想的状态是处于免疫稳态。
那么,外周免疫耐受是如何实现的呢?
在生物界,免疫细胞通过表面抗原识别敌我,自然界的病原体有成千上万种,人体自身的细胞也有成千上万种,这就给免疫细胞的识别敌我机制提出了严峻的挑战。哺乳动物进化出了一个巧妙的办法,成功解决了这个难题。人体内有B细胞和T细胞这两类免疫细胞,分别对应体液免疫和细胞免疫,也就是用抗体来杀敌和用细胞来杀敌。我们刚生下来时,免疫系统会生产出成千上万种不同的B细胞和T细胞。之后,B细胞先去骨髓里走一遍,在那里把自己身体里的所有细胞类型认识一遍,一旦配对就被清除。T细胞则先会去胸腺里走一遍,一旦配对就被清除(图1)。
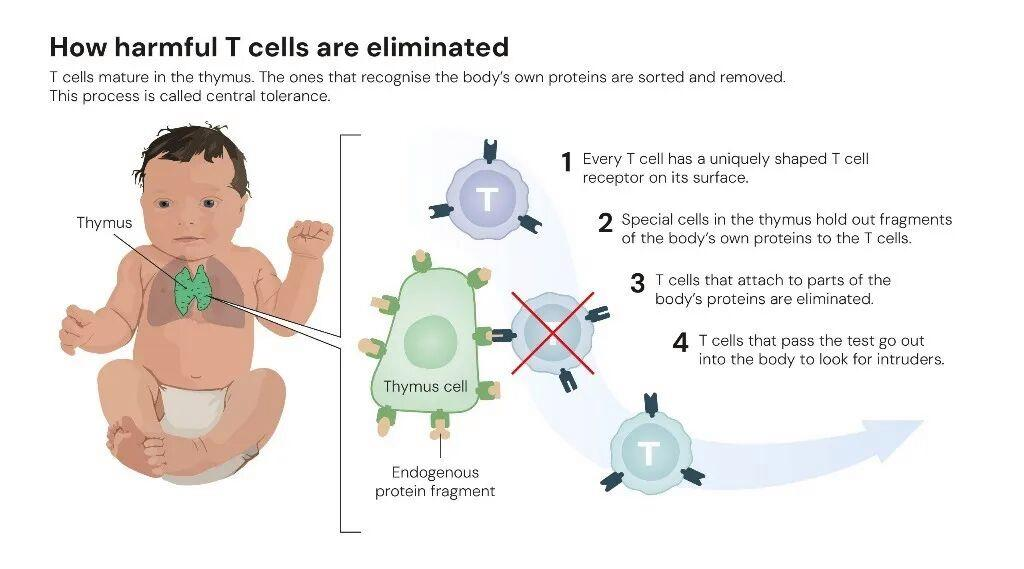
图1:有害T细胞如何被清除
引自诺贝尔生理学或医学委员会
30年前,科学家们相信免疫系统有了中枢耐受就足够了。日本科学家坂口志文(Shimon Sakaguchi)第一个发现事情并没有那么简单,哺乳动物为了防止中枢耐受出现差错,居然还进化出了第二道保险,这就是今年获奖的外周耐受故事的起源。
具体来说,坂口志文发现有一类T细胞能够防止自身免疫病,他将其命名为调节性T细胞(Regulatory T cell,通常简称为Treg)。这类细胞的作用就是抑制免疫细胞的活性,让免疫细胞不再攻击自身。事实证明Treg的作用实在太重要了,因为中枢耐受的准确率只有60-70%!换言之,如果没有第二道保险,将会有大约三分之一的人体细胞会遭到自身免疫系统的攻击,后果不堪设想。
那么,到底是哪些因素让Treg具备了免疫调节功能的呢?这个问题的答案是由美国科学家玛丽·布伦科(Mary E. Brunkow)、和弗瑞德·拉姆斯德尔(Fred Ramsdell)发现的。他俩用一种很容易患自身免疫性疾病的小鼠品系做实验,找到了其中的一个突变基因,将其命名为Foxp3。随后坂口志文证明这个基因就是他发现的Treg细胞之所以能够行使免疫调节功能的关键所在。
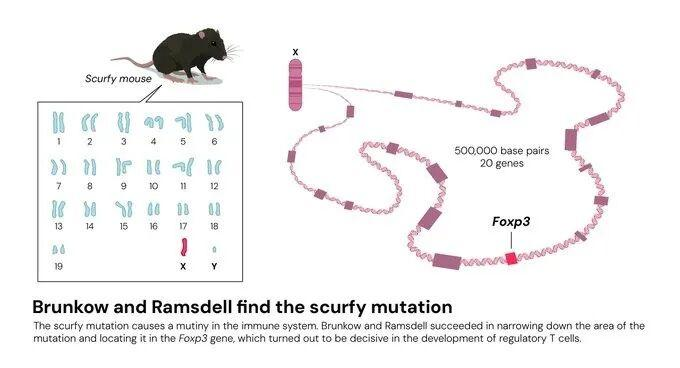
图2:Foxp3基因的发现
引自诺贝尔生理学或医学委员会
后续研究发现,这套系统的成败直接决定了我们会不会得自身免疫病。据估计,全球大约有5%-8%的人患有不同种类的自身免疫病,其中比较常见的包括系统性红斑狼疮、类风湿关节炎、I型糖尿病和多发性硬化等。另外,自身免疫病患者中,女性占比高达80%,原因就在于大部分和免疫系统有关的基因都在X染色体上,而Treg的关节转录因子Foxp3也是如此。
搞清楚Treg在保护机体免疫系统防止出现故障的重要作用后,也许有人会说,我们想办法激活Treg,就能防止自身免疫病了吧?答案并非如此,因为Treg太强的话,免疫系统就会被过度抑制,其结果就是各种传染病在体内肆虐。不仅如此,我们体内的癌细胞也会趁虚而入。

那么,如何通过调节性T细胞(Treg)治疗自身免疫性疾病呢?核心思路是修复或增强Treg细胞的数量和功能,重建免疫耐受平衡,从而抑制过度激活的自身免疫反应。
杜燕医生介绍,目前该领域已形成“直接补充”“体内调控”“细胞改造”三大技术方向,部分策略已进入临床试验阶段,具体方法及进展如下:
核心策略一:外源性Treg细胞输注(“直接补充”)。通过体外扩增或诱导功能性Treg细胞,再输注到患者体内,直接提升外周Treg细胞比例,增强免疫抑制能力,是最直接的干预方式。
1. 自体Treg细胞输注(临床转化最成熟)
原理:从患者自身外周血中分离天然Treg细胞(通过CD4+CD25+Foxp3+标志物筛选),在体外利用IL-2、TGF-β等细胞因子或特定信号分子(如雷帕霉素)扩增,确保细胞保持高纯度和免疫抑制功能后,回输到患者体内。
优势:自体细胞无免疫排斥风险,安全性高;可针对性补充患者自身不足的Treg细胞,避免“过度抑制”。
临床应用进展:已在1型糖尿病、类风湿关节炎、系统性红斑狼疮等疾病中开展Ⅰ/Ⅱ期临床试验。例如,2023年Nature Medicine报道,自体扩增Treg细胞输注可显著降低1型糖尿病患者的胰岛自身抗体水平,延缓胰岛功能衰退。
2. 异体Treg细胞输注(解决“来源不足”问题)
原理:从健康捐赠者外周血或脐带血中分离Treg细胞,体外扩增后输注给患者(类似异体输血)。为降低排斥风险,需选择HLA(人类白细胞抗原)匹配度较高的捐赠者,或通过基因编辑敲除排斥相关分子(如CD52)。
优势:可批量制备,解决部分患者(如严重自身免疫病患者)自身Treg细胞数量过少、扩增困难的问题。
挑战:存在轻微免疫排斥风险,需优化细胞匹配策略;长期安全性仍在观察中,目前主要用于小规模临床试验(如重症系统性红斑狼疮)。
核心策略二:体内调控Treg细胞(“本土激活”)。不依赖体外细胞操作,通过药物、小分子化合物或生物制剂,在患者体内直接促进Treg细胞的生成、增殖或功能增强,操作更简便,适合广泛应用。
1. 促进Treg细胞分化与增殖
靶点/药物:IL-2/IL-2受体激动剂:低剂量IL-2可特异性激活Treg细胞(因Treg细胞高表达IL-2受体α链CD25),促进其增殖且不激活效应T细胞。目前低剂量IL-2已在系统性红斑狼疮、干燥综合征中获批临床应用,可显著降低患者自身抗体水平,缓解炎症。
TGF-β信号激活剂:TGF-β是诱导初始CD4+T细胞分化为诱导型Treg细胞(iTreg)的关键细胞因子,通过小分子药物激活TGF-β信号通路(如SB431542衍生物),可在肠道、关节等炎症部位局部诱导iTreg生成,针对性抑制局部自身免疫反应(如类风湿关节炎的关节炎症)。
2. 增强Treg细胞免疫抑制功能
靶点/药物:CTLA-4激动剂:CTLA-4是Treg细胞表面核心抑制分子,可竞争性结合抗原提呈细胞的CD80/CD86,阻断免疫激活。CTLA-4激动性抗体(如abatacept)可增强Treg细胞的抑制能力,已在类风湿关节炎、强直性脊柱炎中获批上市,临床效果明确。
Foxp3稳定剂:Foxp3是Treg细胞功能的“核心开关”,部分小分子化合物(如维A酸、雷帕霉素)可稳定Foxp3蛋白表达,防止Treg细胞“失功能”转化为效应T细胞,目前在多发性硬化症的小鼠模型中已证实可延缓疾病进展。
核心策略三:基因工程改造Treg细胞(“精准升级”)。通过基因编辑技术(如CRISPR-Cas9)改造Treg细胞,赋予其“靶向性”或“抗衰竭”能力,提升治疗效率,是下一代Treg细胞治疗的重点方向。
1. 靶向炎症部位的“导航Treg”
改造思路:在Treg细胞中转入炎症部位特异性趋化因子受体基因(如针对肠道炎症的CCR9、针对关节炎症的CXCR4),使Treg细胞能精准迁移到自身免疫病的病变部位(如溃疡性结肠炎的肠道黏膜、类风湿关节炎的滑膜),避免在非病变部位“浪费”抑制能力。
进展:2022年Science Translational Medicine报道,靶向肠道的CCR9+基因编辑Treg细胞,在小鼠溃疡性结肠炎模型中可显著减少肠道炎症损伤,且停留时间比普通Treg细胞延长3倍以上。
2. 抗衰竭的“强效Treg”
改造思路:敲除Treg细胞中导致功能衰竭的基因(如PD-1、Tim-3),或转入抗炎细胞因子基因(如IL-10),增强其在慢性炎症环境中的存活能力和抑制强度。例如,敲除PD-1的Treg细胞在系统性红斑狼疮的小鼠模型中,可避免被炎症微环境“耗竭”,长期维持免疫抑制功能。
尽管Treg细胞治疗在自身免疫病中展现出明确潜力,仍需解决三大关键问题:
安全性:避免Treg细胞过度抑制导致感染风险升高(如低剂量IL-2需严格控制剂量),或基因编辑的脱靶效应;
长效性:目前外源性Treg细胞在体内存活时间较短(通常数周至数月),需多次输注,未来需通过改造细胞代谢通路(如增强线粒体功能)延长存活期;
个体化:不同自身免疫病(如1型糖尿病vs类风湿关节炎)的炎症部位、致病细胞不同,需开发“疾病特异性”Treg细胞治疗方案(如靶向胰岛的Treg、靶向关节的Treg)。
综上,Treg细胞治疗通过“补充+激活+升级”三大路径,为自身免疫性疾病提供了“从根源重建免疫耐受”的新方案,部分策略已从实验室走向临床,未来有望成为替代传统免疫抑制剂(如糖皮质激素)的“精准疗法”。
解读人介绍
杜燕 副主任医师
风湿免疫科
擅长:类风湿关节炎、系统性红斑狼疮、痛风、强直性脊柱炎、肌炎/皮肌炎、血管炎等常见风湿病的诊治

另外,浙大二院消化内科陈焰主任医师,也在自己的自媒体上发表了对于此次诺贝尔生理学或医学奖的理解,以及对炎症性肠病(IBD)未来诊治方面的影响。
陈焰认为,Treg细胞可以比作“免疫系统的刹车” 或“保安”,能调节免疫系统平衡。IBD(包括溃疡性结肠炎、克罗恩病)的发病,也与Treg细胞这一“刹车”未起效、免疫过度活跃攻击自身肠道有关。目前治疗IBD常用激素、免疫抑制剂(如硫唑嘌呤),本质就是压制过度免疫以控制病情。她认为,随着Treg细胞等基础研究推进,加之AI助力,未来IBD治疗大概率会有重大突破,甚至可能治愈。
陈焰 主任医师
浙大二院消化内科副主任 IBD多学科诊治中心主任
擅长:IBD消化系统疾病的诊治,尤其擅长溃疡性结肠炎和克罗恩病、小肠疾病和各种疑难肠道疾病的诊治
通讯员 童小仙
查看更多