查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





核素治疗是近年肿瘤治疗的研究热点,镭-223(Ra-223)作为全球首个发射α粒子的放射性药物,自2013年5月经FDA批准上市以来,其已成为核素治疗的代表药物之一。
在刚刚落下帷幕的全球肿瘤领域年度盛会——美国临床肿瘤学会(ASCO)年会中,亦有多项关于镭-223的最新研究进展公布,主题涉及真实世界数据以及核素联合治疗,再度引发学界对于核素治疗当前探索与未来趋势的热烈讨论。
本文特邀上海交通大学医学院附属仁济医院的潘家骅教授为大家点评2024 ASCO年会中关于镭-223的最新研究进展,并就以镭-223为代表的核素治疗的未来探索进行展望。
潘家骅 教授
本次ASCO大会上,基于REASSURE研究的真实世界数据再添新证。本次公布的研究比较了美国学术医疗中心与社区医院在应用镭-223治疗mCRPC患者的差异。此次分析共纳入498例接受镭-223治疗的mCRPC患者。结果显示,学术医疗中心治疗的患者通常更年轻(70岁vs 76岁),且有更多患者在镭-223治疗前后接受了更多延长生命(life-prolonging therapy ,LPT)的治疗(治疗前:69% vs 49%,治疗后:42% vs 26%)。两种环境下患者的总体生存率相似,中位生存期分别为17.2个月和18.4个月。此外,社区医院的患者更常使用骨保护剂,且在治疗期间有更高的临床意义上的疼痛反应率。
此次REASSURE研究再登国际学术舞台,再次印证镭-223在真实世界使用过程中可以给患者带来良好的生存获益和生活质量,进一步夯实了镭-223治疗骨转移mCRPC基石的地位。
放射性核药探索如火如荼,
更多创新方案未来可期
镭-223是一种靶向α粒子的治疗,其发射的α粒子能够在邻近肿瘤细胞中引发高频率的双链DNA断裂,从而产生强效的细胞毒效应。关键III期ALSYMPCA研究结果显示,与安慰剂相比,镭-223可改善骨转移去势抵抗性前列腺癌(mCRPC)患者的总生存期(OS),延迟至首次症状性骨相关事件(SSE)的时间,提高患者生活质量(QoL)。基于该研究数据,镭-223于2013年被美国FDA和欧盟监管部门批准上市,并于2020年进入中国,获批用于治疗伴有症状性骨转移且无已知内脏转移的mCRPC患者。
临床应用10余年来,镭-223造福了众多骨转移mCRPC患者,也积累了丰富的真实世界数据。其中,备受学界关注的真实世界研究REASSURE研究是一项全球性、观察性研究,旨在探究镭-223在常规临床环境中用于骨转移mCRPC患者的疗效与安全性。既往该研究已多次登上国际学术会议舞台,如2023年美国临床肿瘤学会(ASCO)大会、2023年欧洲肿瘤内科学会(ESMO)年会、2024年美国临床肿瘤学会泌尿生殖系肿瘤分会(ASCO-GU 2024)年会等,以扎实的循证数据证实,真实世界中镭-223治疗mCRPC患者具有良好疗效和可耐受安全性,患者中位OS可达17.8个月。镭-223与新型雄激素受体拮抗剂(ARi)联合使用可将中位OS提升至22.2个月,且未显著增加不良事件。
随着对镭-223作用机制的深入了解,越来越多的研究者正在探索其与化疗、靶向治疗等其他治疗手段的联合方案,以期进一步提高生存期和降低骨相关不良事件的发生率。
多西他赛是转移性前列腺癌的标准治疗之一,通过抑制微管解聚及正常重组,导致癌细胞不能进行正常的有丝分裂,最终导致肿瘤细胞死亡。今年ASCO会议上,一项创新型、前瞻性、单臂I期临床试验(Abs5049,NCT03737370)探索了镭-223和分次多西他赛联合治疗在mCRPC患者中的安全性和有效性。结果表明,在有效性方面,联合治疗表现出更长的无进展生存期(图1),中位PFS达到了11.7个月(95%CI 8.7~20.1)。同时,联合治疗有着更高的PSA反应率(图2),所有患者均出现PSA下降,PSA50反应率达到51.4%(18/35),PSA90反应率达到25.7%(9/35),更在控制骨转移方面也表现出优势。在安全性方面,联合治疗在保持两种药物剂量强度的同时,具有良好的可行性和耐受性(图3),35例受试者均没有出现发热性中性粒细胞减少症、骨折及5级毒性不良反应。值得期待的是,评估多西他赛联合镭-223与多西他赛单药治疗疗效和安全性的Ⅲ期临床试验DORA研究目前正在进行中,期待该研究能够早日公布出色数据。
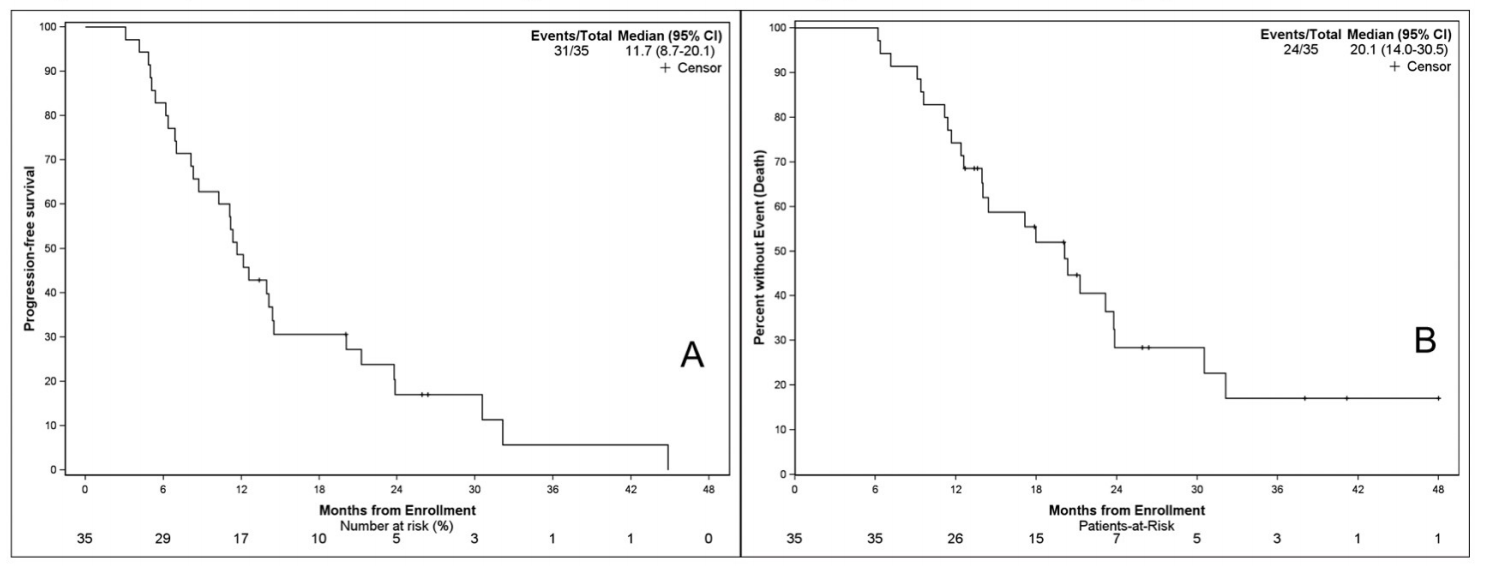
图1.无进展生存期(A)和总生存期(B)的Kaplan-Meier曲线分析
图2. 镭-223和多西他赛联合治疗的PSA瀑布图
图3. 镭-223和多西他赛联合治疗的不良事件
靶向治疗方面,AR抑制剂、PARP抑制剂和镭-223联用也都有相关探索。PEACE III研究旨在评估镭-223联合ARi恩扎卢胺的有效性和安全性,初步结果显示该联合方案可显著改善mCRPC患者的骨折风险。据悉,该研究将在2024 ESMO大会公布最终研究结果;COMRADE研究初步结果显示,镭-223联合奥拉帕利安全可控,接受镭-223 +奥拉帕利治疗的BRCA2突变骨转移mCRPC患者的疾病控制时间有所延长,极具探索价值。
此外,镭与免疫治疗、外放射治疗、DDR抑制剂等不同手段的联合治疗也均有多项研究在开展当中,期待这些研究能够早日开花结果,拓展更多镭-223联合治疗新思路,为广大患者带来新选择。
镭-223的临床应用和相关研究只是放射性核药领域火热探索的一点缩影,实际上,放射性核药的未来还有诸多令人遐想的方向,包括新型放射性元素的探索,新靶点以及新载体平台的研发。
对于新核素的探索,由于α粒子射程短、能量强,能够有效增强对病变区域的杀伤,降低对正常组织的损伤,因此学界更多聚焦于探索发射α粒子的新型元素,其中,225Ac和213Bi已进入临床研究和临床阶段,212pb、149Tb和211At等也都备受研究者关注。在2024年美国癌症研究协会(AACR)年会上,就有两项关于新放射性元素225Ac的临床前研究公布结果被公布,两项研究均评估了225Ac标记的PSMA靶向放射性药物(225Ac-PSMA-Trillium)治疗mCRPC的疗效和安全性,结果提示该研究候选化合物用锕-225标记,包含一种具有定制白蛋白结合部分的新型PSMA(前列腺特异性膜抗原)-靶向小分子,可以在改善治疗效果的同时,减少在唾液腺等正常器官的不良反应[7]。临床前研究显示在前列腺癌异种移植模型小鼠中表现出良好的体内疗效和生物分布特征。目前剂量递增研究(NCT06217822)已在开展当中,期待未来能有更多好消息公布。
对于新靶点的探索,一种思路是探索已知靶点在新疾病/瘤种中表达,另一种思路是探索新生物学途径和新的靶点,如C-X-C趋化因子受体4型-基质细胞行牛因子1(SDF-1)轴用于血液系统肿瘤,成纤维细胞激活蛋白(FAP)用于多种基质丰富的肿瘤,神经降压素受体1(NTR1)用于胰腺癌等。
对于新靶向载体平台,学界目前正在探索肽以外的更多平台,如纳米抗体和小分子,二者均具有分子量小、组织渗透性高等优势,在诊断试剂和治疗药物方面都具有研发潜力。
镭-223的临床应用如同一束希望之光,照亮了前列腺癌核素治疗的前路。此次ASCO盛会中,镭-223在真实世界研究、联合治疗探索方面均有新数据公布,进一步丰富其临床循证证据,拓展其临床应用方案。在整个核素治疗领域,围绕新型核素、新型靶点和新型载体平台的探索也均呈如火如荼之势,期待这些探索都能早日传来捷报,应用于临床,造福更多患者!
查看更多