查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






亲爱的读者朋友,您的意见对我们非常重要!为了更好地了解您的需求,提升文章内容质量,诚邀您花几分钟参与本次有奖问卷调研。参与者有机会获得精美奖品!
上期回顾

自身免疫性胰腺炎(AIP)与胰腺恶性肿瘤的鉴别诊断是临床重要挑战。随着诊疗技术进步及多学科协作的普及,更多AIP患者得以明确诊断,避免了不必要的手术干预。鉴于两者临床表现相似,鉴别需要综合实验室检查(如IgG4)、影像学特征(CT/MRI/EUS)、病理学证据、激素治疗反应及临床经验进行系统评估。本文基于最新研究、指南与实践,阐述AIP分型特征,并探讨其与胰腺恶性肿瘤的优化鉴别策略。
2011年国际胰腺病协会(IAP)制定的AIP国际共识诊断标准(ICDC)首次将AIP分为Ⅰ型和Ⅱ型,诊断基于胰腺影像学特征、血清学标志物、其他器官受累情况、组织病理学结果及激素治疗反应五个方面。
Ⅰ型AIP通常伴有血清IgG4升高,临床特征明确,诊断相对容易且可免除组织学检查,与胰腺肿瘤的鉴别度较高;而Ⅱ型AIP及IgG4阴性的Ⅰ型AIP由于缺乏特异性血清学标志物,必须依赖组织学确诊,与胰腺肿瘤的鉴别诊断较为困难。当AIP表现为局灶性胰腺病变(如胰腺占位)时,无论Ⅰ型(IgG4阴性)还是Ⅱ型,其与胰腺肿瘤的鉴别诊断难度均显著增加,此时需要结合影像学、血清学、组织病理学及激素治疗反应进行综合判断。
Ⅰ型AIP好发于中老年男性,病理特征为淋巴浆细胞硬化性胰腺炎(LPSP),以胰管周围大量淋巴细胞及IgG4+浆细胞弥漫浸润为特点,部分合并伴淋巴浆细胞的闭塞性静脉炎。临床表现谱广泛,可自轻度自限性黄疸至严重无痛性梗阻性黄疸(难与胰腺癌鉴别)。约80%患者合并IgG4相关胆管炎等胰外表现(泪腺、涎腺、眼眶、肺、腹膜后等常见),虽可提示诊断,亦需与胰腺癌转移灶鉴别。血清IgG4升高(常>2倍正常上限)为其特征,但需警惕少部分胰腺癌/胆管癌亦可升高,且发病率更高,故确诊前必须排除恶性病变。影像学可表现为胰腺占位、弥漫/局灶性肿大(腊肠征)或胰管狭窄。部分高度疑诊且排除恶性的患者,激素诊断性治疗反应良好可支持诊断。
相较于Ⅰ型自身免疫性胰腺炎(AIP),Ⅱ型AIP具有以下特征:① 好发年龄更趋年轻化;② 病理学以特发性导管中心性胰腺炎伴粒细胞性上皮损害为典型表现;③ 胰腺外器官受累较少,但合并炎症性肠病时可作为重要诊断支持;④ 血清学缺乏特异性标志物,仅少数病例出现IgG4水平升高;⑤ 影像学表现与Ⅰ型AIP相似。这些特点使得Ⅱ型AIP的诊断必须依赖组织病理学确诊,显著增加了临床诊断的难度。
典型Ⅰ型AIP(IgG4升高、胰腺弥漫性增大呈腊肠征)较易与胰腺癌鉴别。而IgG4阴性Ⅰ型及Ⅱ型AIP因临床表现不典型、IgG4正常、影像呈占位性病变,鉴别难度显著增加。故两者鉴别需要综合临床、血清学、影像学特征,依托多学科诊疗(MDT)模式,以优化诊断策略。
胰腺癌所致梗阻性黄疸常呈无痛性、重度并进行性加重;而AIP相关黄疸具有波动性。需警惕:少数AIP可表现为胰头占位伴重度黄疸,若血清学及影像学不典型,易致误诊,引发非必要手术及相关并发症。此外,极少数胰腺癌可合并AIP,增加诊断复杂性。
IgG4是IgG4 相关疾病的重要血清学标志物,但其升高亦可见于慢性胰腺炎及10%~15%的胰腺导管腺癌(PDAC)患者。PDAC 患者的 IgG4 水平通常<2 倍正常值上限,而此临界值(2×ULN)诊断 IgG4-RD(如 IgG4 相关 AIP)特异性达 92.6%,但对Ⅱ型 AIP 诊断无价值。
此外,约10%PDAC患者CA199无法检出。近年研究提出联合检测血清IgG4与CA19-9鉴别诊断。其中一项研究提示:IgG4 > 1000 mg/L 且 CA19-9<74 U/ml 鉴别AIP与PDAC的敏感度达94%,特异度为100%,但其诊断效能需要大样本验证。
AIP的胰腺实质形态可分为弥漫型(典型)、局灶型(约占30%)和多灶型。
腹部CT和MRI是评估的主要手段。AIP的经典影像表现为弥漫性胰腺肿大(“腊肠征”)(见图1a-1c),常伴边缘光滑的低密度/信号晕环(“假包膜征”)(见图1b-1c)及主胰管不规则狭窄。增强CT显示AIP静脉期延迟强化(图1c)(关键点,有别于胰腺导管腺癌/PDAC)。约30%的AIP表现为局灶性肿块(见图1b),影像学难与肿块型慢性胰腺炎(MFCP)或PDAC区分。
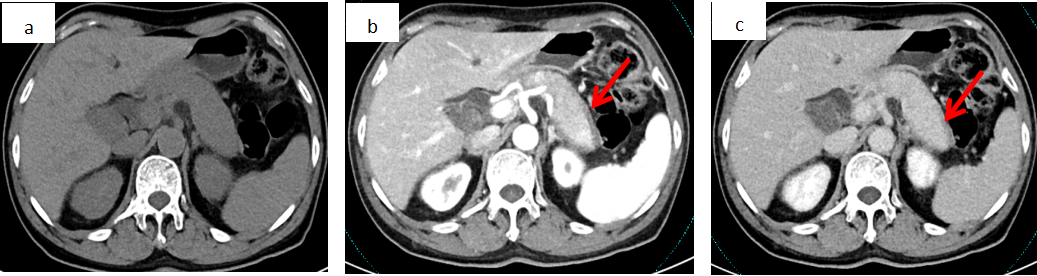
图1a. 平扫显示胰腺肿胀呈腊肠样,羽毛状边缘消失
图1b. 动脉期显示胰腺实质强化不均匀减低,胰腺周围可见环绕包膜增厚影(假包膜征)(箭头所示)
图1c. 静脉期显示胰腺周围局部包膜轻度强化,见假包膜征(箭头所示)
PDAC的典型胰管狭窄呈短段截断状;胰头癌可累及胆总管(CBD),呈现“双管征”(CBD及主胰管/MPD扩张)。晚期PDAC常伴血管侵犯,而AIP合并腹膜后纤维化累及血管时可类似。
辅助鉴别征象包括:胰腺钙化/囊肿提示MFCP或AIP晚期;胰外器官(如肾脏双侧斑片状病变、淋巴结、腮腺)受累则提示IgG4相关疾病(IgG4-RD)。综上,增强CT鉴别AIP与PDAC的敏感性为59%(95%CI:41%~75%),特异性高达99%(95%CI:88%~100%)。
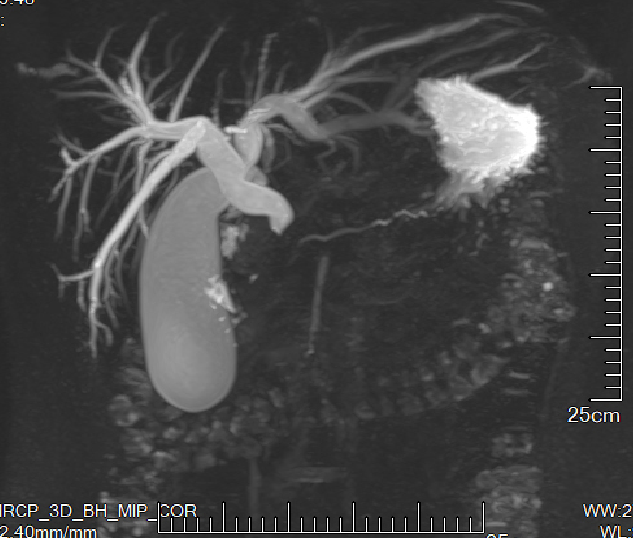
在MRI检查中,AIP在T1WI呈低信号、T2WI呈高信号(同PDAC),DWI均呈弥散受限(高信号),但AIP在ADC图低信号更显著。支持AIP的MRI征象包括:胰周低信号晕环(T1/T2WI)、受累胰段广泛不规则狭窄(≥3 mm)无上游扩张(见图2)、穿管征(促胰液素MRCP更佳)。MRI诊断AIP敏感性较低(28.6%~44.4%),但特异性达100%。
18F-氟脱氧葡萄糖(18F-fludeoxyglucose,18F-FDG)正电子发射计算机断层显像(positron emission tomography,PET)/CT,即18F-FDG PET-CT,基于肿瘤代谢特征显像,虽在恶性肿瘤诊断及转移灶识别中价值明确,但因炎性病灶(如AIP)亦可摄取FDG,故无法单独鉴别AIP与胰腺癌。鉴于Ⅰ型AIP常伴胰外受累,若PET/CT发现泪腺、涎腺或腹膜后淋巴结等部位异常FDG摄取,则高度提示Ⅰ型AIP。近期一项研究(26例AIP vs 40例胰腺癌)证实:AIP组胆管、涎腺及男性前列腺等胰外FDG摄取灶显著多于胰腺癌组,提示PET/CT具鉴别价值。
超声内镜(EUS)的开展为鉴别AIP和PDAC提供了极大帮助。AIP的常规EUS 特征可分为两类:典型 AIP 改变(如胰腺弥漫肿大、弥漫性低回声(见图2a)、胰周低回声包鞘、胆管壁均匀增厚)和符合慢性胰腺炎的改变[如点状或线状强回声(见图3a)、小叶化/蜂窝样改变、胰管壁回声增强]。
局灶型 AIP 常需与PDAC 鉴别,其预测因素包括胰管壁增厚(回声增强)、胆管壁增厚、特定弹力显像特征及无胰周血管受累。
此外,CE-EUS可实时动态评估病灶血供:动脉期呈高或等强化、造影剂分布均匀、病灶内部缺乏不规则血管这三点更支持局灶型 AIP。
对于非典型AIP病例(如胰腺局灶肿胀,血清IgG4正常或轻度升高),常需与胰腺恶性肿瘤相鉴别,需行组织病理学检查。因此,EUS引导下细针抽吸/活检(EUS-FNA/B)获取组织学诊断,成为诊断困境之下的关键手段。EUS-FNA或可诊断或排除胰腺癌,但因样本量小常难以确诊AIP,故推荐采用EUS引导下组织活检(EUS-FNB)。新型FNB穿刺针可获取更多胰腺组织(尤其核心组织),使EUS-FNB诊断AIP成为常规实践(见图3b),并被日本AIP共识指南推荐。十二指肠乳头活检IgG4免疫组化阳性可支持AIP诊断。
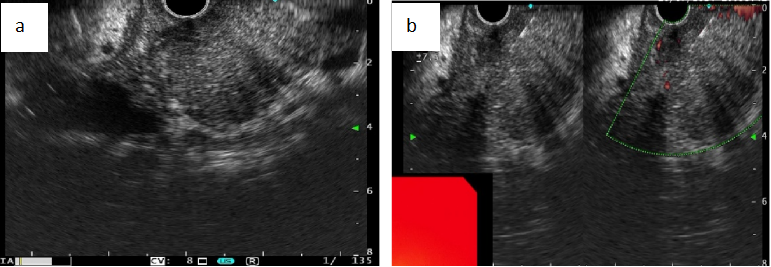
图3a. B模式EUS下AIP表现:弥漫性低回声,内见点状高回声;图3b. EUS-FNB获取胰腺组织
确诊AIP后推荐激素治疗,诊断困难时可考虑试验性激素治疗。核心鉴别依据在于,虽然90%的PDAC和AIP患者胰腺均存在FDG摄取异常,但仅AIP在类固醇治疗1周后摄取显著减弱或消失,而PDAC无此变化;MRCP/增强MRI可通过对比治疗前后主胰管(MPD)狭窄程度、病灶强化范围评估疗效。须警惕试验性治疗风险:若误诊PDAC,激素可能延误手术时机、促进肿瘤进展或转移。因此,治疗期间必须动态监测IgG4水平、胰管狭窄改善及黄疸消退等指标,一旦无效需高度警惕PDAC并及时手术干预。
此外,AIP与PDAC的关联性存在两种假说:其一认为AIP是PDAC先兆,证据为PDAC组织中IgG4⁺浆细胞浸润增多且AIP患者胃癌/肺癌风险增高,机制涉及慢性炎症致K-ras突变癌变或肿瘤触发IgG4反应诱发AIP(症状可早于PDAC);其二认为AIP是PDAC副瘤综合征,表现为AIP确诊1年内癌风险最高、PDAC术后AIP可缓解,且患者多具高龄、新发糖尿病及短期体重骤降特征。
临床需警惕:AIP激素治疗期间必须动态监测影像学及血清IgG4,高龄患者突发血糖骤升或体重锐减时应立即排查PDAC并手术评估。
综上,AIP 与PDAC的鉴别诊断始终是临床难点。误诊后果严重:将 AIP 误诊为 PDAC 会导致不必要的手术,增加患者身心负担;反之,将 PDAC 误诊为 AIP 则会延误治疗,危及生命。因此,临床医师需高度重视 AIP,拓宽诊断思路,通过详细询问病史、综合分析症状与辅助检查、审慎评估检查结果的可靠性及矛盾点,以提高诊断准确性,避免不必要的手术。
自身免疫性胰腺炎(AIP)分为Ⅰ型和Ⅱ型。Ⅰ型AIP多伴有血清IgG4升高,临床表现典型,诊断相对容易,通常无需组织学检查即可确诊,与胰腺肿瘤鉴别较明确;而Ⅱ型AIP和IgG4阴性的Ⅰ型AIP因缺乏特异性临床表现和血清学标志物,必须依靠组织学确诊,与胰腺肿瘤鉴别困难。特别是局灶性AIP常表现为胰腺占位性病变,更增加了鉴别诊断的难度。鉴于AIP与胰腺肿瘤的临床表现相似,需综合实验室检查、影像学特征、病理学结果、诊断性激素治疗反应及临床经验进行鉴别诊断。
1.AIP在CT或MRI上的典型特征是()
胰腺弥漫性肿大呈“腊肠样”改变
胰腺局部占位伴周围血管侵犯
主胰管不规则狭窄伴远端扩张
胰腺实质内低回声结节
2.AIP对哪种治疗敏感?()
手术切除
化疗
放疗
类固醇激素治疗

鼓楼领学⑫|慢性胰腺炎相关癌变风险的内镜监测策略
作者:南京鼓楼医院 郑汝桦
1.下哪项是"以急性胰腺炎为首发表现的胰腺癌"的典型临床特征?
A.血清淀粉酶显著高于单纯急性胰腺炎组
B.腹胀/呕吐/发热发生率高于单纯急性胰腺炎组
C.消耗性体征(如体重下降)异常突出
D.脓毒症发生率显著升高
答案:C
2.影像学阴性但CA19-9/淀粉酶比值>0.4的高危患者,首选进一步检查是?
A.增强CT(层厚≤1mm)
B.内镜超声(EUS)弹性成像+超声造影
C. MRCP胰腺薄层扫描
D.复查CA242
答案:B


查看更多