查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者 北京天坛医院 刘格宇 唐鹤飞 王永刚
偏头痛是一种高度致残性的神经系统疾病。全球疾病负担(GBD)研究数据显示,偏头痛的全球患病率约为14%,伤残调整生命年(DALY)在整个神经系统疾病中位居前三[1-2]。按照头痛每月发作天数,偏头痛可以分为发作性偏头痛和慢性偏头痛。慢性偏头痛表现为头痛发作天数≥15 d/月、持续3个月以上[3]。每年约有2.5%的发作性偏头痛逐渐发展为慢性偏头痛[4]。随着疼痛的慢性化进展,患者生活质量更差、残疾程度更高,且出现心理共病的比例更高[5-6]。此外,越来越多的研究认为药物过度使用性头痛(MOH)是慢性偏头痛的结果,11%~70%的慢性偏头痛患者都存在急性止痛药过度使用的情况[7]。高频的每月头痛天数与药物过度使用之间形成恶性循环,这使得探究偏头痛慢性化的病理生理机制更为复杂。
作为一种无创、非侵入性的技术,神经影像学已被广泛应用于慢性偏头痛机制的探究中。常用的成像技术主要包括结构磁共振成像 (sMRI) 、功能磁共振成像 (fMRI) 及弥散张量成像 (DTI)。因此,本文从结构和功能的角度全面总结慢性偏头痛及共病MOH的影像学研究,并汇总潜在的影像学标志物,为进一步的研究提供见解。
sMRI的优势在于能够生成高分辨率的图像,从而精确地对脑区的解剖结构和病理变化进行量化,其中主要的分析方法包括基于体素的形态学分析(VBM)和基于表面的形态学分析(SBM)。具体详见表1和表2。
VBM多用于客观描述灰质体积(GMV)及表观密度。多项研究采用VBM的分析方法对慢性偏头痛患者的结构变化进行探究,虽然研究结果之间存在异质性;但大多数影像学数据表明,与健康受试者相比,慢性偏头痛患者在涉及疼痛调节、情感处理以及认知方面相关的脑区GMV存在异常。综合现有的结果,偏头痛患者表现出广泛且分布不均的GMV改变,涉及额叶、颞叶、枕叶、小脑、脑干及边缘系统核心结构(如杏仁核、前扣带回、岛叶和壳核和海马)。
对比发作性偏头痛,慢性偏头痛的额叶、前扣带回及双侧脑岛的GMV减少更显著,这提示在慢性化过程可能与前额叶-边缘系统调控网络的结构异常密切相关[8]。MOH患者则表现出导水管周围灰质、丘脑和腹侧纹状体的体积增大,以及额叶、眶额叶皮质和岛叶的体积下降,停药后部分脑区改变具有可逆性[9]。在多数研究中,海马则表现为GMV减少[10],这反映了慢性疼痛对记忆与情绪调控区域的应激性损害。总体而言,这些结构异常提示偏头痛的病理机制不仅涉及痛觉传导通路,也与情绪、认知及中枢调控网络的可塑性改变密切相关。
表1 慢性偏头痛(含药物过度使用性头痛)患者基于体素的形态学分析部分脑区结果汇总


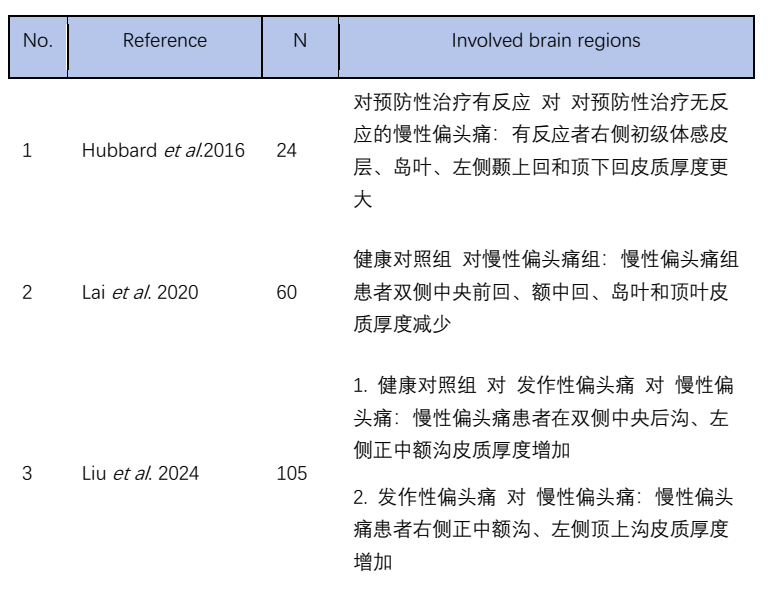
VBM则可以评估皮质其他特征,如皮质厚度、表面积和折叠指数等,在反映大脑皮层形态学变化方面更具敏感性。目前的研究认为,慢性偏头痛患者的皮质厚度变化结论不一致。在双侧中央前回、额中回、岛叶和顶叶等区域出现皮质厚度减少[11],可能反映了与疼痛处理及认知-情绪调控相关脑区的结构损伤。相反,中央后沟和正中额沟等区域观察到皮质增加[12],可能代表一种代偿性的神经可塑性改变。总体而言,慢性偏头痛涉及复杂且区域特异的皮质重构过程。
表2 慢性偏头痛SBM分析部分脑区结果汇总
fMRI是一种利用血氧水平依赖信号(BOLD)间接反映神经活动的成像方法。当某一脑区神经元活动增强时,局部脑血流量和血氧供应会增加,使得脱氧血红蛋白浓度相对下降,从而改变该区域的磁共振信号强度。基于上述原理,fMRI可以绘制大脑在静息或任务状态下的功能活动变化。
在疼痛慢性化过程中,部分脑区发挥重要作用,基于种子点的分析方法可以为探究感兴趣区(ROI)在慢性化中的作用提供可能途径。目前多项研究认为,下丘脑在偏头痛病理生理学机制中发挥重要作用[13-14]。以下丘脑为ROI进行全脑功能连接变化分析发现,该区域与三叉神经脊髓核之间的连接增加,以及与一些属于显著性网络的脑区(如脑岛、尾状核、背外侧前额叶皮层、前扣带皮层和丘脑等)的连接增加[15-17]。此外,尾状核也在慢性化过程中发挥重要作用[18]。既往的研究发现,慢性偏头痛患者尾状核与多个脑区功能连接值增加,这些脑区多与感觉、认知及情绪相关,可能提示尾状核通过影响疼痛的情绪及认知过程参与疼痛调节[19]。
脑网络是由空间分布不同、但具有协同作用的脑区组成,在脑网络水平进行探究不再是孤立地对某个脑区进行分析。慢性偏头痛患者在大尺度脑网络中存在异常变化。既往一项纳入女性慢性偏头痛患者的研究表明,内在脑网络之间[即默认模式网络(DMN)、中央执行网络(CEN)、显著性网络(SN)]功能连接降低,且与头痛频率相关[20]。此外,基于独立成分分析的fMRI研究发现,与健康对照组相比,慢性偏头痛患者DMN和CEN之间以及CEN和腹侧注意网络(DAS)之间的功能连接均减弱,而DMN和DAS之间的功能连接增强[21]。这些结果提示,慢性偏头痛涉及多网络间的协调异常,这可能是其慢性化和复杂症状的重要神经机制。
DTI主要用于探究脑白质(WM)微观结构的变化。通过评估水分子沿白质纤维束三个主要正交方向的扩散特性,揭示组织微结构的完整性与方向性。常用的指标主要包括各向异性分数(FA)、平均扩散率(MD)、径向扩散率(RD)和轴向扩散率(AD)。既往的一项研究发现,与发作性偏头痛患者相比,慢性偏头痛患者白质纤维的AD显著降低(上、中、下小脑脚、左侧外囊和脑桥交叉束)[22],可能反映轴向纤维完整性受损或复杂纤维架构改变所致的轴向扩散受限,支持头痛慢性化伴随小脑调控、感觉预测与认知-情绪调节网络的功能失衡。此外,在探究MOH患者WM变化的前瞻性研究中发现,停药前后患者组及健康对照组均未发现显著性变化[23]。由于当前研究所纳入样本量较少及选择偏倚等,其结果存在异质性,因此未来仍需要通过新技术进一步探究慢性化过程中白质微观结构的变化特点。
sMRI、fMRI及DTI等多模态磁共振技术的应用显著推动了慢性偏头痛病理机制的研究。目前的研究表明,偏头痛慢性化不仅是单一痛觉通路的异常,更涉及感觉、情绪、认知网络的功能与结构重塑。
然而,现有研究仍存在样本量小、研究设计异质性高、缺乏纵向随访及多模态整合分析等局限。未来应加强基于大样本的多模态影像学整合及机器学习建模,来探索可复现的影像生物标志物,为临床诊断、预防与精准干预提供可靠依据。

Take Home Message
1. 多模态磁共振成像技术广泛应用于慢性偏头痛病理生理机制的研究中,为临床诊断与干预提供潜在的影像学标志物。
2. 慢性偏头痛机制涉及疼痛调节、情绪、认知和感觉相关的多个脑区结构和功能的改变。
3. 未来研究方向在于基于大样本、融合多模态成像技术、通过机器学习构建诊断及预测模型,探究可复现的影像学标志物。
专家简介

01 (单选题)以下哪一项不是弥散张量成像的常用指标?
A. 各向异性分数(FA)
B. 平均扩散率(MD)
C. 血氧水平依赖信号(BOLD)
D. 径向扩散率(RD)
02 (多选题)下列哪些方法属于功能磁共振分析方法?
A. 基于种子点的分析
B. 独立成分分析
C. 基于体素的形态学分析
D. 基于表面的形态学分析
(评论区留言一起讨论一下吧~)
Day9 答案明日揭晓
点击图片查看更多精彩内容
最终解释权归中国医学论坛报社所有,转载须授权
查看更多