查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:南京大学神经病学研究所 刘锐
脑高灌注综合征(cerebral hyperperfusion syndrome,CHS)出现的病理生理学机制十分复杂。
脑血管自动调节功能是指脑血管可以随着动脉血压的变化,自动调节微动脉和毛细血管前括约肌的舒缩来改变脑组织血流阻力,最终维持脑血流量(cerebral blood flow,CBF)的稳定。调节的因素除了动脉血压,还有局部组织的内环境,如CO、pH等都起着重要调节作用。当主要供血动脉严重狭窄时相应供血区脑灌注压明显下降,其微动脉和毛细血管括约肌持续扩张以增加CBF;长时间的血管扩张造成血管平滑肌收缩功能障碍、血管重构,使血管自动调节功能严重受损,受损的程度与缺血持续时间和严重程度成正比。
CHS的患者CBF通常在术后3~4 d达到最大,7 d之后能形成稳定的状态,而自动调节功能的恢复却需要6周甚至更长。在脑血管自动调节功能缺失的情况下血管维持最小阻力状态,CBF受全身血压波动影响巨大。颈动脉的严重狭窄被解除之后CBF急剧增加,进而导致脑水肿、甚至脑出血。
Spetzler等基于脑血管自动调节功能受损提出了正常灌注压突破理论,颈动脉重度狭窄引起持久性脑组织低灌注,导致局部缺血,使CO、NO等血管舒张物质长期蓄积而导致内皮功能障碍、血管结构破坏、毛细血管脆性增加、血脑屏障相对脆弱,并且损伤的程度与同侧供血动脉狭窄程度及侧支循环失代偿的程度呈正比,脆弱的血脑屏障在再灌注期间更容易被突破,这可以解释为什么有些患者没有严重高血压病或HP却发生血管源性脑水肿。
高血压病在CHS的起病和进展中都起着重要的作用。虽然没有证据表明高血压病会诱发出血,但几乎所有CHS患者术后都出现高血压病,74%的患者在颈动脉内膜切除术(CEA)CEA后24 h内出现血压不稳,19%~35%患者的CEA后出现恶性高血压(收缩压>200 mmHg或舒张压>100 mmHg)。由于自动调节功能受损,CEA术后CBF急剧增加,高血压又使之进一步恶化,最终导致CHS的发生。术前高血压是术后高血压最重要的危险因素。对于术前高血压的患者我们要高度警惕术后出现CHS。
CEA术中可能会损伤颈动脉窦部,由于受体去神经化,导致压力感受器功能受损,从而影响血压调控功能。当因颈动脉窦受损导致血压降低而应用升压药维持血压时,由于个体敏感性差异,血压监测不严密的情况下患者血压随时可能反弹性恶性升高,不能及时控制而导致CHS。特别是连续行双侧颈动脉内膜切除术可出现压力反射衰竭综合征,导致术后渐进性难治性的高血压。颈动脉狭窄解除后CBF的急剧增加会引起脑水肿、颅内压增高,这又刺激中枢和周围神经去甲肾上腺素的释放,使收缩压进一步升高,形成恶性循环,最终引起CHS。
术中缺血以及术后再灌注过程中伴随着氧化剂生成、补体激活和微血管通透性增加也可以导致血脑屏障受损,加剧了术后脑组织损伤。有研究表明,围手术期脑缺血的指标如颅内血氧饱和度降低、S-100B蛋白升高、中心体感诱发电位缺乏是术后CHS和神经功能障碍的独立危险因素。CEA后再灌注产生的氧自由基可能介导了这种效应,应用自由基清除剂可能有助于预防再灌注损伤的发生。
目前为止已报道的发病高危因素汇总如下:高血压病、重度狭窄伴侧支循环差、脑循环阻力下降、峰值流速增加、对侧颈动脉闭塞、3个月内对侧行CEA、术中颈动脉远端血压<40 mmHg、术中脑缺血。其他可能的危险因素有年龄>72岁、脑卒中史、Willis环不完整、血管反应性和储备下降、大剂量应用含挥发性卤化氢类的麻醉药、抗凝药、抗血小板聚集药等等。临床上遇到上述情况需高度警惕CHS的发生。
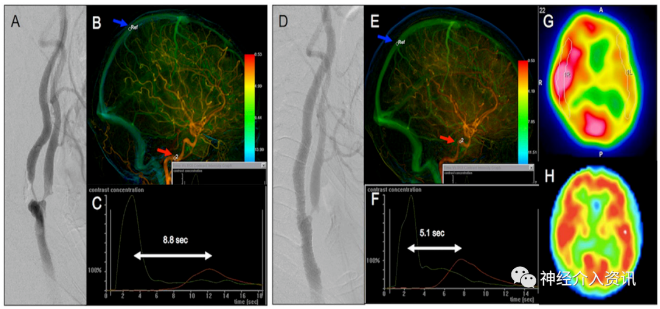
TCD可以测量大脑中动脉(MCA)的脑血流速度,并能对术前低灌注、脑血管反应性、术后高灌注、脑血管栓塞等提供有效的检测,在两项研究中,术中颈动脉远端低血压(<40 mmHg)、TCD检测发现颈动脉开放之后峰值血流速度增加、搏动指数>100%都可以有效地预测术后HP,HP患者颅内出血的风险比正常患者高10倍,对于临床上有条件的医院我们建议对行CEA的患者在围手术期常规行TCD监测。发现高危患者应进行更加严密的监护,及时行必要的处理,使其预后得到改善。
脑血管对CO或乙酰唑胺的反应性可以用来评估脑血流动力学储备功能。正常人服用乙酰唑胺(碳酸酐酶抑制剂可使局部CO水平升高)会导致CBF迅速增加20%~80%。通常采用单光子发射计算机断层扫描(SPECT)、磁共振或TCD来检测。慢性脑缺血患者脑血管已经最大限度地扩张,应用乙酰唑胺后CBF不会明显增加、脑血管阻力也不会明显下降。术前脑血管阻力(CVR)越低的患者术后CHS的风险就越高。
临床上有时也采用MRI/CT来评价出现CHS的风险,如果术前存在血管畸形等病变则术后发生CHS的概率会明显增加。术后发生CHS时MRI/CT可见脑水肿、局灶性脑梗死或颅内出血等。不过这些异常与CHS症状并不绝对相关,有些CHS患者MRI/CT检查发现并没有明显异常。总体来说,MRI/CT对CHS预测及诊断的价值不大,但可用于CHS脑组织损伤的检查。
来源:第67病区
查看更多