查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





胃癌在全球不同地区的治疗模式并未统一,放疗在局部进展期胃癌D2根治术后的应用价值,一直存在争议。ARTIST-2研究的期中分析结果于2019年ASCO公布,使这一话题再度引起胃癌学者的关注。
局部进展期胃癌术后放化疗研究现状
首项大型Ⅲ期随机对照研究——INT-0116
本世纪初,美国的INT-0116研究是胃癌术后放化疗领域第一项大型的Ⅲ期随机对照研究。与单纯手术相比,以氟尿嘧啶为基础的辅助化疗联合放疗可以提高胃癌根治术后患者的生存率,确立了放疗在胃癌术后辅助治疗中的地位。
然而,INT-0116研究只有10%的患者接受了D2根治术,且对照组为单纯手术。但在东亚,D2根治术是局部进展期胃癌的标准术式,且术后标准治疗方案为辅助化疗。因此,放疗在D2根治术后的应用价值备受质疑。为此,韩国学者进行了ARTIST研究,旨在探索D2根治术后在卡培他滨/顺铂辅助化疗的基础上加用放疗是否能够带来进一步获益。该研究的最终结果显示,加入放疗后,总体并未提高患者的5年生存率(XP组对比XPRT组:73% 对75%),但亚组分析显示,淋巴结阳性和肠型患者或可从放疗中获益。
2019 ASCO胃癌领域重磅研究——ARTIST-2
基于前述背景,结合目前尚缺乏S-1单药、SOX方案、SOX方案联合放疗对比的直接证据,韩国的学者于2013年启动了ARTIST-2研究。
该研究采用优效性设计,拟入组900例D2根治术后、病理分期为Ⅱ-Ⅲ期、淋巴结阳性的胃癌患者,1:1:1随机分配至接受辅助S-1单药组(40~60 mg,每天2次,用药4周,停药2周,治疗1年)、SOX化疗组(S-1用药2周,停药1周,联合奥沙利铂130 mg/m2,治疗6个月)或SOXRT组(SOX化疗联合放疗DT45 Gy/25 Fx)。主要研究终点为3年无病生存期(DFS),次要研究终点包括总生存(OS)、安全性等,分层因素包括分期、手术方式、Lauren分型。
截止2018年1月17日,共有538例患者纳入本次期中分析。患者的中位年龄为58岁,男性占65%,Ⅱ和Ⅲ期患者分别为31%和69%。各个治疗组基线特征均衡。不良事件发生率与预期一致,总体耐受性良好。S-1单药组的DFS显著劣于SOX组和SOXRT组,分别为: S-1对SOX, HR=0.617(P=0.016)和S-1对SOXRT,HR=0.686(P=0.057)。S-1单药组、SOX组和SOXRT组的3年DFS率分别为65%、78%和73%。SOX组和SOXRT组的DFS无显著差异(HR=0.910,P=0.667)。
ARTIST-2期中分析结论认为,对于D2根治术后Ⅱ-Ⅲ期且淋巴结阳性的患者,SOX组与SOXRT组较S1单药组可显著延长DFS,三组的治疗方案均具有良好的耐受性。然而,加入放疗并未带来进一步获益。虽然该研究尚未达到中止研究的界值,但IDMC认为期中分析结果已足够达到研究终点并建议中止研究,远期的随访数据和次要研究终点将在后期报道。
ARTIST-2之后,胃癌术后放化疗何去何从?
ARTIST和ARTIST-2两项研究的结果,将放疗在胃癌D2根治术后的角色置于了一个尴尬境地。目前尚无证据支持D2/R0术后辅助化疗的基础上加用放疗。但是,现在全面否定D2根治术后放疗尚无作用是否为时尚早?放疗作为一种局部治疗手段,其在术后应用的价值与D2根治术的完成度成反比。
从局部控制的角度看,放疗是有效的。2015年韩国的Yu等分析了ARTIST研究入组患者的复发模式,发现XPRT组的局部区域(locoregional)复发率要显著低于XP组(P=0.03)。其中,两组间局部(local)复发率并无差异,这一差异主要来自区域(regional)复发率(P<0.001)。无论全组(P=0.03),亦或在淋巴结阳性的患者中(P=0.009),XPRT组的局部区域无复发生存率(LRRFS)均显著优于XP组。因此,D2根治术后辅助放疗可显著降低局部区域的复发。
既然放疗的局控作用是肯定的,那么为何D2根治术后的临床研究却相继败北?究其原因,首先可能与胃癌的腹膜转移率高有关,且一旦出现腹膜转移,患者的预后不良。高腹膜转移率使局控获益无法转换为生存获益。其次,虽然人群选择的重要性不言而喻,但是至今仍没有有效的疗效预测临床病理因素或生物标志物。仅仅依据淋巴结阳性来选择获益人群是否仍不够精细,这一人群或许应进一步划分。后续我们有待ARTIST-2研究公布更多的随访数据,如不同组间的复发模式、局控率等,来获得更多依据。
胃癌治疗策略影响因素
中日韩胃癌人群差异不容忽视
现有的胃癌治疗策略主要根据日韩主导的临床研究制定,然而这些“他山之石”却未必完全适应中国国情。胃癌人群的不同和防治水平的差异,决定了我国不能一成不变的照搬日韩的治疗模式。首先,胃癌人群的不同,主要体现在病期分布。日韩由于全国性早筛的开展,其早期胃癌比例高达60%~70%。而我国的胃癌患者分期则呈现出“两头小,中间大”的特点,即Ⅰ期胃癌和Ⅳ期胃癌分别占19.5%和9.7%,Ⅱ-Ⅲ期胃癌占比则高达70.8%。局部进展期胃癌占比高是与日韩显著不同的人群特征。
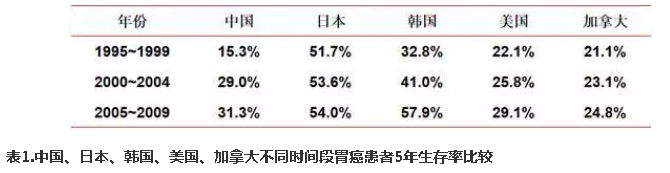
其次,根据一项1995-2009年癌症患者生存情况的全球性调查数据(CONCORD-2),在相同时间段内,我国胃癌患者的5年生存率与美国、加拿大等西方国家相似,远低于日本、韩国(表1)。其中原因,除了日韩早期胃癌比例明显高于其他国家以外,亦有治疗水平差距的因素。在我国,不同地区、不同级别医院之间D2根治术的手术质控差别亦不容忽视。复旦大学附属中山医院与天津医科大学肿瘤医院的相关研究表明,胃癌专科手术医生与非专科手术医生相比,其患者的术后生存率有显著提高。
治疗人群的选择,N3患者值得关注
通常认为,D2根治术后伴有局部区域复发高危因素的患者,如T4b,安全切缘不足,淋巴结转移较多(N3或LNR>25%),为术后放疗潜在获益人群,其术后放化疗的作用仍有待探索。对于这类患者,其病期较晚,局部复发与腹膜、远处转移的风险同时存在,其治疗策略应是局部与全身治疗的共同加强,或许可有进一步获益的空间。
对于同属N3的患者,N3a与N3b或许需要被区别对待。在第7版美国癌症联合委员会(AJCC)胃癌分期中,虽然N3已被进一步划分为N3a与N3b,但是在TNM总分期中并未体现这两者的预后差异;第8版AJCC胃癌分期则将N3a与N3b的意义区别对待。若干N3b相关的分期被划分到更晚的TNM的总分期,如pT1N3bM0由IIB期更改为IIIB期,pT2N3bM0由IIIa期更改为IIIb期,pT3N3bM0由IIIb期更改为IIIc期,但pT4aN3aM0则由IIIc期降至IIIb期(图1)。2019年IGCC一项韩国的研究提出将T4bN3a、N3b和CY1划分至IVa期,而肉眼可见的转移则划分为IVb期,并且将N3b定义为需要姑息性治疗的疾病。

韩国曾进行过一项针对III-IV期胃癌D2/R0术后辅助放化疗对比辅助化疗的III期研究,采用的治疗方案同INT-0116研究。两组的术后治疗完成率分别为93.2%和87.0%,该研究因入组缓慢而提前关闭。从2002年5月至2006年6月,共90例患者入组,ChT组44例, CRT组46例。ITT集分析显示CRT组的LRRFS有获益,但两组DFS无差异。亚组分析则提示CRT组Ⅲ期患者的LRRFS和DFS均有显著提高。该研究采用的是第6版AJCC的胃癌分期,若换算成第7版,则亚组分析显示的Ⅲ期获益人群大部分属于N3a。
本中心针对D2/R0术后N3胃癌进行了一项回顾性研究,术后化疗组与术后放化疗组分别纳入了365例和175例患者,通过基于倾向值的4种不同方法排除基线特征不均衡的影响后,放化疗组的LRRFS和DFS要显著优于化疗组进一步亚组分析显示N3a,而非N3b的患者可从放化疗中获益。
一项土耳其的小样本回顾性研究仅纳入了淋巴结转移≥16枚即N3b的患者,结果表明无论LRR或OS均无获益,但该研究化疗组与放化疗组的人数仅分别为53例与18例。武汉大学中南医学的一项回顾性研究,其亚组分析显示IIIc期患者,术后放化疗组的DFS与OS要显著优于术后化疗组。
2012年,韩国的Chang等分析了D2根治术后IIIc(N3)期患者的复发模式。在整个随访过程中,纳入分析的382例患者的区域复发率为27.5%,低于腹膜转移率(40.6%),但高于远处转移率(23.8%)和局部复发率(9.7%)。这一数据提示,对于D2根治术Ⅲc(N3)的患者,其区域复发率仍然较高,或许可从辅助放疗中获益。
进展期胃癌术前放化疗,期待中国好声音
胃癌术后放化疗的研究中治疗的完成率低被认为是导致研究阴性结果的重要原因之一,如CRITICS研究。相比之下,胃癌的术前治疗具有的优势有且不限于此。因此,目前在胃癌中放化疗有前移的趋势,术前放化疗成为当下的研究热点。
POET研究于2017年更新的长期随访结果显示,术前放化疗组的手术后局部无进展生存显著优于术前化疗组(P=0.01),并且术前放化疗组的3年和5年的OS亦显示出获益趋势(P=0.055)。
本中心于2012-2014年开展了一项局部进展期胃癌术前放化疗的Ⅱ期临床研究(NCT02024217)。该研究共入组40例分期为cT4aN+M0或cT4bNxM0的胃或胃食管结合部腺癌患者,其中36例完成了术前治疗,R0切除率为67%(24/36),pCR率为13.9%(5/36)。术前治疗的毒性反应在可接受范围内,且无放化疗相关的死亡病例。
目前国内有本中心的PREACT(NCT03013010)和中山大学附属肿瘤医院(NCT01815853)的两项Ⅲ期随机对照临床试验正在进行,有望对胃癌术前放化疗提供更为可靠的依据。
结语
局部进展期胃癌D2根治术后放化疗的疗效仍缺乏循证依据。基于现有的研究,N3患者或许是值得进一步探索的方向。胃癌的术前放化疗为当下的研究热点,局部进展期胃癌术前放化疗的近期疗效和安全性已获肯定,对于患者的远期疗效以及与单纯化疗相比孰优孰劣的问题,我们期待目前国内正在进行的两项Ⅲ期研究能够给出答案。
参考文献
[1] Macdonald J S, Smalley S R, Benedetti J, et al. Chemoradiotherapy after Surgery Compared with Surgery Alone for Adenocarcinoma of the Stomach or Gastroesophageal Junction[J]. N Engl J Med, 2001,345(10):725-730.
[2] Lee J, Lim D H, Kim S, et al. Phase III trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection: the ARTIST trial[J]. J Clin Oncol, 2012,30(3):268-273.
[3] Yu J I, Lim D H, Ahn Y C, et al. Effects of adjuvant radiotherapy on completely resected gastric cancer: A radiation oncologist's view of the ARTIST randomized phase III trial[J]. Radiotherapy and Oncology, 2015,117(1):171-177.
[4] 王胤奎, 李子禹, 陕飞, 等. 我国早期胃癌的诊治现状——来自中国胃肠肿瘤外科联盟数据的启示[J]. 中华胃肠外科杂志, 2018(2):168-174.
[5] Allemani C, Weir H K, Carreira H, et al. Global surveillance of cancer survival 1995-2009: analysis of individual data for 25,676,887 patients from 279 population-based registries in 67 countries (CONCORD-2)[J]. Lancet, 2015,385(9972):977-1010.
[6] Shen Z, Sun Y, Wang C, et al. Positive association of gastric cancer surgery outcome with surgeon specialization in a Shanghai high-volume general hospital.[J]. JOURNAL OF CLINICAL ONCOLOGY, 2012,30(suppl; abstr 4092).
[7] Liang Y, Wu L, Wang X, et al. The positive impact of surgeon specialization on survival for gastric cancer patients after surgery with curative intent[J]. Gastric Cancer, 2015,18(4):859-867.
[8] Kim T H, Park S R, Ryu K W, et al. Phase 3 trial of postoperative chemotherapy alone versus chemoradiation therapy in stage III-IV gastric cancer treated with R0 gastrectomy and D2 lymph node dissection[J]. Int J Radiat Oncol Biol Phys, 2012,84(5):e585-e592.
[9] Zhou M L, Yang W, Wang Y Q, et al. Adjuvant chemoradiotherapy versus adjuvant chemotherapy for patients with N3 gastric cancer after D2/R0 resection: a retrospective study based on propensity score analyses[J]. Cancer Manag Res, 2019,11:4855-4870.
[10] Kilic L, Ordu C, Ekenel M, et al. Comparison of two different adjuvant treatment modalities for pN3 gastric cancer patients after D2 lymph node dissection: can we avoid radiotherapy in a subgroup of patients?[J]. Med Oncol, 2013,30(3):660.
[11] Peng J, Wei Y, Zhou F, et al. D2-resected stage IIIc gastric cancer patients benefit from adjuvant chemoradiotherapy[J]. Cancer Med, 2016,5(10):2773-2780.
[12] Chang J S, Lim J S, Noh S H, et al. Patterns of regional recurrence after curative D2 resection for stage III (N3) gastric cancer: implications for postoperative radiotherapy[J]. Radiother Oncol, 2012,104(3):367-373.
[13] Stahl M, Walz M K, Riera-Knorrenschild J, et al. Preoperative chemotherapy versus chemoradiotherapy in locally advanced adenocarcinomas of the oesophagogastric junction (POET): Long-term results of a controlled randomised trial[J]. Eur J Cancer, 2017,81:183-190.
[14] Liu X, Li G, Long Z, et al. Phase II trial of preoperative chemoradiation plus perioperative SOX chemotherapy in patients with locally advanced gastric cancer[J]. J Surg Oncol, 2018,117(4):692-698.
作者 | 周梦龙 章真(复旦大学附属肿瘤医院 放疗科)
编辑 | 郝冉(中国医学论坛报)
查看更多