查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





亲爱的读者朋友们:
笃行致远,惟实励新,中国医学论坛报特邀北京大学肿瘤医院王维虎教授团队共同打造“放眼看前沿”专题栏目,与肿瘤领域医生分享放疗领域前沿进展。专栏内容于中国医学论坛报今日肿瘤微信公众平台、壹生APP实时更新,期待您的持续关注与传播!
一项非随机Ⅱ期SABR-5临床试验的主要毒副反应结果

立体定向消融放疗(SABR)是指在图像引导下给予肿瘤局部高剂量、少分次放射治疗且处方剂量分布与靶区高度适形的先进放疗技术,最初被用于早期肺癌的根治性治疗。近期,具有里程碑意义的Ⅱ期随机临床试验SABR-COMET显示,SABR治疗寡转移瘤与标准姑息治疗方式相比,能够显著提高生存,但毒副反应发生率较高(2级以上毒副反应发生率为28.8%;5级毒副反应发生率为4.5%)。本研究的目的是评估SABR治疗寡转移瘤的毒副反应和患者后续生活质量,主要研究终点为毒副反应发生率。
本研究为一项开放标签、基于人群的单臂Ⅱ期非随机临床试验。主要入组条件为患者存在≤5个转移灶(寡转移)或疾病处于寡进展状态。研究根据患者的转移瘤位置制定不同的SABR治疗方案,并详细规定了放疗的处方剂量、分割次数(表1)、危及器官(OAR)及其限量。计划设计优先考虑OAR限量,处方剂量的目标为至少95%计划靶区(PTV)接受100%处方剂量,但为了满足OAR的限量要求,可使处方剂量最低包括50%的靶区体积。
表1 该试验中SABR处方剂量及分割次数
主要研究终点:毒副反应、患者报告的生活质量,其中毒副反应分级依据美国国家癌症研究所不良事件常用术语标准(NCI-CTCAE)4.0版。可接受的SABR相关毒副反应预先设定为:5级毒副反应<5%,4级毒副反应<10%,3级毒副反应<25%。
次要研究终点:无进展生存(PFS)期、疾病进展时间(定义为从SABR治疗到任何部位疾病进展或死亡的时间)、总生存(OS)、疾病控制率、开始或恢复系统治疗的时间、后续化疗/系统性治疗的周期数。
2016年6月~2020年11月,共入组381例患者,中位随访时间25个月。最常见的原发肿瘤分别为前列腺癌(32%)、结直肠癌(17%)、乳腺癌(11%)和肺癌(9%)。
接受SABR治疗的最常见转移瘤部位依次为肺(34%)、非椎体骨(25%)、椎体(16%)、淋巴结(14%)、肝脏(5%)和肾上腺(3%)。
SABR相关的2、3、4、5级累计毒副反应发生率分别为14.2%、4.2%、0%、0.3%(表2)。
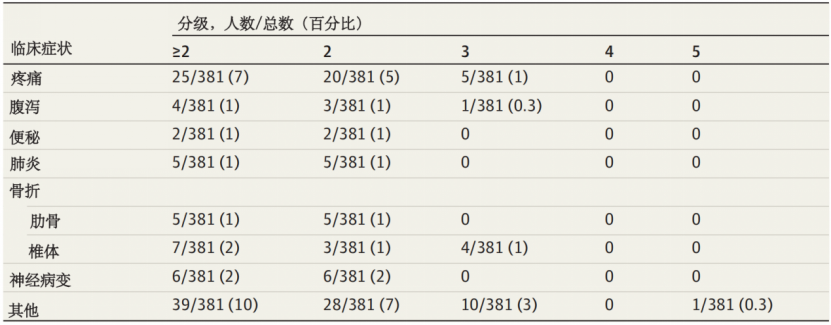
表2 患者发生SABR相关毒副反应及其分级
2级及以上毒副反应发生率为18.6%。其中肝脏和肾上腺转移瘤接受SABR后出现≥3级毒副反应的比例分别为10.3%、6.7%(表3)。

表3 SABR治疗不同部位转移瘤患者发生≥2级毒副反应比例
2级以上毒副反应在第2年、第4年的累计发生率分别为8%、23%,而≥3级毒副反应发生率分别为4%、6%,毒副反应累计发生率在早期呈现随时间增加的趋势,第3年后则趋于稳定(图1)。
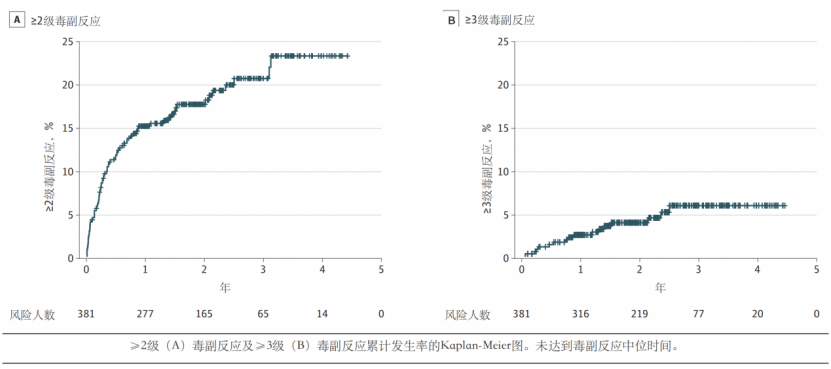
图1 ≥2级(A)与≥3级毒副反应(B)的累计发生率
本研究为相对大型、基于人群的Ⅱ期非随机临床试验,结果显示SABR相关的严重毒副反应发生率低于5%(3级至5级发生率,4.5%),表明SABR治疗寡转移瘤是相对安全的。
但本研究中出现1例5级毒副反应,提示SABR治疗仍存在潜在毒性风险,因此,需要谨慎开展该技术并继续积累高质量研究证据,尤其是对转移病灶位于腹部(如肝、肾上腺等)的患者。
本研究对比随机Ⅱ期临床试验SABR-COMET,样本量更大(381 对 99),≥2级毒副反应发生率更低(18.6% 对 29%)。
本研究毒副反应发生率低的原因主要有两点:一是在制定放疗计划时OAR限量优先于肿瘤靶区覆盖,二是对OAR和靶区勾画采取地方协作的严格同行审核,最终得以获得高质量、高安全性的放疗计划。
本研究结果表明,在严格同行审核、质量保证和优先考虑OAR限量的情况下,SABR治疗寡转移瘤是相对安全的,本研究结果支持后续开展Ⅲ期随机临床试验。
余荣 副主任医师
北京大学肿瘤医院放疗科 副主任医师
北京肿瘤防治研究会放疗分委会副主委
北京癌症防治学会食管癌专委会常委
北京抗癌协会食管癌专委会委员
北京医学奖励基金会肺癌医学青委会委员
专业方向:肺癌与食管癌的放疗与综合治疗
寡转移是一种介于局部病变和全身广泛转移的中间状态,在多数临床试验中定义为3~5个以内转移灶。既往几项Ⅱ期临床研究数据表明,对于寡转移瘤,在全身药物治疗的基础上,给予转移灶根治性的局部治疗能够延长患者长期生存时间,但目前仍然缺乏前瞻性Ⅲ期临床试验的数据支持。
在SABR-COMET研究中,99例寡转移患者被随机分配至SABR组(66例)或对照组(33例)。虽然无论是中位OS或PFS,SABR组均显著优于对照组(中位OS期,41个月对28个月,HR=0.57,95% CI 0.30-1.10,P=0.090;中位PFS期,12个月对6个月,HR=0.47,95% CI 0.30-0.76,P=0.0012),但该研究2级以上治疗相关毒副反应发生率为29%,且5级治疗相关毒性发生率为4.5%(3/66例)[1]。
SABR-5研究由参与SABR-COMET研究的加拿大6家肿瘤中心发起,作为SABR-COMET研究和后续Ⅲ期研究之间的过渡,旨在以安全、合理、规范、统一的形式进一步推广SABR在寡转移瘤中的应用。主要研究终点为毒副反应和生活质量。该研究2级以上毒副反应发生率为18.6%,以2~3级为主,5级毒副反应发生率0.3%(1/381例),明显低于试验预设的范围。肝脏和肾上腺转移瘤接受SABR治疗后,3级以上毒副反应的发生率更高。
在时间趋势方面,毒副反应主要发生在前3年,此后趋于稳定,但仍有可能长期持续存在。该研究同时在《国际放射肿瘤学、生物学、物理学杂志》报告了PFS和局部控制率结果[2]。
中位PFS期为15个月(95% CI 12-18);
1年和3年PFS率分别为56%(95% CI 50-62)和31%(95% CI 25-37);
中位OS期尚未达到;
3年OS率为71%(95% CI 65-77);
1年和3年局部控制率分别为93%(95% CI 91-95)和87%(95% CI 84-90)。

该研究前瞻性收集毒副反应,建立评审委员会复核毒副反应是否与治疗相关,因此进一步提高了研究数据的真实性和可靠性。与SABR-COMET研究相比,2级以上和5级毒副反应发生率更低。
约19%入组患者为寡进展状态,即全身治疗后少数病灶进展而其他病灶稳定的状态,寡进展的患者被认为预后相对更差,但该研究中位PFS期数值上并不劣于SABR-COMET研究(15个月对12个月)。
该研究在优先保证正常组织的前提下,允许适当降低靶区剂量,亚组分析结果显示,降低靶区剂量并未增加寡转移瘤局部复发。以上研究结果再次证实SABR可作为安全有效的手段应用于寡转移瘤的治疗。
临床前研究提示,SABR能诱导肿瘤新抗原释放,上调MHC分子表达,促进抗原提呈,增加肿瘤浸润淋巴细胞数量。SABR联合免疫治疗在晚期肿瘤可提高PFS期和OS期,且并未显著增加毒副反应。尤其是对于程序性死亡配体-1(PD-L1)阴性或低表达的患者,SABR联合免疫治疗也显示出生存获益[3, 4]。对于SABR与免疫治疗的联合,仍需要更多前瞻性研究的证实。
总之,SABR可作为一种安全有效的手段而被应用于寡转移瘤的局部治疗。但对于不同原发肿瘤及转移部位的最佳分割模式、最多可接受SABR治疗的寡转移病灶数目以及最佳的全身治疗方案,目前尚未明确。SABR-COMET-10和SABR-COMET-3研究正在进行中,期待后续结果能为SABR在寡转移瘤的治疗提供更多依据。
参考文献

王维虎 教授
博士、博士后导师
北京大学肿瘤医院 放疗科主任
中国医师协会放射肿瘤治疗医师分会 常任委员
中国医师协会放射肿瘤治疗医师分会肝癌放疗学组 组长
中华医学会放射肿瘤治疗学分会 全国委员
中华医学会放射肿瘤治疗学分会肝癌放疗学组 副组长
北京医学会放射肿瘤治疗学分会 副主任委员
北京医师协会放射治疗专科医师(技师)分会 副会长
北京抗癌协会肿瘤放疗专业委员会 副主任委员
北京癌症防治学会消化道肿瘤放疗专业委员会 主任委员
获中华医学科技二等奖和北京市科学技术三等奖
《中国原发性肝细胞癌放射治疗指南》主编
《消化系统肿瘤放疗规范和靶区定义》主编
《头颈部肿瘤放疗规范和靶区定义》主编
《胸部肿瘤放疗规范和靶区定义》主编
《放射治疗常规》主编
团队介绍

北京大学肿瘤医院放射治疗科多年来一直致力于肿瘤的规范化诊治,个体化放疗及多学科综合治疗等。科室以“团结创新,至仁至精”为科训,通过具体项目带领全科进步,借助规范提升临床和科研水平,并努力实现肿瘤领域引领和示范作用。团队年收治新患者约5000例,正在进行的临床试验50余项,在研各类课题24项,在《美国医学会杂志·外科学》(JAMA Surgery)、《柳叶刀·肿瘤学》(Lancet Oncol)、《肝病学》(Hepatology)、《国际放射汇肿瘤学·生物学·物理学杂志》(IJROBP)、《放射治疗学及肿瘤学》(Radiother Oncol)等期刊上发表科学论文多篇,并主编了《恶性肿瘤放疗规范和靶区定义》系列丛书。
文章解读:北京大学肿瘤医院 杜喆
内容审核:北京大学肿瘤医院 邓玮
排版编辑:中国医学论坛报 李浩
查看更多