查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





糖尿病肾病(DN)是全世界范围内导致慢性肾功能不全的最常见病因,而肾小管损伤是DN发生发展的关键环节。虽然近年来DN的临床治疗药物取得了长足发展,但是目前仍缺乏靶向性的分子干预手段,导致患者长期预后不良。
肾小管损伤是DN发生发展关键环节。既往研究表明,内质网应激是导致高糖介导肾小管细胞损伤的重要驱动因素。DN患者的肾小管细胞存在蛋白超负荷,大量蛋白质和脂质被肾小管细胞重吸收,导致其对各种功能蛋白和膜成分需求增加;此外,高糖还可以导致肾小管细胞中蛋白质非酶糖基化和大量产生活性氧,使得肾小管上皮细胞内质网需要合成更多蛋白质以维持细胞功能。在这些压力刺激综合作用下,肾小管细胞的内质网蛋白质合成能力受损,引发以错误折叠或未折叠蛋白质积累为特征的内质网应激(ER应激)的过度激活,启动细胞凋亡程序,诱导细胞死亡。
虽然目前研究初步证明了内质网应激参与了高糖情况下的肾小管细胞损伤,但其关键调控机制尚未完全阐明;此外,靶向内质网应激是否可以作为DN治疗的新策略也需要进一步验证。
2025 年8月25日,东部战区总医院,国家慢性肾病临床医学研究中心刘志红院士团队在肾脏病领域国际期刊《Kidney International》在线发表了题为Protein UHRF1-mediated dual dysregulation of molecular chaperone GRP78 induces endoplasmic reticulum stress and aggravates diabetic nephropathy的研究论文。

该研究首次发现,高糖可导致肾小管细胞内UHRF1蛋白表达下调,进而破坏其对内质网未折叠蛋白反应中关键分子伴侣—GRP78启动子甲基化及蛋白泛素化的双重表观调控作用,引起GRP78蛋白在肾小管细胞内异常蓄积。机制研究证实,胞质内异常蓄积的GRP78可以通过核孔蛋白复合体介导的细胞核易位,发挥转录调控功能,主动激活内质网应激与细胞凋亡相关基因网络,加剧高糖诱导的细胞损伤。在阐明内质网应激调控新机制的基础上,研究团队结合分子对接与深度学习技术,筛选并验证了可特异性阻断GRP78入核,从而缓解内质网应激反应,减轻DN肾小管损伤的干预新药物。该研究首次系统揭示了GRP78表达受到双重表观遗传调控及其参与细胞内质网应激调控的分子机制;在阐明DN肾小管细胞损伤新机制的基础上,构建和验证了靶向内质网应激的DN治疗新策略。
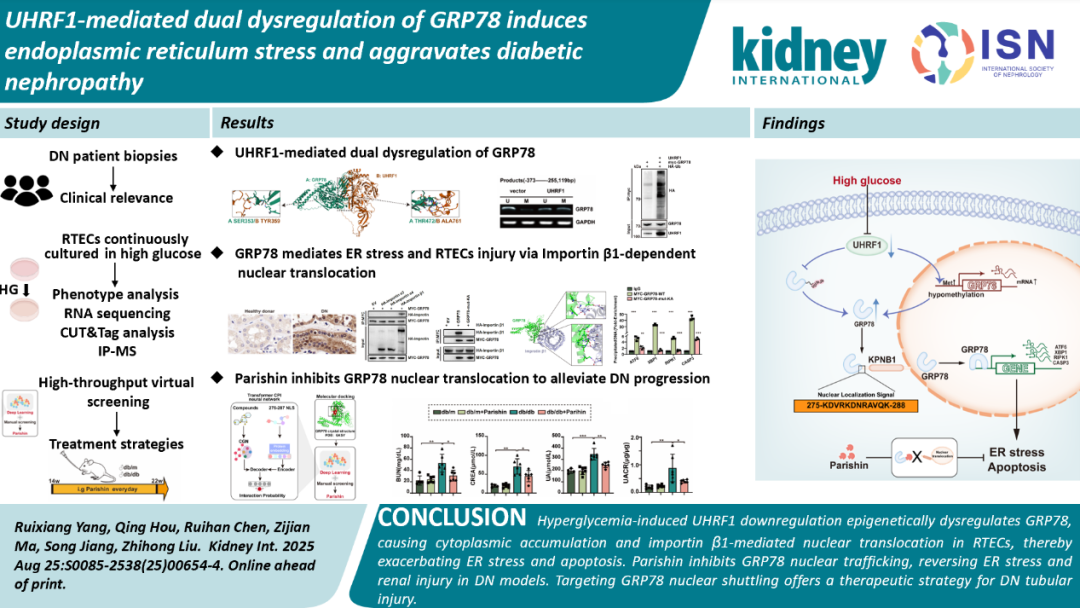
图1 研究模式图
首次发现UHRF1对GRP78的双重表观调控机制
研究团队利用长期高糖刺激HK-2细胞,通过RNA测序验证了持续代谢压力刺激情况下,肾小管细胞内的内质网应激相关通路发生显著激活,其中GRP78是表达变化最为显著的分子。GRP78在DN患者肾小管上皮细胞中富集表达,且与正常对照相比,其蛋白和mRNA表达均显著上调。体外研究证实,HK-2细胞中过表达GRP78,可以诱导内质网应激通路激活。
研究团队进一步发现,DN患者肾小管细胞内UHRF1表达与GRP78表达呈显著负相关,且体外过表达UHRF1可以显著降低GRP78的mRNA和蛋白表达水平。机制研究发现,正常生理情况下,UHRF1一方面可以通过其Hemi-mCpG和H3K9me2/3结合活性介导的GRP78基因启动子甲基化发挥转录抑制的作用,维持GRP78 mRNA表达稳定;另一方面,UHRF1蛋白可以和GRP78蛋白SBD结构域直接结合,并作为E3泛素连接酶,介导GRP78 K48连接的多聚泛素化,从而维持GRP78蛋白表达稳定。高糖情况下,肾小管细胞内UHRF1下调,破坏了其对GRP78启动子甲基化及蛋白泛素化的双重表观调控功能,导致了GRP78在细胞内的表达增加和异常蓄积。
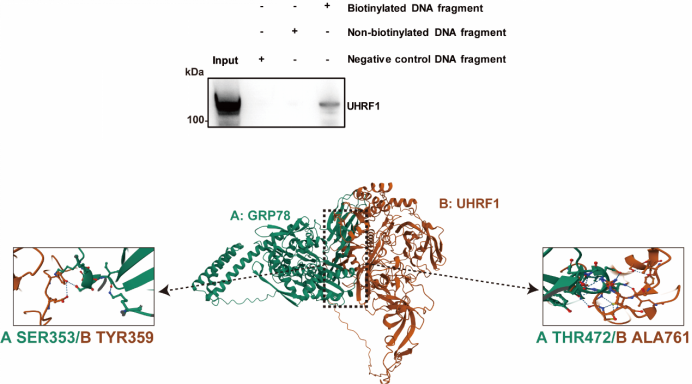
图2 UHRF1与GRP78启动子和蛋白相互作用
揭示GRP78核易位调控内质网应激参与DN肾小管损伤新机制
既往研究认为GRP78是细胞内质网应激激活的关键标志物,但缺乏对GRP78主动参与内质网应激的调控机制的认识。研究团队通过DN患者肾组织免疫组化染色和体外细胞实验,首次发现高糖不仅可以诱导GRP78在细胞质中高表达,且可进一步导致GRP78入核发生核易位。
蛋白结构解析发现,GRP78存在不同物种间高度保守的赖氨酸富集区(氨基酸276-287)所构成的核定位信号(NLS),NLS突变的GRP78会丧失核易位功能。通过核提取物免疫共沉淀结合质谱技术和分子对接模拟,研究团队解析了GPR78的NLS肽段(276-287残基)可以与细胞核转运蛋白Importin β1(KPNB1)的结合口袋形成特异性互作,从而驱动其核易位的发生;并证明了GRP78核易位是其在细胞质内过表达所触发的主动过程,而非核转运系统功能障碍或内质网滞留信号受损所致。
为了揭示GRP78核易位后的作用,研究团队采用CUT&Tag技术绘制了HK-2细胞中GRP78-DNA互作全景图谱,证明了核易位后的GRP78主要结合到内质网蛋白加工(如ATF6、XBP1、RIPK1)和凋亡通路(如CASP3)的关键调控基因启动子区域,并显著增加上述关键基因表达水平,从而加重内质网应激。研究结果证明了GRP78可以通过核易位,直接结合靶基因启动子区域,从而发挥调控内质网应激介导细胞凋亡的级联反应,阐明了DN肾小管细胞损伤的新机制。
图3 CUT&Tag技术绘制HK-2细胞中GRP78-DNA互作全景图谱
构建靶向内质网应激的糖尿病肾病干预新策略
在阐明GRP78核易位加重高糖情况下内质网应激参与DN肾小管损伤机制的基础上,研究团队构建了靶向内质网应激的干预新策略。研究团队通过蛋白结构导向分子对接与序列深度学习相结合的筛选策略,从210万种化合物库中,高通量筛选了可以特异性靶向GRP78入核序列(NLS)的小分子药物,并进一步验证了通过阻断GRP78入核调控内质网应激治疗DN这一新策略的有效性。
研究团队虚拟筛选出酚苷类小分子Parishin可以靶向结合到GRP78 NLS区域。体外细胞实验发现,Parishin处理可以显著抑制高糖诱导的GRP78入核,但是并不改变GRP78在细胞质内的表达水平。研究显示,Parishin通过特异性阻断GRP78与核转运蛋白Importin β1的相互作用,从而抑制其核易位。体内外研究证实,Parishin治疗可以在不改变db/db小鼠体重和血糖的情况下,有效缓解db/db小鼠肾小管间质的内质网应激,并且抑制细胞凋亡信号通路,改善db/db小鼠模型的肾小管损伤和间质纤维化。研究结果证明了靶向GRP78核易位的内质网应激干预新策略有望作为DN治疗新手段。
研究意义
1
解析代谢因素介导内质网应激的表观调控新机制
高糖等代谢压力是驱动内质网应激的关键因素。本研究首次揭示了高糖介导的UHRF1变化调控内质网应激关键分子伴侣—GRP78的DNA甲基化与蛋白泛素化修饰的分子机制。该发现不仅为理解DN中内质网应激的分子调控机制提供了新视角,也为解析表观调控机制参与DN发生发展提供了理论依据。
2
阐明GRP78调控内质网应激的关键机制
本研究首次系统揭示了GRP78通过其核定位信号(NLS)与核孔复合物结合并发生核易位的具体机制,并阐明了该过程在调控内质网应激和促进细胞凋亡中的关键作用。这一发现证实了GRP78可以通过主动入核过程,调控内质网应激关键效应基因的表达,直接参与和放大内质网应激过程,这不仅为DN的治疗提供了干预新靶点,也为未来防治其他内质网应激所参与的疾病,如神经退行性疾病、代谢综合征等提供了新路径。
3
靶向GRP78核易位为DN治疗提供新策略
与传统GRP78抑制剂,如HA15抑制GRP78的ATP酶活性进而阻断其分子伴侣功能,导致错误折叠蛋白积聚,加剧内质网应激并诱导细胞凋亡的作用机制不同,本研究基于对GRP78核易位反馈激活内质网应激机制的深入解析,筛选出靶向GRP78核定位信号(NLS)的小分子干预药物。该药物可以在不干扰GRP78生理性分子伴侣功能的同时,精准抑制GRP78的核易位,从而有效缓解内质网应激和肾小管细胞损伤,为DM治疗提供了一种兼具靶向性与安全性的治疗新策略。
综上所述,本研究不仅揭示了高糖介导肾小管细胞中GRP78表达稳态失衡的双重表观遗传调控机制,还系统阐释了GRP78通过核易位主动调控内质网应激并介导DN肾小管损伤的关键分子通路;基于上述机制,构建和验证了靶向内质网应激的DN干预新策略,展现出了良好的临床转化潜力与应用价值。
东部战区总医院国家慢性肾病临床医学研究中心刘志红院士、蒋松主任医师为论文的共同通讯作者,博士后杨瑞祥为论文的第一作者。
来源:东部战区总医院订阅号
查看更多