查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





2021年6月15日,美国默沙东公司宣布,其PD-1抑制剂帕博利珠单抗(商品名:可瑞达®,国内俗称K药)已获得中国国家药品监督管理局(NMPA)批准,单药用于KRAS、NRAS和BRAF基因均为野生型、不可切除或转移性的高度微卫星不稳定性(MSI-H)/错配修复基因缺陷型(dMMR)结直肠癌(CRC)患者的一线治疗。该新适应证的获批是基于一项全球关键III期临床试验KEYNOTE-177的数据分析结果。
同样基于KEYNOTE-177研究结果,K药此前已于2020年6月和2021年1月分别在美国和欧盟获批单药用于一线治疗MSI-H/dMMR不可切除/转移性CRC。
CRC具有很强的异质性,其中约15%的CRC患者可表现为免疫治疗应答较好的MSI-H/dMMR,但是在晚期CRC患者中,MSI-H/dMMR所占比例仅约5%。早在2015年,美国《新英格兰医学杂志》刊登了一项K药单药用于经标准治疗无效的转移性CRC II期临床研究,其结果显示[1],K药单药治疗dMMR患者的中位无进展生存期(PFS)和总生存期(OS)未达到,而治疗错配修复功能正常(pMMR)患者的中位PFS为2.2个月(95% CI, 1.4-2.8), 中位OS为5.0个月(95% CI, 3.0-未达到),提示K药单药治疗dMMR转移性CRC患者的疗效显著优于pMMR的患者(图1)。
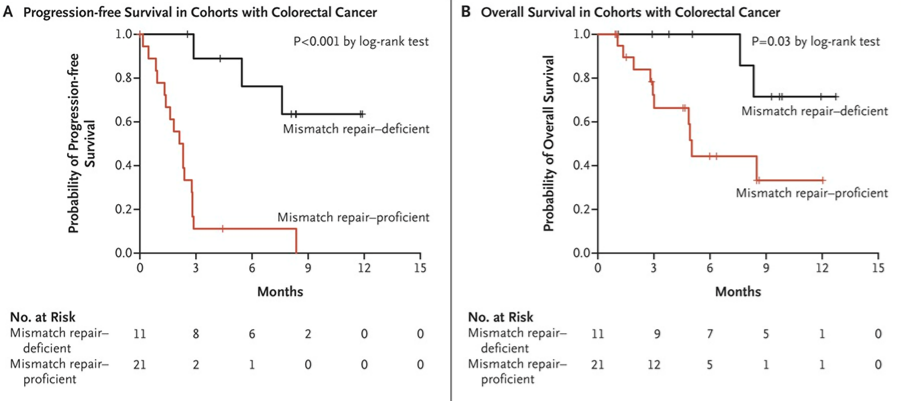
图1:K药治疗dMMR和pMMR CRC的PFS(A)和OS(B)[1]
此研究确立了dMMR作为PD-1免疫检查点抑制剂治疗疗效的预测生物标志物。
2017年5月24日,美国食品和药物管理局(FDA)批准K药单药治疗MSI-H/dMMR的实体瘤患者,覆盖结直肠癌、小细胞肺癌、宫颈癌等15种不同的恶性肿瘤。这种不依照肿瘤来源,而是依照生物标志物进行区分的抗肿瘤疗法,是精准医学的一个“里程碑”,且在目前所有国内临床可及的PD-(L)1单抗中,仅有K药得此“殊荣”。
2020年6月16日,美国FDA加速批准K药单药治疗肿瘤突变负荷高(TMB-H,定义为TMB≥10 突变/兆碱基)且既往治疗后疾病进展的无法切除或转移性实体瘤患者,代表精准医学的又一个里程碑,K药也因此成为PD-1精准治疗的领跑者。
刚刚结束的2021美国临床肿瘤学会(ASCO)大会公布了KEYNOTE-177的最终OS数据,结果显示[2],在中位随访超过44个月时 [K药治疗组44.5(36.0-60.3)个月, 对照组44.4(36.2-58.6)个月],K药治疗组的中位OS尚未达到,对照组中位OS为36.7个月,死亡风险降低26% (HR=0.74; 95%CI 0.53-1.03; P=0.0359) (图2)。在有60%的对照组患者出现疾病进展后接受PD-1/PD-L1免疫检查点抑制剂治疗的干扰情况下,K药治疗组仍显示了长期的OS获益趋势,在36个月时,K药组有61%的患者仍然存活,相比对照组(50%)提升了11%。
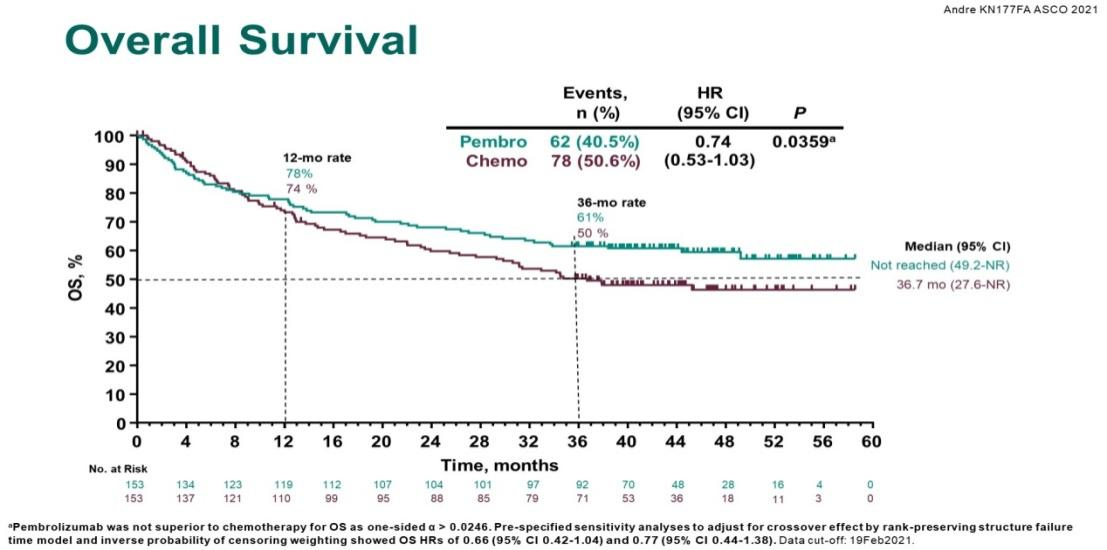
图2:KEYNOTE-177 最终OS分析结果[2]
相比出现远处转移的晚期CRC患者不足20%的5年生存率,61%的3年生存率是一个令人惊艳的数字,但这并非K药首次显示出免疫单药一线治疗的精准性。
在2020 ASCO大会上,一项K药单药一线治疗晚期恶性黑色素瘤的研究结果显示,中位随访66.8个月,5年OS率达到43%[3]。在2020年ESMO大会上,一项K药单药一线治疗PD-L1高表达(PD-L1≥50%)晚期非小细胞肺癌的KEYNOTE-024研究结果显示,中位随访59.9个月,5年OS率达到31.9%[2]。
值得注意的是,K药此次在国内获批的单药一线治疗MSI-H/dMMR转移性CRC的适应证,也是继其在晚期非小细胞肺癌、二线局部晚期和转移性食管鳞癌、转移性或不可切除的复发性头颈鳞癌治疗领域获批单药治疗精选人群适应证之后,又一个在生物标志物指导下实施精准PD-1治疗的适应证,让K药成为国内当之无愧的“精准免疫”先驱者。
KEYNOTE-177研究于2020年ASCO大会第一次发布了首次中期分析结果[5],此次2021年ASCO发布的研究结果也更新了主要终点PFS数据,以及ORR和安全性等次要终点的数据分析结果[2]:
K药治疗组的中位PFS为16.5(5.4-38.1)个月,约是化疗对照组(8.2个月)的两倍, (HR=0.59; 95%CI 0.45-0.79; P=0.0002) ;
K药治疗组的最终确定ORR为45.1%(20例CR, 49 例PR),对照组为33.1%(6例CR,45例PR);
K药治疗组的中位缓解时间(DOR)未达到(2.3+ to 53.5+),对照组为10.6个月(2.8 to 48.3+);
K药治疗组3级以上治疗相关不良事件(TRAE)发生率为21.6%,对照组为66.4%。
此次中国获批的适应证在MSI-H/dMMR基础上进行了更精准的人群细分,这更有助于找到最有可能得到长期生存获益的人群。
KEYNOTE-177的亚组分析结果显示,在KRAS或NRAS野生型的MSI-H/dMMR人群中,死亡风险降低幅度相较于总体人群更显著,达到45%(图3),提示越精准筛选人群,越能发挥免疫治疗带来的生存获益优势[2]。
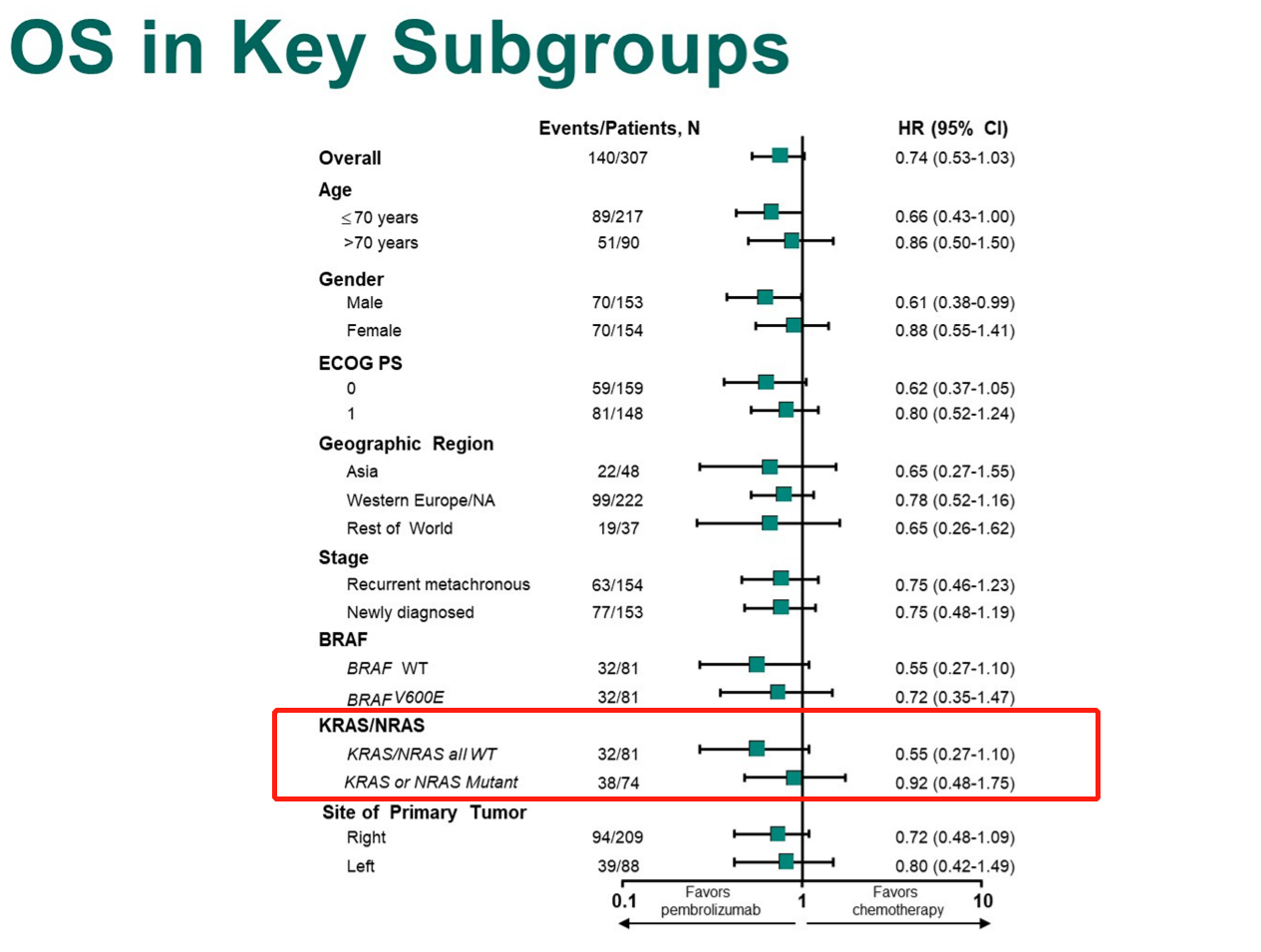
图3:KEYNOTE-177 亚组OS分析结果[2]
相信此次K药适应证的获批意味着国内KRAS、NRAS和BRAF基因均为野生型,不可切除或转移性MSI-H/dMMR这部分经过精准筛选的CRC患者,不仅有机会从K药治疗中获得长期生存,甚至还有得到“临床治愈”的可能,而且还能享受到“去化疗”后的高质量生存。
参考文献
[1] Dung T. Le et al. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med 2015; 372: 2509-2520, DOI: 10.1056/NEJMoa1500596.
[2] Thierry Andre et al. Final overall survival for the phase III KN177 study: Pembrolizumab versus chemotherapy in microsatellite instability-high/mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC). 2021 ASCO Abstract 3500, www.asco.org
[3] Long GV., Long-Term Survival From Pembrolizumab Retreatment: Phase 3 KEYNOTE-006 in Advanced Melanoma, 2020 ASCO, Oral Presentation.
[4] Brahmer JR,et al.KEYNOTE-024 5-year OS update:First-line(1L) pembrolizumab(pembro) vs platinum-based chemotherapy(chemo) in patients(pts) with metastatic NSCLC and PD-L1 tumour proportion score (TPS) ≥50%[EB/OL].ESMO 2020,abstract LBA51.
[5] Thierry Andre, First-line therapy of pembrolizumab versus standard of care (SOC) in microsatellite instability-high/mismatch repair deficient metastatic colorectal cancer: The phase III, KEYNOTE-177 study. ASCO 2020, LBA4.
查看更多