查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





来自:国际脑血管病高峰论坛
由中华医学会神经病学分会、中华医学会神经病学分会神经血管介入协作组共同推出的《脑血管造影术操作规范中国专家共识》,已于2018年1月在《中华神经科杂志》刊出。 以下为共识全文,以飨读者。
脑血管造影术由葡萄牙医生EgasMoniz于1927年首次在人体成功实施[1, 2]。最初需要直接暴露颈动脉[3, 4]或经皮穿刺颈动脉[5]、椎动脉[6]注射造影剂,此后引入经皮动脉穿刺置鞘技术(Seldinger穿刺法)[7]和数字减影血管造影(digital subtraction angiography, DSA)[8],逐步发展为今天成熟的经皮动脉插管脑血管造影术(以下简称DSA)。这一方法最初用来探查颅内占位性病变。CT、MRI等无创影像检查手段出现后,DSA主要用于评估脑血管的异常。目前CTA、MRA基本能够获得完整的头颈部血管图像,但是,DSA可以动态观察脑血流和侧支循环,并可同期完成介入治疗,仍是其他检查手段无法替代的重要方法。为规范脑血管造影术的操作流程,中华医学会神经病学分会组织部分国内专家,根据国内外流程规范和文献,制定此项专家共识,以供临床参考。
术前评估与准备
一、适应证与禁忌症
DSA适应证:①怀疑血管本身病变或寻找脑血管病病因;②怀疑脑静脉病变;③脑内或蛛网膜下腔出血病因检查;④头面部富血性肿瘤术前检查;⑤了解颅内占位病变的血供与邻近血管的关系及某些肿瘤的定型;⑥实施血管介入或手术治疗前明确血管病变和周围解剖关系;⑦急性脑血管病需动脉溶栓或其他血管内治疗;⑧头面部及颅内血管性疾病的治疗后复查。
DSA禁忌证:①碘造影剂过敏或不能耐受;②介入器材过敏;③严重心、肝、肾功能不全;④穿刺点局部感染;⑤并发脑疝。特殊情况可各方讨论,知情同意采取个体化处理。
二、术前准备
1. 掌握一般情况
DSA术前应掌握患者的临床资料,包括现病史和既往史,尤其是有无造影剂过敏史。术前对患者进行查体,有助于在术中术后对比观察神经功能变化。了解股动脉、足背动脉的搏动情况,如有异常建议完善下肢血管超声或CTA。拟行桡动脉穿刺者,需行桡动脉触诊和Allen试验[9]。
术前完善患者的血常规、凝血功能、肝肾功能等。如果已有血管超声、TCD、CTA等血管检查结果,结合临床资料初步判断责任血管,以便术中着重观察。如果已有主动脉弓结构信息,可在造影前预判可能的解剖变异或路径困难,提前做好介入器材和技术准备[10]。
2. 知情同意
DSA术前需要向患者及家属充分告知检查的必要性、简要操作过程,造影期间需要配合医生的注意事项、术中术后可能的不适感、可能的并发症及相应处理方案。在取得患者和/或家属的同意后,签署知情同意书。
3. 药物调整
长期服用抗凝药物的患者,在DSA术前如何调整抗凝治疗方案,目前还缺乏研究结论。理论上,口服抗凝药物会增加DSA等介入检查(治疗)的出血风险以及出血后处理的困难;术前直接停药,又可能增加围手术期发生栓塞事件的风险。对于一般手术,需要暂时停用口服抗凝药。通常在术前5天左右停用华法林,并使INR降低至1.5以下[11];如存在较高血栓栓塞风险,也可使用低分子肝素或普通肝素过渡治疗[12]。对于血管内介入操作(如冠脉造影及介入治疗、起搏器植入术等),多项研究显示继续口服华法林是安全的,并不会增加出血风险[13-15]。2016年欧洲房颤管理指南认为绝大部分心血管介入操作都能在不停用华法林的情况下可以安全实施[15]。因此,我们建议根据患者个体情况进行风险-获益评估,来决定术前是否停用华法林。
二甲双胍是目前治疗2型糖尿病的主要药物之一,本身并非肾毒性药物,与碘造影剂也没有相互作用。二甲双胍主要经肾脏排泄,能抑制肝脏中乳酸转化为葡萄糖,导致乳酸蓄积甚至乳酸酸中毒。一旦发生造影剂肾病,将会产生二甲双胍的累积和潜在的乳酸酸中毒风险,进一步加重肾脏损害。目前美国放射学会[16]、欧洲泌尿生殖放射学会[17]均建议肾功能正常者造影前不必停用二甲双胍。结合我国相关共识[18],我们建议:肾功能正常的患者,造影前不需要停用二甲双胍,但使用造影剂后应在医生的指导下停用二甲双胍2-3天,复查肾功能正常后可继续用药;肾功能异常的患者,使用造影剂前2天暂时停用二甲双胍,之后还需停药2-3天,复查肾功能正常后可继续用药。
4. 其他
通常在造影手术前会要求患者禁食数小时。但是,DSA一般在局麻下进行,发生恶心呕吐的可能性极小,吸入性肺炎更加罕见[19, 20]。建议清醒且配合的患者一般不必要术前禁饮食。
股动脉穿刺者建议双侧腹股沟区备皮。如果预计手术时间较长或术后不能配合平卧位排尿,可以提前留置导尿。术前需建立静脉通道。
术中流程
一、术中管理
大多数患者DSA术中不需要全麻,最低程度的镇静治疗缓解患者的紧张情绪即可。可在术前肌肉注射苯巴比妥,或术中静脉注射咪达唑仑/地西泮。术中监测患者的生命体征,包括血压、心率、呼吸、脉氧。
为避免动脉穿刺置鞘处以及血管内的导丝、导管形成血栓,除活动性脑出血急诊造影等病因外,大部分DSA中应给予抗凝药物。通常选择普通肝素。成年患者可首先给予半量肝素化(30-40 U/Kg)静脉推注,之后每隔1小时追加肝素1000U。术中经导管持续灌注肝素生理盐水(2-5 U/ml)。对于刚完成静脉溶栓,准备桥接介入治疗的患者,造影时不再需要肝素静脉推注[21],但仍应给予持续导管内肝素生理盐水灌洗。
造影剂建议使用非离子型碘造影剂,可显著减少过敏反应和肾毒性。使用前可将造影剂预热至37°以降低粘稠度[22, 23]。有报道碘克沙醇和碘海醇在碘含量140-150 mg/ml时仍能获得满意的造影图像[24]。需要控制造影剂用量时,宜将造影剂稀释后使用[25]。
二、动脉穿刺置鞘
Seldinger穿刺技术及其改良方法操作简便,损伤小,同期置入血管鞘可避免反复置入造影导管损伤血管,目前已成为DSA的基本操作技术。股动脉是脑血管介入诊疗的最常用途径。股动脉不适合穿刺时,也可根据经验选择桡动脉[26, 27]或肱动脉[28, 29]作为穿刺点。相比股动脉,经桡动脉穿刺可降低冠脉介入治疗后的穿刺点出血并发症[30, 31]。但尚无对照研究比较血管入路对脑血管造影相关并发症的影响。
股动脉穿刺置鞘操作要点:①定位:优先选择右侧股动脉,在腹股沟韧带股动脉搏动最明显处下方1.5-2cm处为穿刺点;②消毒:双侧股动脉穿刺区域碘伏消毒两遍,范围:上界为脐平面,下界为大腿下1/3处,外侧界为腋中线延长线,内侧界为大腿内侧中线。首先消毒穿刺处,最后消毒会阴部;③麻醉:以利多卡因在皮肤穿刺点(外口)和股动脉穿刺点(内口)两侧逐层浸润麻醉;④穿刺:在外口作一与腹股沟方向大致平行的2-3 mm皮肤切口,右手拇指和食指持血管穿刺针,针与皮面成约30-45°,缓慢进针,针尖接近股动脉时可感到搏动感。若为单壁穿刺,继续推送穿刺针至穿透前壁,尾端鲜红色动脉血持续搏动性涌出为穿刺成功;若使用透壁穿刺法,则穿透血管前后壁,拔去针芯,缓慢后退穿刺针套管至尾端动脉血持续涌出为穿刺成功;⑤置入导丝:换用左手持针,右手将J型导丝自尾端送入股动脉内,撤去穿刺针,左手随即压迫内口以防出血;⑥置鞘:以肝素盐水纱布擦拭导丝,通过导丝置入动脉鞘-鞘芯组件,到位后撤去导丝和鞘芯;⑦冲洗:以注射器回抽动脉鞘,回血良好确认在动脉内,注入肝素盐水冲洗动脉鞘。
桡动脉穿刺置鞘通常选择患者右臂以便于术者操作,根据弓上大血管形态和介入诊疗需要也可选择左侧入路。通常选择桡骨茎突近端1-2 cm桡动脉搏动最明显处为穿刺点[26],操作步骤基本同上。
三、主动脉弓造影
在DSA开展的初期,有观点认为弓上大血管开口处病变可能性低、且主动脉弓造影剂用量大,主动脉弓造影可以略去[32]。随着造影技术的进步以及对安全性更高的要求,目前认为主动脉弓造影可以初步评估颅内外总体血管情况,便于寻找弓上血管开口和选择合适的导管,为DSA提供便利。主动脉弓造影通常使用直径0.035’’亲水导丝和带侧孔的Pigtail导管。采用自动注射方式,将导管尾端直接连接于DSA高压注射器的压力延长管。造影投射位置和高压注射器设置见表1和表2。
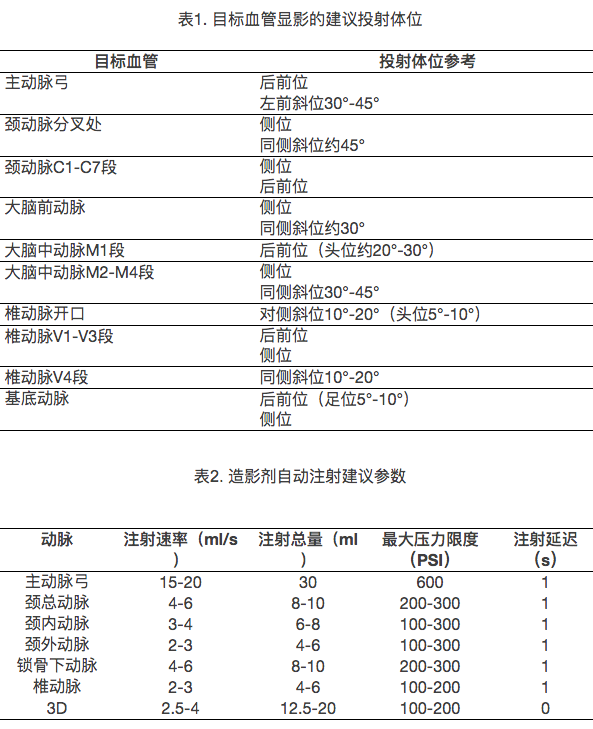
四、选择性血管造影
标准的脑血管造影包括双侧颈内动脉+双侧椎动脉的四血管造影,有时为明确颅外动脉代偿或排除硬脑膜动静脉瘘等,还需做包括双侧颈外动脉的六血管造影。但是,为减少导丝触碰动脉斑块导致斑块脱落的风险,大部分情况下,双侧颈总动脉+双侧锁骨下动脉的四血管选择性造影足以清晰地观察颅内外血管。
通常使用0.035’’亲水导丝和单一弯曲造影导管(如Vertebral导管)可完成四血管造影。操作要点:①连接:单弯导管内衬导丝,尾端连接Y形阀,并通过三通管连接加压滴注和高压注射器,排净管道内气体;②导管到位:导管在造影导丝的指引下经过主动脉弓进入升主动脉,退出导丝,边旋转导管边缓慢后撤,直到导管头端弹入弓上一级血管开口,这时前送导丝,使导丝的支撑力足以支撑前送导管,并且使导丝头端保持在安全范围内,固定导丝,沿导丝缓慢前送导管。颈动脉造影时,导管头端应放置在颈总动脉分叉段以下2-3 cm处;锁骨下-椎动脉造影时,导管头端应放置在锁骨下动脉距离椎动脉开口1-2 cm处;③造影:造影投射位置和高压注射器设置见表1和表2。导管头端位于主动脉弓一级分支血管的造影习惯称为选择性血管造影。进入二级甚至三级分支血管时称为超选择性血管造影,如颈内动脉和椎动脉。这些分支血管管径较小,建议在选择性造影的路图指引下将导丝准确送入目标血管,然后将造影导管与目标血管保持同轴,向前送至适宜造影的稳定位置。操作中需注意:
①超选择性造影前需谨慎评估目标血管管径,迂曲程度等,结合超选择性造影的必要性综合判断。若血管开口存在斑块或狭窄,慎行超选择性造影。
②超选择性造影目标血管更易受损,推送导丝应轻柔,并结合适度旋转,避免造成血管夹层。
③若目标血管存在严重狭窄或动脉瘤,多种投影位置显影效果不佳,可尝试3D成像以获得更全面的影像。
五、复杂血管造影
脑血管造影常伴有动脉迂曲,增大介入操作难度。可通过如下方法完成选择性造影:
①髂动脉或腹主动脉迂曲,严重影响导管操控性,可改用长血管鞘拉直迂曲血管,增强操控性。
②目标血管开口扭曲、成角较大,导丝难以进入,可使用导丝塑形技术增大导丝头端弯曲角度。
③目标血管远端迂曲,导丝可通过但导管前送困难,可尽量将导丝送至血管远端相对安全区域,如送至颈外动脉或腋动脉,推送导管时可稍加旋转,也可要求患者将头部转向对侧以减少张力。
④牛型主动脉弓,导管能搭在头臂干开口,但导丝在左侧颈总动脉前送困难,可嘱患者向右侧转头,或在前送导丝时轻轻咳嗽。
⑤II型主动脉弓,导管难以搭在头臂干内,不能为导丝输送提供足够的支撑力,可考虑使用头端弯曲部分更大的Hunterhead导管。
⑥III型主动脉弓或II型主动脉弓合并牛型弓,可考虑使用Simmons复合弯曲导管,利用髂动脉、左侧锁骨下动脉或主动脉瓣塑形导管,完成选择性造影[25, 33]。切勿过度旋转导管以免导管打结。
⑦若血管过于迂曲,应避免使用一种方法长时间反复尝试;在改变操作方法、更换介入材料后,导丝导管仍不能到位,应及时终止操作以免徒增并发症。
六、其他辅助检查方法
1. 压力导丝技术
压力导丝是直径为0.014’’,头端嵌入压力传感器的微导丝,可以直接评估血流压力。Pijls在1995年提出了血流储备分数(fractional flow reserve, FFR)的概念[34],指狭窄病变远端血管所能获得的最大血流量与正常管径下所能获得的最大血流量的比值。最大充血状态下,血流量之比可以转化为压力之比,即Pd/Pa,其中Pd表示最大充血状态下狭窄病变远端的冠脉压力,Pa表示主动脉压力。目前,FFR已成为临床诊断冠心病功能性狭窄的标准方法[35, 36]。国内已有单位将压力导丝技术应用在脑血管造影中[37, 38],成功测定颅内动脉狭窄患者的静息态Pd/Pa。简要操作流程:使用6F指引导管,头端置于目标血管的近端。将压力导丝沿指引导管送至目标血管近端,在导管口和狭窄近端分别测定压力值,校正一致后作为Pa;再将导丝送至狭窄病变远端,记录压力值Pd。血管迂曲时可使用微导管辅助输送压力导丝。在没有血管扩张的情况下,静息态Pd/Pa的生理意义不能等同于FFR,其临床应用价值还有待进一步研究。
2. 光学相干断层扫描(OCT)技术
OCT利用波长为1300 nm左右的近红外光,对血管壁进行横断位成像,分辨率可达到10-20 μm。近年来一些小样本的临床研究已初步证实了OCT在颈动脉造影评估中的安全性和有效性。OCT能够识别颈动脉的斑块性质,如脂质、薄帽纤维斑块、钙化和巨噬细胞成分等,筛选出常规DSA难以识别的易损斑块[39-41];在颈动脉支架术后,OCT也能够检查支架-血管壁关系[42, 43],观察支架梁的贴壁情况,识别组织脱垂、边缘夹层和支架内血栓形成[44],为补救治疗提供指征。操作流程:使用6-8F指引导管,头端置于目标血管的近端,保持同轴。校准OCT导管后,内衬0.014’’导丝,将OCT导管近段标记点送至病变远端10 mm处,手动推注3-5 ml造影剂排净OCT导管内血液。然后经指引导管注射造影剂(速度8 ml/s,总量15 ml)冲洗血管,OCT导管回撤同时采集图像。
术后及并发症处理
一、术后处理
拔鞘后手工按压仍是封闭股动脉穿刺点的最主要方法。可用鱼精蛋白中和肝素后拔出动脉鞘,也可等待肝素代谢清除后拔鞘。按压时,手指着力点位于股动脉穿刺内口或其近端,同时注意暴露外口,以便观察有无活动性出血。按压时间一般为10-20分钟,解除压力后确认外口无渗血,才可将无菌敷料置于内口上,以弹力绷带交叉加压包扎,继续沙袋压迫穿刺点6-8小时。压迫过程中定时观察敷料是否干燥,伤口有无渗血肿胀,以及足背动脉搏动情况,以便及早发现出血等并发症并及时处理。患者平卧位,穿刺侧下肢制动24小时。
手工按压止血法下肢制动时间长,易出现排尿困难和背部酸痛等不适。为提高患者术后舒适度,或对于一些不能配合制动的患者,也可使用血管闭合器。血管闭合器种类较多,原理不一,通过缝线、金属夹或胶原海绵快速闭合动脉穿刺口,止血过程简便,患者可更早下床活动,穿刺点并发症发生率与手工按压大致相当[45, 46]。注意使用血管闭合器前需行股动脉造影,明确股动脉穿刺处的位置、管径、有无粥样硬化和钙化斑块,确定是否适于使用闭合器。
桡动脉穿刺点拔鞘后可使用手工按压或压迫器压迫止血。
脑血管造影术后建议给予“水化”以促进造影剂排泄。注意观察并记录患者生命体征,包括头晕、头痛、恶心、呕吐等全身症状,以及失语、肌力下降、癫痫等神经系统症状,并及时处理。
二、并发症处理
脑血管造影术并发症包括神经系统并发症、局部或周围血管并发症、穿刺点并发症和造影剂并发症等。其中神经系统并发症发生率可达1.3%-2.63%[47, 48]。患者年龄、基础疾病及手术时间与并发症密切相关。
1. 短暂性脑缺血发作和脑梗死
术中血管壁斑块脱落、导管内血栓形成、气体栓塞等可造成缺血性脑卒中。预防方法包括:穿刺成功后给予全身肝素化,预防导管壁血栓形成;造影次序严格按照主动脉弓、弓上大血管及其分支超选择造影,禁止导管或导丝超越血管壁斑块,防止斑块破损或附壁血栓脱落;仔细检查并排空管道中的空气,预防气栓的发生;当证实远端血管出现栓塞时,根据病情给予溶栓或机械取栓;当患者出现气栓时,可给予高压氧治疗[49]。
2. 皮质盲
皮质盲表现为双眼视力丧失,瞳孔对光反射正常,也可伴有遗忘、肢体偏瘫、头痛等其他症状[50],多见于椎动脉造影后,其他脑血管或冠脉造影后也可出现[51]。发病机制与脑血管痉挛、血脑屏障破坏有关,可能是一种与可逆性后部白质脑病综合症类似的疾病类型[52]。脑血管造影后的皮质盲无特效处理,需完善头颅影像学检查排除后循环脑栓塞,可适当补液,促进造影剂排泄,同时给予血管解痉药物。皮质盲通常预后良好,数小时或数天内可完全恢复。
3. 动脉夹层
发生于股动脉或髂动脉的夹层多由于穿刺针或导管、导丝进入内膜下而未及时发现,因内膜破口位于血管夹层的远心段,而血管夹层位于近心段,为逆行夹层,不易继续扩大,一般数小时或数天后可自行愈合。如血管夹层延伸过深可能累及对侧大血管供血,应及时行局部血管造影,必要时请外科协助处理。
发生于弓上血管的动脉夹层为顺行夹层,应立即暂停介入操作,数分钟后行造影检查。如果未引起明显的管腔狭窄,血管壁没有明显的造影剂滞留,可不需要特殊处理。如果管腔血流受到明显影响,可以考虑给予支架置入。
4. 血管迷走反射
拔除血管鞘、手工按压、加压包扎时刺激周围血管,患者可出现迷走神经反射,主要表现为血压下降、心率下降,患者可有冷汗、苍白、四肢湿冷迷走神经反射症状。当高龄、心脏功能不全患者出现迷走神经反射时,可危及生命。处理方法为解除血管刺激、静脉推注阿托品,并适当补充血容量,必要时应用血管活性药物如多巴胺升压。
5. 血肿形成
腹股沟局部血肿是最常见的穿刺点并发症。原因包括:凝血功能异常或使用了抗凝药物;术中反复穿刺股动脉,或穿刺时刺穿股动脉并同时累及股动脉的分支;术后股动脉穿刺处压迫止血方法不当、时间不足,及患者出现剧烈咳嗽、便秘等腹压增加症状;穿刺侧下肢过早负重活动等。预防方法包括:术前明确患者无凝血功能障碍,根据手术时间合理控制肝素用量;尽量减少股动脉穿刺次数;术后按压部位准确,按压时间不少于15分钟;嘱患者避免剧烈咳嗽,卧床时间不小于24小时。少量出血可用机械压迫法处理。血肿多为自限性,可自行吸收。
6. 假性动脉瘤
股动脉穿刺后,血液可通过损伤的壁破裂口进入血管周围组织,形成腔隙,造成假性动脉瘤[53]。收缩期动脉血液可经过瘤颈部流向瘤腔。舒张期血液可回流至动脉内。假性动脉瘤的原因包括:穿刺次数过多;穿刺部位偏低,股动脉偏细,致使穿刺损伤相对较大;血管周边软组织较多,不易压迫止血;动脉鞘尺寸较大等。大部分假性动脉瘤可在超声定位下局部对瘤颈部加压包扎,复查超声了解瘤体闭塞情况,3-5天后瘤腔可以闭合;部分难以压迫闭塞的假性动脉瘤可在超声引导下瘤腔内注射凝血酶;少数情况下可使用覆膜支架将假性动脉瘤闭塞,或行外科手术切除或修补。
执笔:叶瑞东、孙文、刘新峰
专家委员会成员名单 (按姓氏拼音排列):
曹文锋(江西省人民医院)、陈国华(武汉市第一医院)、崔丽英(中国医学科学院北京协和医院)、樊小兵(南京军区南京总医院)、方玲(福建医科大学附属第一医院)、高连波(中国医科大学附属第四医院)、高小平(湖南省人民医院)、郭富强(四川省人民医院)、韩云飞(南京军区南京总医院)、黄家星(香港中文大学威尔士亲王医院)、黄一宁(北京大学第一医院)、柯开富(南通大学附属医院)、李宝民(中国人民解放军总医院)、李敏(南京军区南京总医院)、林航(南京军区福州总医院)、刘建林(西安交通大学第一附属医院)、刘鸣(四川大学华西医院)、刘新峰(南京军区南京总医院)、刘新通(广东省第二人民医院)、刘亚杰(南方医科大学珠江医院)、刘煜敏(武汉大学中南医院)、刘运海(中南大学湘雅医院)、陆正齐(中山医科大学第三附属医院)、骆翔(武汉同济医院)、马敏敏(南京军区南京总医院)、缪中荣(北京天坛医院)、牛国忠(杭州市第一人民医院)、蒲传强(中国人民解放军总医院)、秦超(广西医科大学附属第一医院)、石进(中国人民解放军空军总医院)、宋永斌(兰州军区乌鲁木齐总医院)、孙文(南京军区南京总医院)、孙钦建(山东省立医院)、汪谋岳(中华医学会中华神经科杂志编辑部)、王守春(吉林大学第一医院)、吴伟(山东大学齐鲁医院)、徐格林(南京军区南京总医院)、徐浩文(郑州大学第一附属医院)、谢鹏(重庆医科大学)、叶瑞东(南京军区南京总医院)杨清武(第三军医大学新桥医院)、殷勤(南京军区南京总医院)、岳炫烨(天津医科大学总医院)、张苏明(华中科技大学同济医学院附属同济医院)、张光运(第四军医大学西京医院)、张晓龙(复旦大学附属华山医院)、张勇(青岛大学附属医院)、郑洪波(四川大学华西医院)、周华东(第三军医大学大坪医院)、周志明(皖南医学院附属弋矶山医院)、朱良付(河南省人民医院)、朱武生(南京军区南京总医院)
参考文献:
[1] Moniz Z.Injections Intracarotidiennes et Substances Injectables Opaques aux Rayons X[J]. Presse méd, 1927, 35): 969.
[2] Moniz Z.Cerebral Angiography. Its Application in Clinical Practice and Physiology [J].Lancet, 1933, 222(5751): 1144-1147.
[3] Bull JW.The history of neuroradiology [J]. Proceedings of the Royal Society ofMedicine, 1970, 63(6): 637-643.
[4] Lima A.Egas Moniz 1874-1955 [J]. Surgical neurology, 1973, 1(5): 247-248.
[5] Lindgren E.The technique of direct (percutaneous) cerebral angiography [J]. The Britishjournal of radiology, 1947, 20(236): 326-331.
[6] Sugar O,Holden LB, Powell CB. Vertebral angiography [J]. The American journal ofroentgenology and radium therapy, 1949, 11(2): 166-182.
[7] SeldingerSI. Catheter replacement of the needle in percutaneous arteriography; a newtechnique [J]. Acta radiologica, 1953, 39(5): 368-376.
[8] Pelz DM,Fox AJ, Vinuela F. Digital subtraction angiography: current clinicalapplications [J]. Stroke, 1985, 16(3): 528-536.
[9] GreenwoodMJ, Della-Siega AJ, Fretz EB, et al. Vascular communications of the hand inpatients being considered for transradial coronary angiography: is the Allen'stest accurate? [J]. J Am Coll Cardiol, 2005, 46(11): 2013-2017.
[10] 李晓青. 缺血性脑血管病介入治疗:入门与进阶 [M]. 世界图书出版公司, 2014.
[11] Douketis JD,Spyropoulos AC, Spencer FA, et al. Perioperative management of antithrombotictherapy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: AmericanCollege of Chest Physicians Evidence-Based Clinical Practice Guidelines [J].Chest, 2012, 141(2 Suppl): e326S-e350S.
[12] 国家卫生计生委脑卒中防治工程委员会. 中国心房颤动患者卒中防治指导规范 [M]. 2015.
[13] KowalewskiM, Suwalski P, Raffa GM, et al. Meta-analysis of uninterrupted as compared tointerrupted oral anticoagulation with or without bridging in patientsundergoing coronary angiography with or without percutaneous coronaryintervention [J]. International journal of cardiology, 2016, 223: 186-194.
[14] Jamula E,Lloyd NS, Schwalm JD, et al. Safety of uninterrupted anticoagulation inpatients requiring elective coronary angiography with or without percutaneouscoronary intervention: a systematic review and metaanalysis [J]. Chest, 2010,138(4): 840-847.
[15] Kirchhof P,Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrialfibrillation developed in collaboration with EACTS [J]. Eur Heart J, 2016,37(38): 2893-2962.
[16] MediaACODaC. ACR Manual on Contrast Media [M]. Version 102. American College ofRadiology. 2016.
[17] Stacul F,Van Der Molen AJ, Reimer P, et al. Contrast induced nephropathy: updated ESURContrast Media Safety Committee guidelines [J]. Eur Radiol, 2011, 21(12): 2527-2541.
[18] 母义明, 纪立农, 宁光, 等. 二甲双胍临床应用专家共识(2016年版) [J]. 中国糖尿病杂志, 2016, 24(10): 871-884.
[19] Kwon OK, OhCW, Park H, et al. Is fasting necessary for elective cerebral angiography? [J].AJNR Am J Neuroradiol, 2011, 32(5): 908-910.
[20] Hamid T,Aleem Q, Lau Y, et al. Pre-procedural fasting for coronary interventions: is ittime to change practice? [J]. Heart, 2014, 100(8): 658-661.
[21] 中华医学会神经病学分会, 中华医学会神经病学分会神经血管介入协作组. 急性缺血性脑卒中早期血管内介入治疗流程与规范专家共识 [J]. 中华神经科杂志, 2017, 50(3): 172-177.
[22] DavenportMS, Wang CL, Bashir MR, et al. Rate of contrast material extravasations andallergic-like reactions: effect of extrinsic warming of low-osmolalityiodinated CT contrast material to 37 degrees C [J]. Radiology, 2012, 262(2):475-484.
[23] 陈韵岱, 陈纪言, 傅国胜, 等. 碘对比剂血管造影应用相关不良反应中国专家共识 [J]. 中国介入心脏病学杂志, 2014, 22(6): 341-348.
[24] Kendall BE,Sheppick A, Nossen JO, et al. Iodixanol in intra-arterial cerebral digitalsubtraction angiography: a comparison with iohexol [J]. Neuroradiology, 1995,37(7): 512-514.
[25] Morris P.Practical Neuroangiography [M]. Lippincott Williams & Wilkins, 2013.
[26] Satti SR,Vance AZ, Sivapatham T. Radial access for cerebrovascular procedures: Casereport and technical note [J]. Interv Neuroradio, 2016, 22(2): 227-235.
[27] Nohara AM,Kallmes DF. Transradial cerebral angiography: technique and outcomes [J]. AJNRAm J Neuroradiol, 2003, 24(6): 1247-1250.
[28] Touho H,Karasawa J, Shishido H, et al. Transbrachial artery approach for selectivecerebral angiography in outpatients [J]. AJNR Am J Neuroradiol, 1988, 9(2):334-336.
[29] Barnett FJ,Lecky DM, Freiman DB, et al. Cerebrovascular disease: outpatient evaluationwith selective carotid DSA performed via a transbrachial approach [J].Radiology, 1989, 170(2): 535-539
[30] Jolly SS,Amlani S, Hamon M, et al. Radial versus femoral access for coronary angiographyor intervention and the impact on major bleeding and ischemic events: asystematic review and meta-analysis of randomized trials [J].Am Heart J, 2009, 157(1):132-140
[31] Rao SV,Cohen MG, Kandzari DE, et al. The transradial approach to percutaneous coronaryintervention: historical perspective, current concepts, and future directions[J]. J Am Coll Cardiol, 2010, 55(20): 2187-2195.
[32] Caplan LR,Wolpert SM. Angiography in patients with occlusive cerebrovascular disease:views of a stroke neurologist and neuroradiologist [J]. AJNR Am J Neuroradiol,1991, 12(4): 593-601
[33] 刘新峰. 脑血管病介入治疗学 [M]. 2 ed.: 人民卫生出版社, 2012.
[34] Pijls NH,Van Gelder B, Van Der Voort P, et al. Fractional flow reserve. A useful indexto evaluate the influence of an epicardial coronary stenosis on myocardialblood flow [J]. Circulation, 1995, 92(11): 3183-3193.
[35] MontalescotG, Sechtem U, Achenbach S, et al. 2013 ESC guidelines on the management ofstable coronary artery disease: the Task Force on the management of stablecoronary artery disease of the European Society of Cardiology [J]. Eur Heart J,2013, 34(38): 2949-3003.
[36] Kushner FG,Hand M, Smith SC, Jr., et al. 2009 focused updates: ACC/AHA guidelines for themanagement of patients with ST-elevation myocardial infarction (updating the2004 guideline and 2007 focused update) and ACC/AHA/SCAI guidelines onpercutaneous coronary intervention (updating the 2005 guideline and 2007focused update) a report of the American College of CardiologyFoundation/American Heart Association Task Force on Practice Guidelines [J]. JAm Coll Cardiol, 2009, 54(23): 2205-2241.
[37] Han YF, LiuWH, Chen XL, et al. Severity assessment of intracranial large artery stenosisby pressure gradient measurements: A feasibility study [J]. Catheter CardiovascInterv, 2016, 88(2): 255-261.
[38] Miao Z,Liebeskind DS, Lo W, et al. Fractional Flow Assessment for the Evaluation ofIntracranial Atherosclerosis: A Feasibility Study [J]. Interv Neurol, 2016,5(1-2): 65-75.
[39] Setacci C,De Donato G, Setacci F, et al. Safety and feasibility of intravascular opticalcoherence tomography using a nonocclusive technique to evaluate carotid plaquesbefore and after stent deployment [J]. J Endovasc Ther, 2012, 19(3): 303-311.
[40] Shindo S,Fujii K, Shirakawa M, et al. Morphologic Features of Carotid Plaque RuptureAssessed by Optical Coherence Tomography [J]. AJNR Am J Neuroradiol, 2015,36(11): 2140-2146.
[41] Given CA,2nd, Attizzani GF, Jones MR, et al. Frequency-domain optical coherencetomography assessment of human carotid atherosclerosis using saline flush forblood clearance without balloon occlusion [J]. AJNR Am J Neuroradiol, 2013,34(7): 1414-1418.
[42] Liu R, JiangY, Xiong Y, et al. An Optical Coherence Tomography Assessment of Stent StrutApposition Based on the Presence of Lipid-Rich Plaque in the Carotid Artery[J]. J Endovasc Ther, 2015, 22(6): 942-929.
[43] De Donato G,Setacci F, Sirignano P, et al. Optical coherence tomography after carotidstenting: rate of stent malapposition, plaque prolapse and fibrous cap ruptureaccording to stent design [J]. Eur J Vasc Endovasc, 2013, 45(6): 579-587.
[44] 郭志良, 俞书红, 陈昕, 等. 应用光学相关断层成像快速诊断颈动脉支架内血栓一例 [J]. 中华神经科杂志, 2016, 49(3): 247-248.
[45] Schulz-SchupkeS, Helde S, Gewalt S, et al. Comparison of vascular closure devices vs manualcompression after femoral artery puncture: the ISAR-CLOSURE randomized clinicaltrial [J]. JAMA, 2014, 312(19): 1981-1987.
[46] Robertson L,Andras A, Colgan F, et al. Vascular closure devices for femoral arterialpuncture site haemostasis [J]. Cochrane Database Syst Rev, 2016, 3: CD009541.
[47] WillinskyRA, Taylor SM, Terbrugge K, et al. Neurologic complications of cerebralangiography: prospective analysis of 2,899 procedures and review of theliterature [J]. Radiology, 2003, 227(2): 522-528.
[48] Kaufmann TJ,Huston J, 3rd, Mandrekar JN, et al. Complications of diagnostic cerebralangiography: evaluation of 19,826 consecutive patients [J]. Radiology, 2007,243(3): 812-819.
[49] HeisermanJE, Dean BL, Hodak JA, et al. Neurologic complications of cerebral angiography[J]. AJNR Am J Neuroradiol, 1994, 15(8): 1401-1411.
[50] Zwicker JC,Sila CA. MRI findings in a case of transient cortical blindness after cardiaccatheterization [J]. Catheter Cardiovasc Interv, 2002, 57(1): 47-49.
[51] 王虎清, 李燕玲, 张晓娜, 等. 神经系统血管造影术后皮质盲患者临床分析 [J]. 卒中与神经疾病, 2013, 5): 297-9.
[52] Saigal G,Bhatia R, Bhatia S, et al. MR findings of cortical blindness following cerebralangiography: is this entity related to posterior reversibleleukoencephalopathy? [J]. AJNR Am J Neuroradiol, 2004, 25(2): 252-256.
[53] Stone PA,Campbell JE, Aburahma AF. Femoral pseudoaneurysms after percutaneous access[J]. J Vasc Surg, 2014, 60(5): 1359-1366.
查看更多