查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





现在对于肺癌的治疗,最多的是精准治疗,精准治疗里面要找到引起肺癌发病的驱动基因。靶向治疗就是根据驱动基因找到靶点以后进行治疗。
那么,非小细胞肺癌(NSCLC)患者如何选择靶向治疗方案?下面这个病例,希望对你有所启示。
患者,女,初诊年龄45岁,既往体健,否认吸烟史。2016年8月9日因咳嗽入院,行胸部CT(图1A)提示右肺上叶结节影,大小27 mm × 25 mm,分叶状,周围可见毛刺;双肺弥散分布粟粒状小结节影。2016年8月18日行活检(右上肺占位):腺癌,以腺泡状及乳头状生长方式为主;免疫组织化学:ALK-Ventana(-),ROS-1(弱+,40%)。基因检测(ARMS法)示EGFR(19外显子缺失突变)丰度4%,KRAS未见突变。完善分期检查后诊断为右肺上叶周围型腺癌,cT1N0M1a,Ⅳa期。
2016年8月31日开始口服吉非替尼(250 mg,qd)治疗,最佳疗效疾病稳定(SD),无进展生存(PFS)期为7个月,服药期间出现皮疹3级,肝功能损伤1级,脱发1级,对症处理后好转。
2017年3月12日复查胸CT示双肺及胸膜弥漫粟粒样结节较前增多、增大(图1B)。考虑疾病进展。血液基因检测(ARMS法)示EGFR无突变。2017年3月23日开始行培美曲塞+卡铂方案化疗4个周期,2个周期评效SD,4个周期后评效疾病进展(大脑、小脑新发多发转移,图1C,图2A)。
2017年7月1日再次行血液EGFR基因检测(ARMS法)示EGFR 19外显子缺失突变、EGFR 20外显子T790M突变。2017年7月10日开始口服奥希替尼(80 mg,qd)治疗,最佳疗效SD,PFS为5个月(图1D),患者脑转移在奥希替尼治疗后完全消失,且在后续随访过程中未再出现脑部病灶。
2017年12月发现双侧乳腺肿物,并进行性增大(图1E,图2B)。2018年2月7日行超声引导下双侧乳腺肿物+腋窝淋巴结活检,病理示少许低分化癌浸润,免疫组织化学支持肺腺癌转移,ER(−),PR(−),HER-2(+),Ki-67(50%~75%,+),TTF-1(+), NapsinA(+),GATA3(−),ALK-Ventana(−)(图3)。
乳腺肿物基因检测提示EGFR 19外显子缺失突变、c-MET基因扩增(二代测序,MET拷贝数=6),未见其他基因突变/扩增/融合。2018年2月口服奥希替尼(80 mg,qd)联合卡博替尼(40 mg,qd),最佳疗效SD,皮疹3度,对症处理后疗效不佳,2018年9月改为克唑替尼(250 mg,bid),最佳疗效SD(图1F),口服5月后再次出现皮疹3级,不能耐受停药。停药后颈部、乳腺肿块逐渐增大。后行白蛋白紫杉醇+贝伐珠单抗化疗4个周期。化疗后最佳疗效SD(图1G),目前在定期随访中,未见疾病进展征象,末次复查时间2020年11月(图1H,图2C),治疗经过见图4。
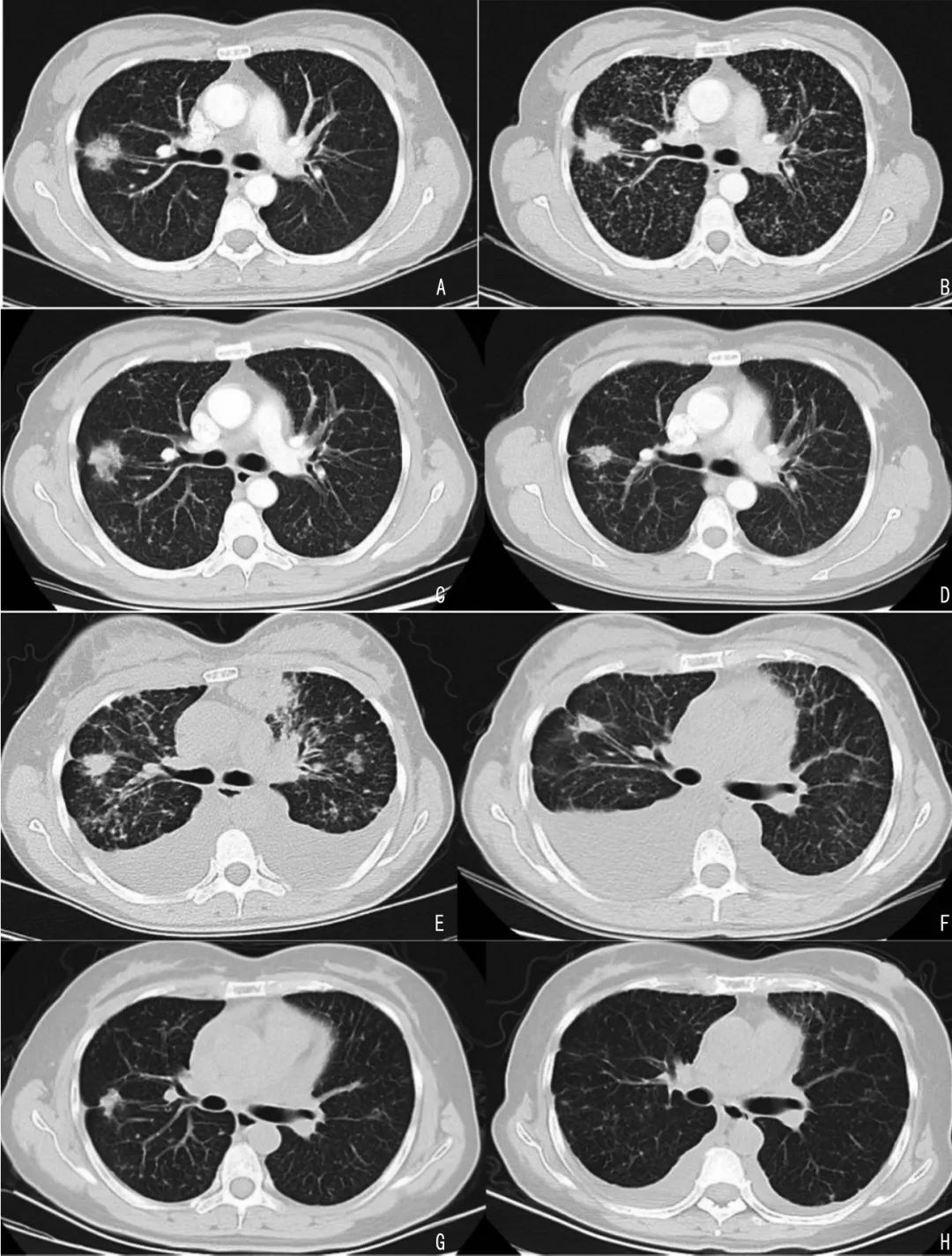
图 1 肺部病灶治疗前后影像
A:2016年8月初治;B:吉非替尼治疗后进展;C:二线化疗4个周期复查;D:奥希替尼治疗后2个月复查;E:奥希替尼治疗后进展;F:奥希替尼+卡博替尼治疗后复查;G:白蛋白紫杉醇化疗4个周期复查;H:2020年11月定期随访
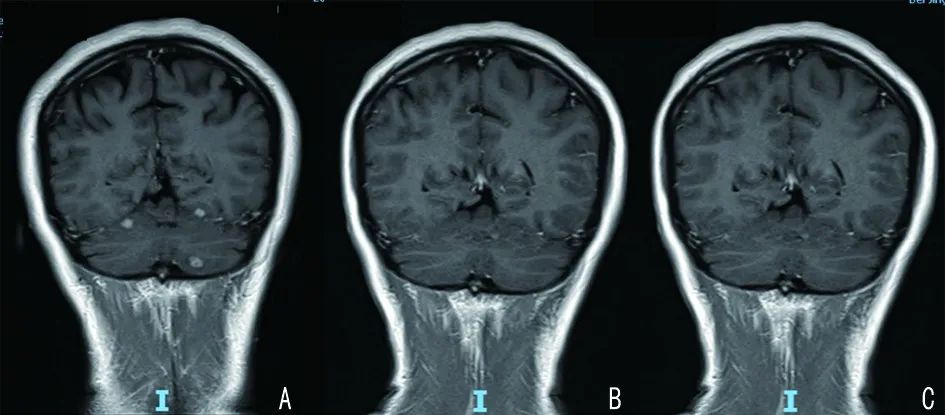
图 2 脑部病灶治疗前后影像
A:二线化疗后;B:奥希替尼治疗后;C:2020年11月定期随访
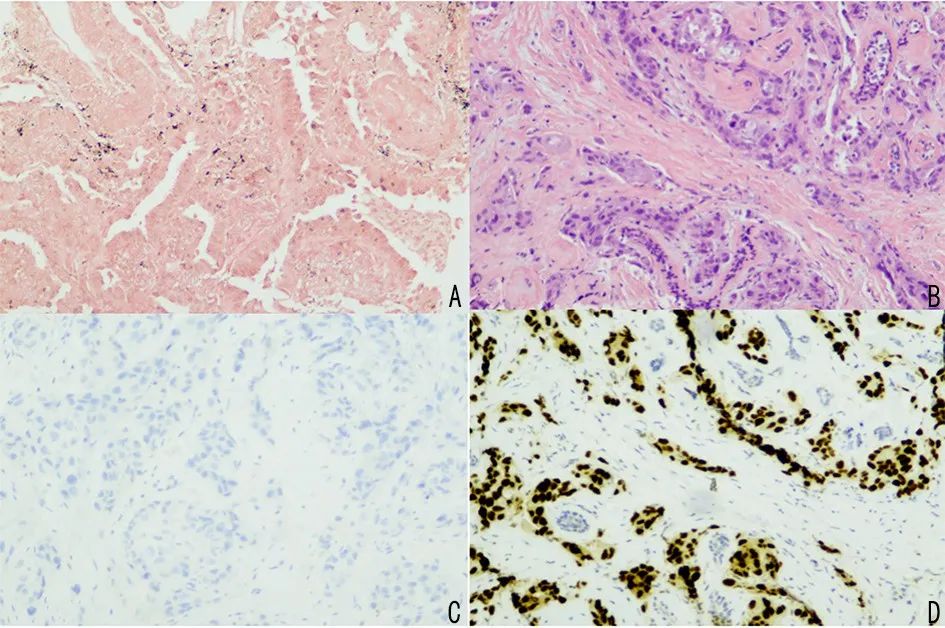
图 3 肺癌原发灶及乳腺转移癌病理检测
A:肺原发灶(H&E×100);B:乳腺转移灶(H&E×100);C:乳腺转移灶(GATA3×100);D:乳腺转移灶(TTF-1×100)
本例患者为EGFR突变型晚期肺腺癌患者,经过多线治疗后目前已获得4年以上生存。
患者初诊时肿瘤组织存在预后相对较好的EGFR19外显子缺失的敏感突变,根据中国临床肿瘤学会(CSCO)指南可选择的治疗模式包括一、二、三代单药表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),EGFR-TKI联合贝伐珠单抗或EGFR-TKI联合化疗。
但在2016年可选择的治疗方式并不多,OPTIMAL、WJTOG3405研究分别表明厄洛替尼、吉非替尼对比化疗治疗EGFR突变晚期非小细胞肺癌(NSCLC)患者,能够显著延长中位PFS期(厄洛替尼:13.1个月对4.6个月;吉非替尼:9.2个月对 6.3个月)。EURTAC Ⅲ期试验也显示,厄洛替尼对比化疗治疗EGFR阳性NSCLC患者的中位PFS期更长(9.7个月 对5.2个月)。
本例患者一线接受吉非替尼治疗仅获得SD最佳疗效,PFS期为7个月,与多个Ⅲ期临床试验的中位PFS(9~13个月)存在差距,考虑患者肿瘤组织中EGFR突变丰度为4%,属于偏低的水平,可能是疗效欠佳的原因之一;另外,不除外患者在初治时即合并伴随基因如c-MET扩增、TP53突变、PTEN突变或程序性死亡因子配体1(PD-L1)高表达等不良预后因素,但由于当时检测手段的局限性,该患者并未进行多基因测序及PD-L1表达的检测。
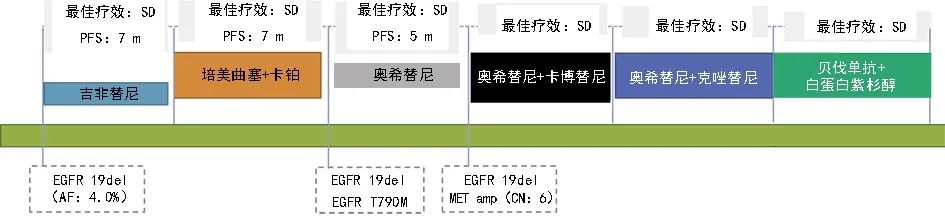
图 4 治疗经过总结
患者二线治疗接受了标准含铂双药化疗后出现全脑多发转移,与EGFR-TKI耐药后二线应用化疗相关临床研究的PFS数据基本一致。而脑局部进展可能与化疗药物无法透过血脑屏障相关。考虑患者在化疗耐药后检测到T790M突变,奥希替尼对于脑转移效果佳,客观缓解率(ORR)高达70%,且患者并无脑转移症状,因此在三线选择了单药奥希替尼治疗,而未联合脑局部放疗。
患者在奥希替尼耐药后进行基因检测,发现EGFR 19外显子缺失敏感突变仍然存在,同时合并c-MET基因扩增。MET扩增是奥希替尼最为常见的耐药机制之一,占7%~24%。
MET属于肝细胞生长因子受体,具有酪氨酸激酶活性,参与细胞信息传导、细胞骨架重排的调控,是细胞增殖、分化和运动的重要因素。MET扩增可导致PI3K通路激活和肿瘤耐药。MET抑制剂可以阻断c-MET信号,双重抑制两种PI3K通路上游激活蛋白(EGFR和c-MET)可能会产生协同治疗效果。
目前已上市的多靶点MET-TKI包括卡博替尼、克唑替尼及单靶点MET-TKI如沃利替尼、卡马替尼等。目前多采用联合治疗模式以避免c-MET扩增导致奥希替尼耐药。TATTON研究显示,奥希替尼联合MET抑制剂沃利替尼对于EGFR-TKI耐药后c-MET扩增且T790M阴性患者,ORR为65%,中位PFS期为9个月。此外,SAVANNAH以及EMD Serono等多项奥希替尼联合MET抑制剂的研究也在开展中。目前,较为成熟的MET抑制剂如沃利替尼对于中国肺癌患者尚不可及。
本例患者联合方案选择了奥希替尼联合卡博替尼。卡博替尼是小分子多靶点TKI,靶点包括MET、VEGFR、ROS1、RET、AXL、NTRK、KIT,因卡博替尼为多靶点药物,故不良反应相对较大。本例患者因不能耐受卡博替尼不良反应换用克唑替尼。虽然克唑替尼获批的适应证为晚期ALK/ROS-1融合基因阳性NSCLC,但无论从基础试验还是小样本研究都证实其对c-MET扩增初步有效。但遗憾的是本例患者因不能耐受克唑替尼不良反应,在用药5个月后再次停药。
综上所述,本例患者采用奥希替尼联合c-MET抑制剂的治疗方法合理且有效。在应用两种靶向药物联合时,需注意两药是否有协同效应,更要关注两者不良反应是否存在叠加。
靶向治疗已成为晚期EGFR突变NSCLC的一线首选治疗方案,但如何针对不同的患者(如不同突变类型、肿瘤负荷、转移部位、并发症)采取最佳的治疗方案,临床上仍需根据患者自身情况进行个体化、精准化治疗。而对于奥希替尼耐药后处理,目前临床上尚无统一标准,建议完善奥希替尼耐药后二次活检,根据活检结果决定下一步治疗方案。
中国肿瘤临床 平台发布
查看更多