查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:东部战区总医院 国家肾脏疾病临床医学研究中心 全军肾脏病研究所 许书添 董建华 李世军 刘志红
病例摘要
主诉及现病史
18岁女性,因“反复腹痛、腹胀27天,发热10天”,于2017-2-10入院。
2017年1月20日出现脐周及左下腹闷痛不适,伴腹胀,逐渐停止肛门排便、排气,呕吐胃内容物,无发热。1月23日就诊当地医院,胃镜示慢性浅表性胃炎伴胆汁反流、十二指肠球部炎症,腹部平片见肠管气粪影,未见气液平,对症治疗后腹痛腹胀未缓解。1月27日查血白细胞(WBC)11.6×109/L、血红蛋白(Hb)123g/L、血小板(PLT)332×109/L,血白蛋白33.9g/L,肝肾功能正常,尿蛋白2+、尿潜血+,腹部CT见小肠壁水肿,对症治疗腹痛仍无缓解明显。2月6日出现发热,体温最高40.3℃,伴畏寒、寒战,无胸闷胸痛,无心悸,抗SSA抗体、抗核抗体阳性,补体正常,予抗感染、补液等治疗后,仍反复高热。2月9日来我院急诊,查血WBC 2.3×109/L、Hb 101g/L、PLT 105×109/L,单核细胞 2.6%,C反应蛋白(CRP)20.6mg/L,血白蛋白26.6g/L,谷丙转氨酶444U/L,谷草转氨酶713U/L,乳酸脱氢酶4271U/L,TG1.7mmol/L,前白蛋白 411mg/L,血肌酐、胰酶正常。2月10日收住消化内科。起病以来,患者禁食,睡眠欠佳,大便如上述,小便正常,体重减轻5斤。
既往史及家族史:有口腔溃疡病史半年,个人史、婚育史以及家族史无特殊。
消化科住院期间(2017-2-10~2017-2-16)
体格检查:
体温 36.9℃,脉搏 89次/分,呼吸 18次/分,血压 93/67mmHg,神志清楚,精神可,巩膜无黄染,全身淋巴结未扪及肿大,心肺查体阴性,腹膨隆,腹软,脐周压痛,肠鸣音正常(5次/分),移动性浊音阴性,双下肢无浮肿。
实验室检查:WBC 0.6×109/L、Hb 97g/L、PLT 76×109/L,IL-6 60.25ng/L,CRP38.7mg/L,降钙素原9.43ug/L,凝血酶原时间15.1s,活化部分凝血酶时间测定 43.8s,D-二聚体>40mg/L,纤维蛋白(原)降解产物 945ug/mL,纤维蛋白原(Fib)2.77g/L,TG 2.28mmol/L;尿蛋白+、尿红细胞及白细胞阴性;ANA 1:320,A-dsDNA阴性,A-SSA、A-Ro52、A-GAB(抗小肠杯状细胞抗体)均阳性,补体C3 0.603g/L;铁蛋白>1500ug/L;异型淋巴细胞6%;骨髓细胞学示吞噬细胞占1%,组织细胞占5.5%(图 1);甲型和乙型流感病毒抗原、出血热特异性抗体、结核感染T细胞、血培养均阴性;
辅助检查:颅脑、胸部、腹部CT未见明显异常。
治疗经过:入院后予奥硝唑、泰能抗感染,退热、抑酸、营养支持等治疗,自行排便排气,但仍有发热,体温波动在37~41℃,血三系进行下降。2月12日下午高热41℃时突发意识不清、呼之不应、全身肌肉强直、牙关紧闭、眼球上翻,无大小便失禁,予气管插管接呼吸机辅助呼吸,苯巴比妥镇静,甲泼尼龙160mg静滴。2月13日停奥硝唑、泰能,予万古霉素、伏立康唑、阿昔洛韦抗感染,经全院病例讨论后诊断为"系统性红斑狼疮(SLE)、噬血细胞综合征(HPS)”,予甲泼尼龙500mg×3天,丙种球蛋白(20g×5天),美罗培南抗感染,体温逐渐降至正常(图2)。2月15日拔除气管插管。2月16日腹痛缓解,血WBC升至4.6×109/L,PLT升至109×109/L,CRP下降,甲泼尼龙减量至250mg/d。2月16日转入肾脏科。
肾脏科住院期间(2017-2-16~2017-3-14)
体格检查
体温36.1℃,脉搏121次/分,呼吸30次/分,血压119/69mmHg;神清,精神差,全身皮肤满布透明水泡;双侧球结膜出血;口唇皲裂;呼吸频数,双肺和心脏听诊阴性;腹软,脐周压痛,肠鸣音正常;双下肢不肿。
实验室检查
尿液 尿蛋白定量1.33g/24h(尿量4700ml/24h),尿红细胞和尿糖阴性。尿NAG 62.4U/g.cr、RBP8.6mg/L、尿NGAL 3259.1ng/mL。
血液 WBC 4.5×109/L、单核细胞 23.2%、N 67.7%、L 8.7%、PLT 109×109/L、Hb 102g/L、Ret 1.62%;Alb 32g/L、Glo 41g/L、ALT 238U/L、AST 81U/L、BUN 9md/dl、Scr0.33 md/dl、UA 52mmol/L、LDH 1173U/L、Ca 2.04mmol/L、P 0.5mmol/L、余电解质基本正常,PRO-BNP 399.9pmol/L、CRP 1.1mg/L、PCT 0.459ug/L,D-二聚体 2.49mg/L、Fib 1.17g/L。血异型淋巴细胞比例2%;铁蛋白>1500.0ug/L,可溶性白介素2受体1507U/ml;NK细胞活性 14.17%(正常值 >15.11%)
免疫学抗核抗体 1:320,补体C3 0.6g/L、C4 0.13g/L;RO-52+++、SS-A+++;狼疮抗凝因子、抗心磷脂抗体、抗β2-糖蛋白1抗体和抗中性粒细胞胞浆抗体阴性;IgG 27.7g/L、IgA 2.02g/L、IgE 52.1IU/ml、IgM 0.823g/L。淋巴细胞免疫分型:CD19+ 159.00个/ml、CD3+ 701个/ml、CD4+ 357个/ml、CD8+ 322个/ml。自免肝相关抗体:抗丙酮酸脱氢酶复合物E2亚单位三联体抗体弱阳性、抗线粒体抗体2型弱阳性。甲状腺功能正常,抗甲状腺球蛋白抗体(TgAb)、甲状腺过氧化物酶抗体(TPOAb)、促甲状腺激素受体抗体(TRAb)均阳性。
病原体检查 结核感染T细胞检测阴性;抗EB病毒壳抗原(VCA)抗体IgG 3+,抗EBVCA-IgA阴性,抗EBVCA-IgM阴性,抗EB病毒早期抗原(EA)IgG抗体 1+, 抗EB病毒核抗原(NA)IgG抗体 1+;EB病毒DNA 4.44×103copies/ml。CMV-DNA阴性。
其他:大便隐血阴性。
辅助检查
双肾B超:左肾118 mm×53 mm×59mm,右肾121 mm×49 mm×60mm,双肾肾盂肾盏扩张,输尿管上段扩张,左右侧宽均为5mm。心脏超声:未见明显异常。头颅和腰椎MRI平扫未见异常。
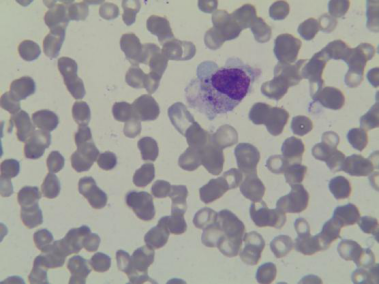
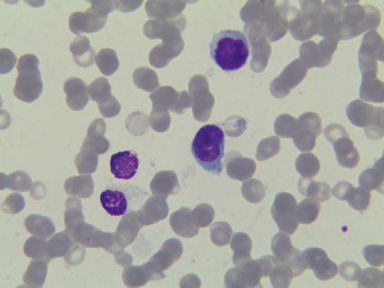
图 1 骨髓细胞学检查: A吞噬细胞占1%,组织细胞占5.5%。吞噬细胞内可见成熟红细胞、幼红、血小板、分叶核粒细胞(如箭头所示)。B 异常淋巴细胞占 2.5%(如箭头所示)
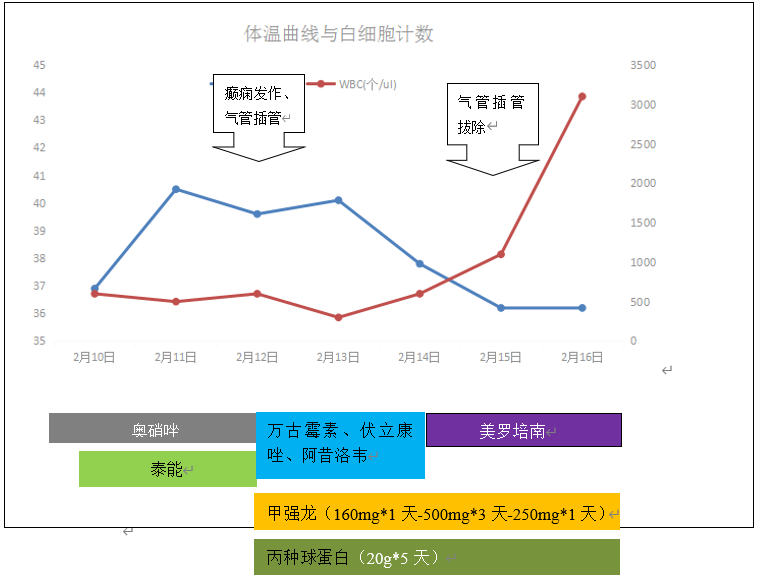
图2 药物治疗与体温、白细胞计数变化曲线图
诊断(1)SLE合并MAS(累及胃肠道、肝脏、血液、肾脏、输尿管和中枢神经系统 DAI 17分)狼疮性肾炎;假性肠梗阻;(2)EB病毒感染;
治疗及随访
2月16日转入肾脏科重症监护病房,予甲泼尼龙80mg/日,辅以抗感染、护肾、护胃等治疗;体温持续正常,CRP降至正常,血三系升高,皮肤水疱消退。3月14日出院,予强的松45mg/日+环孢素A100mg/日治疗。3月29日复查,予甲泼尼龙12mg Qd+环孢素A 50mg Q12h,尿蛋白转阴,尿红细胞18.2/ml,血常规、肝肾功能正常,ANA 1:256,补体C3略低。4月12日复查穿孔素蛋白在NK细胞上表达仍低于正常范围,EB病毒-DNA<500copies/ml,CD107α激发实验提示NK细胞脱颗粒功能正常,提示该患者无遗传性HLH的基因背景,因此不必完善HLH分子遗传学检查,而证明本例患者为获得性HLH,而非原发性HLH。
诊疗分析
本例患者临床特点如下:(1)青少年女性,病程短,起病急;(2)临床表现为多系统受累,累及消化系统、血液、肾脏、输尿管和中枢神经系统。消化系统起病:肠梗阻、肝酶升高,肝脾不大;血液系统损害:血象三系进行性减少。肾脏表现为少量尿蛋白和镜下血尿;输尿管表现为肾盂积水和输尿管上段扩张;神经系统表现为癫痫发作;肾外表现为发热(弛张热)、口腔溃疡、充血性皮疹、球黏膜出血;同时伴有多种自身抗体阳性和补体低下。本例患者符合1997年美国风湿协会关于系统性红斑狼疮(SLE)诊断标准。
除了SLE诊断明确,该患者还有几点特殊之处:(1)增多:外周血查异淋6%,骨髓细胞学提示异淋4%;(2)单核细胞比例升高:最高23.2%,EB病毒抗体阳性及EB病毒DNA阳性,提示EB病毒感染再激活;(3)铁蛋白>1500mg/l;(4)TG 逐渐升至2.28mmol/l;(5)Fib逐渐低至<1.5g/l;(6)骨髓可见吞噬细胞1%;(7)低钠血症;因此患者病因需要考虑以下几种可能。
HPS(亦称为噬血细胞性淋巴细胞增多症,HLH) 根据2004年修订的HLH的标准(见表1),该患者满足上述8条中6条,故HLH诊断成立。2009年美国血液病学者在HLH-2004诊断标准的基础上,做了适当的修改,根据此标准本例患者符合其中9条,也完全符合HLH临床诊断。
SLE并发巨噬细胞活化综合征
该患者系SLE并发HLH,属于自身免疫性疾病范畴,因此称为SLE并发巨噬细胞活化综合征(macrophage activation syndrome,MAS),其诊断标准见(表1),临床标准至少1条加上实验室标准至少2条即可确诊。显然该患者可诊断为SLE并发MAS。
神经精神性狼疮
该患者病程中癫痫发作,当时体温高达41℃,且期间使用泰能抗感染,因此需与高热惊厥和药物性癫痫相鉴别。高热惊厥一般好发于有高热家族史的6岁以下儿童,但该患者系18岁女性,且首次高热并未惊厥,不符合高热惊厥。另外,自1984年首次报道泰能诱发药物性癫痫以来,国内外陆续有报道泰能致药物性癫痫的病例报道。一般认为泰能诱发癫痫的机制可能与激活兴奋神经元,抑制g氨基丁酸介导的抑制性神经传导通路有关。该患者在癫痫发作前行头颅CT检查未见明显颅内占位性等器质性病变,且停用泰能后,癫痫未再发作,因此不能完全除外药物性癫痫。但是,该患者为狼疮活动时癫痫发作,且大剂量激素冲击治疗有效,因此临床考虑SLE合并神经精神性狼疮。此外,由于患者首先符合SLE合并MAS,从一元论角度考虑,SLE并发癫痫发作可归因于MAS诊断。
SLE并发假性肠梗阻
青年狼疮患者,以典型的肠梗阻起病,有肠道动力障碍的影像学证据,如肠腔明显扩张、肠壁水肿等,但未见到“靶征”和肠系膜充血水肿“栅栏”征象,因此不考虑狼疮肠系膜血管炎。另外,该患者无机械性肠梗阻表现,病程中腹痛、腹胀自行缓解,给予激素治疗后未再次发作;且双肾超声提示肾盂积水、输尿管扩张。这些临床表现均符合狼疮并发假性肠梗阻。
EB病毒感染
该患者入院后持续高热,血、尿、粪等病原体检查均阴性,仅呼吸道病原体抗体检查结果提示EBVCA-IgG、EA-IgG以及NA-IgG均阳性,提示EBV感染再激活状态,加之异型淋巴细胞和单核细胞升高,更提示病毒感染。因此进一步送检EB病毒载量,结果发现EB病毒高度水平复制,证明EB病毒感染。
表1 噬血细胞综合征以及SLE并发MAS诊断标准
2004年修订版HPS诊断标准 | SLE并发巨噬细胞活化综合征(MAS) |
满足以下2条之一者可确定HPS诊断 | 符合SLE诊断标准,并同时满足至少1条临床指标和至少2条实验室指标 |
1、发现HLH相关的分子遗传学异常,结合临床即可诊断:如PRF1、UNC13D、STXBP2等基因突变。 | 满足临床指标(至少1条) |
2、满足以下8条中的5条 | 1、发热>38℃ |
发热:持续7天,最高体温≧38.5℃; | 2、肝脏肿大(肋下 ≧3cm) 3、脾脏肿大(肋下 ≧3cm) |
脾大≧肋下3cm; | 4、出血表现 |
血细胞减少(两系或三系):WBC <1.0×109/L,Hb<90g/L,PLT<100×109/L; | 5、神经系统功能障碍 |
高三酰甘油(又称甘油三酯,TG)(禁食后≧3.0mmol/L或265mg/dL)血症和(或)Fib(≦1.5g/L)血症; | 满足实验室指标(至少2条) |
骨髓、脾或淋巴结发现噬血细胞,无恶性病证据; | 1、血象两系或三系减少(WBC ≤4.0×109/L,Hb≤90g/L 或PLT ≤150×109/L); |
NK细胞活性降低或完全缺失; | 2、谷草转氨酶(AST) >40U/l; |
血清铁蛋白(≧500ug/L); | 3、乳酸脱氢酶(LDH)>567U/L; |
可溶性CD25(IL-2受体)增高(≧2400U/ml) | 4、纤维蛋白原(Fib)≤1.5g/dl; |
5、TG >178mg/dL(2.0mmol/L); | |
6、铁蛋白 >500ug/L; | |
组织病理学指标(仅对可疑患者检查骨髓细胞):骨髓有噬血细胞; |
HPS:噬血细胞综合征;SLE:系统性红斑狼疮;MAS:巨噬细胞活化综合征;TG:三酰甘油;Fib:纤维蛋白原;WBC:白细胞计数;Hb:血红蛋白
讨论
概述
HPS又称HLH,是由多种潜在病变引起淋巴细胞和组织细胞非恶性增生,产生细胞因子风暴所致的一种临床综合征。根据发病原因的不同,HLH可分为原发性和获得性。原发性HLH常见于2岁以内儿童,获得性HLH多见于成人,常继发于感染(EB病毒、CMV病毒、细菌、结核等)、恶性肿瘤、风湿性疾病和器官移植术后,其中风湿性疾病相关的HLH在获得性HLH中占有重要地位,也称为MAS。
SLE合并MAS发病机制
SLE并发MAS的发病率为0.9%~4.6%,自身免疫性疾病相关的MAS病死率高达46%。其病理机制可能包括:自身抗体介导噬血现象;免疫复合物沉积在骨髓造血细胞;原始未控制的T细胞活化致细胞因子(如IL-1、IL-6)过度分泌。自身抗体和(或)免疫复合物致骨髓造血细胞对巨噬细胞敏感性增强,导致无法控制的噬血现象。T细胞分泌的细胞因子除参与上述过程外,还增加巨噬细胞活性。在SLE相关MAS患者出现无法控制的噬血现象主要是由于自身反应性淋巴细胞或同时发生的感染使得内在的狼疮相关的巨噬细胞功能出现紊乱和恶化。
SLE合并MAS与EB病毒感染之间的关系
本例狼疮患者特殊之处在于同时并发MAS和EB病毒感染。EB病毒感染疾病主要包括传染性单核细胞增多症(IM)、慢性活动性EBV感染(CAEBV)以及EBV 相关噬血淋巴组织细胞增生症( EBV-HLH),根据IM和EAEBV诊断标准,该患者明显均不符合。但患者既符合EB病毒感染,又符合HLH诊断标准,因此需考虑诊断EBV-HLH。此外,EB病毒可诱发SLE活动或复发,而EB病毒感染和SLE二者均是获得性HLH的原因,究竟是EB病毒诱发HLH还是EB病毒诱发狼疮活动并发HLH,其先后关系以及因果关系很难阐明清楚,但唯一清楚的是,本例先以假性肠梗阻起病,继发EB病毒感染以及HLH等一系列临床表现。有研究发现SLE患者外周血经常有大量EB病毒感染细胞,且证实其跟疾病发作有必然联系。因此可以推测EB病毒感染是SLE一个重要的诱发因素,最后促发假性肠梗阻和HLH等狼疮活动。
SLE合并MAS治疗方案
目前有关SLE并发MAS的治疗主要参照HLH-2004方案。MAS主要治疗糖皮质激素单药或联合环孢素治疗。本例治疗的难点在于狼疮活动需使用大剂量激素,但是使用大剂量激素的后果会加重感染或使病情恶化。因此本例治疗方案是在大剂量激素冲击治疗时,联合使用丙种球蛋白冲击(IVIG)。尽管在病毒相关HLH治疗策略中,IVIG治疗价值仍不清楚,但一般认为IVIG有抗炎效应。另外,中枢神经系统受累的SLE患者同时合并感染时,可将IVIG作为一线用药。尽管IVIG没有直接抗病毒效应,但是其潜在的抗炎效应可以在细胞水平上抑制巨噬细胞活化、降低细胞因子活性和减轻细胞因子风暴。环孢素A对于治疗病情严重和激素抵抗患者疗效显著。环孢素A是一种强效的免疫抑制剂,对T细胞有明显的抑制作用,糖皮质激素联合环孢素可控制高细胞因子血症,在治疗风湿性疾病相关HLH中有显著疗效,早期使用可降低病死率。如患者对以上治疗反应较差时,则推荐使用HLH-2004方案。本例患者采用小剂量激素联合环孢素治疗,事实证明有利于原发病的控制和HLH的治疗。
小结
本文报道一例SLE以假性肠梗阻起病,随后并发HLH和EB病毒感染。尽管HLH确切的病因仍不知晓,但EB病毒感染再激活后同时出现狼疮活动和HLH实属罕见。SLE持续高热不缓解且血象三系进行性下降,在完善骨髓细胞学检查和排查各种感染的同时,一旦铁蛋白升高,临床需考虑HLH,立即给予大剂量激素冲击治疗原发病,如果感染持续存在或不能排除,可联合丙种球蛋白治疗。总之,早期积极有效控制细胞因子风暴和原发病是治疗SLE合并HLH的关键。
本文由作者授权中国医学论坛报发布,未经同意请勿转载
查看更多