查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





近日,PD-1抑制剂帕博利珠单抗(商品名:可瑞达®,国内俗称“K药”)获得国家药品监督管理局(NMPA)批准联合铂类和氟尿嘧啶类化疗药物用于局部晚期不可切除或转移性食管或胃食管结合部癌患者的一线治疗。K药成为首个也是目前唯一一个在国内获批一线治疗食管癌全人群的PD-1单抗。
此次获批一线治疗食管癌适应证,也是K药在食管癌治疗领域获批的第二个适应证。2020年6月,凭借全球首个二线治疗晚期食管癌的III期临床研究KEYNOTE-181的阳性数据结果[1,2],K药在国内获批单药治疗PD-1表达阳性(CPS>=10)的、既往一线全身治疗失败的、局部晚期或转移性食管鳞状细胞癌(ESCC)患者。
同时,K药也是目前国内唯一一个在同一种晚期实体瘤中同时拥有一线及二线治疗适应证的PD-(L)1单抗。
K药此次获批一线治疗适应证是基于一项著名的全球多中心、随机、双盲对照的III临床研究KEYNOTE-590的结果。在2020年欧洲肿瘤内科学会(ESMO)大会上发布的KEYNOTE-590随访10.8个月的中期分析结果显示,研究已达到设立的主要终点和次要终点:无论是在意向治疗(ITT)人群,还是食管鳞状细胞癌(ESCC),或PD-L1 CPS≥10的ITT和ESCC人群中,K药联合化疗一线治疗方案相比含铂化疗在总生存期(OS)、无进展生存期(PFS)、客观缓解率(ORR)方面都显示出了具有统计学意义的改善。
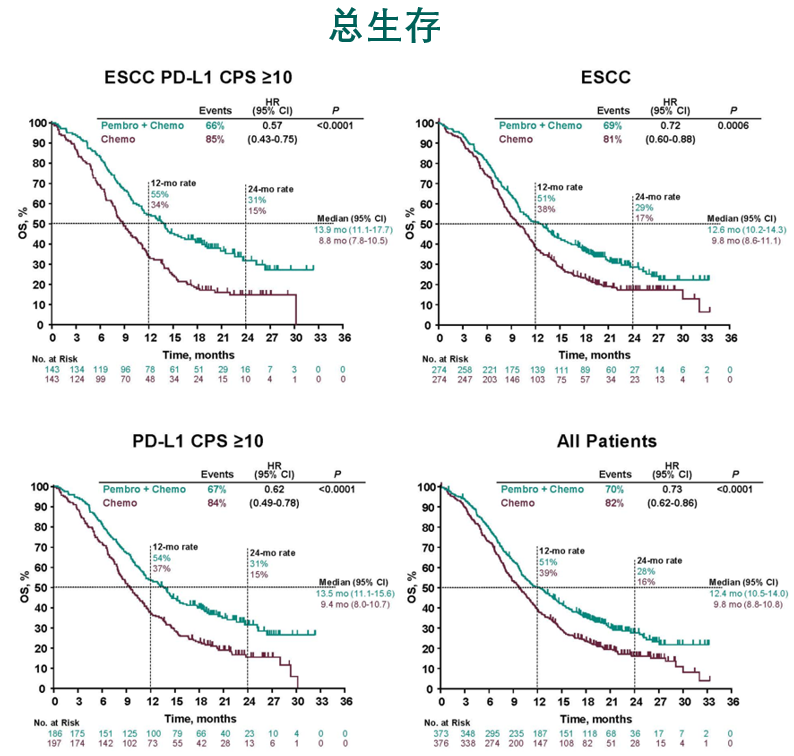
图 KEYNOTE-590:整体人群、ESCC,PD-L1 CPS≥10的ITT和ESCC人群的OS获益
KEYNOTE-590的中国亚组人群数据分析结果显示,较化疗对照组,K药联合含铂化疗一线治疗方案中位OS延长了2.5个月,降低49%的死亡风险 (HR, 0.51; 95% CI, 0.32-0.81) ,与全球数据结果一致。
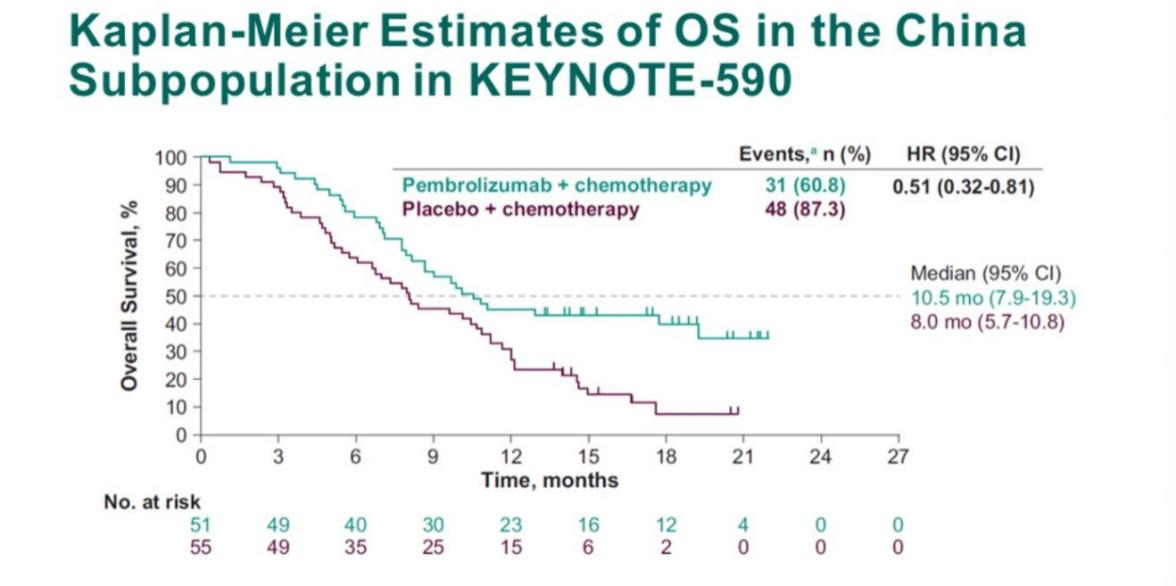
图 KEYNOTE-590中国亚组OS数据[3]
KEYNOTE-590也是全球首个显示免疫检查点抑制剂一线治疗晚期食管癌可带来显著OS获益的临床研究,为近半个世纪几乎停滞不前、以化疗为主的晚期食管癌一线治疗带来了全新的突破。
在过去几十年中,转移性食管癌一线治疗仍以5-FU或紫杉醇联合含铂化疗为主。无论采用哪种化疗方案,患者的预后都较差,OS均不超过12个月。
K药联合含铂化疗一线治疗方案为局部晚期不可切除和发生远端转移的中国食管癌治疗带来了全新选择,也势必成为晚期食管癌治疗的新标准。
《2021CSCO免疫检查点抑制剂临床应用指南》给予(且仅给予)K药联合含铂化疗方案I级专家推荐,用于一线治疗转移性食管癌(证据级别1A类)。
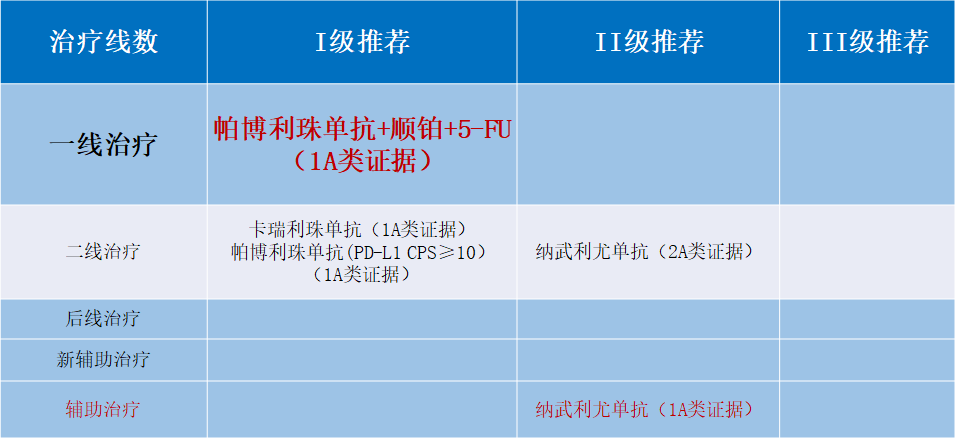
图 《2021CSCO免疫检查点抑制剂临床应用指南》对于食管癌免疫治疗的推荐意见和证据级别
值得注意的是,此次K药获批适应证没有对人群的病理分型、PD-L1表达、食管癌部位做限定,因此K药联合含铂化疗一线治疗可以用于所有局部晚期或转移性食管癌的一线治疗,无论PD-L1表达情况,也无论是食管鳞癌还是腺癌,同时还包括了胃食管结合部癌。这在扩大该方案潜在获益人群的同时,也为该治疗方案的临床实践带来了方便。
在KEYNOTE-590研究中,K药联合化疗方案的研究者评估的ORR(RECIST v1.1)达到45.0% ,显著高于化疗组的 ORR(29.3%)。在24个月时的肿瘤持续缓解人数是化疗组的3倍[1]。
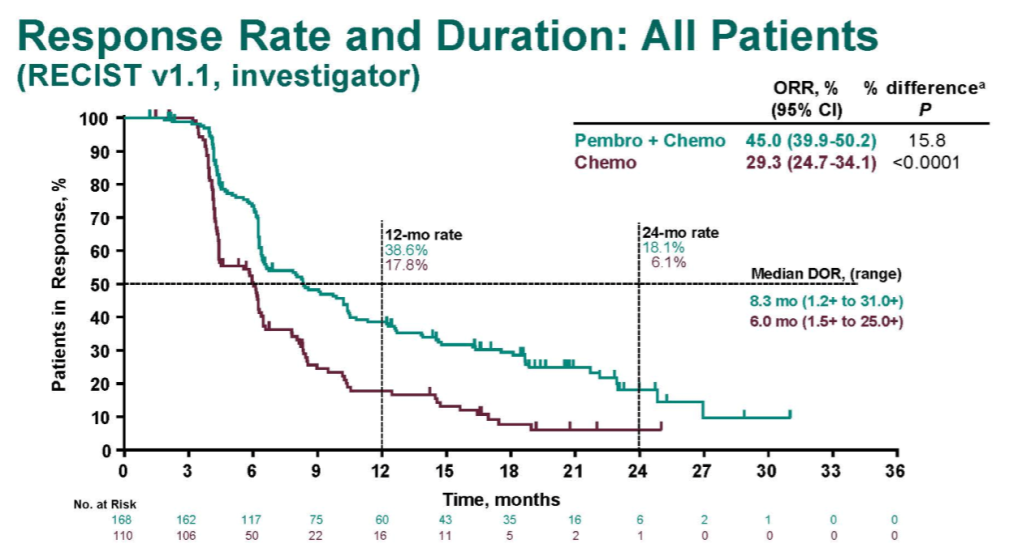
KEYNOTE-590: 整体人群的ORR和DOR[1]
KEYNOTE-590中国亚组人群数据分析结果显示,K药联合化疗方案的ORR是37.3%,比对照组20%的ORR提高了近一倍(17.3%)[3]。 值得注意的是,KEYNOTE-590入组的中国亚组人群的身体状况更差,ECOG PS 1分的患者占81.1%,比在整体人群中的占比(59.8%)高出21.3%。
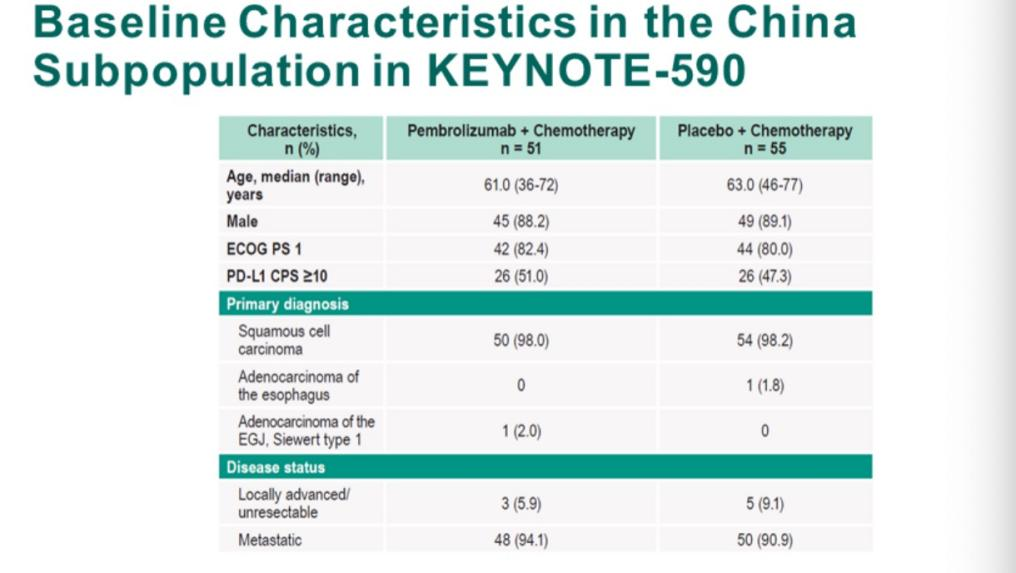
图 KEYNOTE-590入组中国人群基线特征[3]
高ORR意味着部分晚期患者可通过K药联合含铂化疗治疗获得手术切除的可能,而手术切除仍然是当前食管癌患者获得长期生存获益甚至治愈的一个最主要的手段。
K药联合化疗的ORR同样提示免疫联合化疗具有应用于可手术的局部进展期食管癌的术前新辅助治疗的潜力,有望提升MPR率或病理学完全缓解(pCR)率,助力提升R0切除率,最终降低术后复发率,尤其是那些已出现多站淋巴结转移的局部晚期食管癌患者。
食管癌是中国高发的恶性肿瘤之一[4], 2020年我国新发病例和死亡病例均占全球一半以上。我国食管癌五年生存率仅15%-20%[5]。
毫无疑问,此次K药联合含铂化疗一线治疗局部晚期不可切除和转移性食管癌适应证的获批有望改善这部分患者的长期生存。此外,K药此次适应证获批,对于在国内正在高速蓬勃发展的可手术食管癌围手术期免疫治疗将产生怎样的积极影响,以及将如何助力提升我国食管癌整体五年生存率,让我们拭目以待。
参考文献:
[1] Shah M.A, et al. Pembrolizumab versus Chemotherapy in Advanced Esophageal Cancer: Phase 3 KEYNOTE-181 Study, Oral Presentation, ASCO-GI, 2019.
[2] Chen J, et al. Pembrolizumab versus Chemotherapy in Patients With Advanced/Metastatic Adenocarcinoma or Squamous Cell Carcinoma of the Esophagus as Second-Line Therapy: Analysis of Chinese Sub-group in KEYNOTE-181, Abstract, ESMO, 2019.
[3] Li Z, et al. First-Line Pembrolizumab Plus Chemotherapy Versus Chemotherapy in Patients With Advanced Esophageal Cancer: China Subgroup Analysis of KEYNOTE-590, ASCO 2021 Abstract #4049.
[4] IARC. Globocan 2020 World.
[5] 食管癌诊疗规范(2018年版). 中华消化病与影像杂志(电子版), 9(4):35.
查看更多